对污水处理厂中大肠杆菌的四环素耐药性分析
2019-11-21毛艳萍张雅怡王越兴
毛艳萍,田 里,陈 胜,张雅怡,王越兴
1)深圳大学化学与环境工程学院,广东深圳518060;2)深圳市水务(集团)有限公司,广东深圳518000
抗生素一直被认为是20世纪的医学奇迹,现在各种抗生素已被广泛用于人类和动物的医疗,然而滥用抗生素可能会导致环境中抗生素耐药细菌(antibiotic resistant bacteria, ARB)和抗生素耐药基因(antibiotic resistance genes, ARGs)的广泛出现和传播[1].在抗生素临床应用前,微生物群体中就已经存在ARGs且来源广泛.微生物耐药性是独立于人类社会自然发生的,但在人类和动物中滥用抗生素会加速耐药性的产生[2].城市污水处理厂(sewage treatment plants, STPs)中ARB和ARGs的分布和传播是现今研究的热点之一,因为其接收了各种家庭污水和医疗废水,被认为是环境中ARB和ARGs的重要来源之一[3-4].现已在STPs中检测到携带ARGs的人或动物病原体,如具有抗生素耐药性的气单胞菌属、不动杆菌属、肠杆菌科和假单胞菌属等[5-6].LI等[7-8]研究表明,STPs显著改变了ARGs在环境中的丰度和分布,它排放的废水是ARGs在自然环境中的主要人为来源,因此STPs被认为是将ARGs传播到自然环境中的重要节点,开展STPs中抗生素耐药性的研究具有重要意义.
四环素是使用量较大的抗生素之一,持续地使用四环素导致四环素耐药细菌和耐药基因不断增加.但是,目前对四环素类抗生素在STPs中的去除的影响因素,以及对微生物群落的影响机制尚不十分明确[9-12].大肠杆菌常被用作肠源性细菌的模式菌株和粪便指示菌,被用于评估水域中微生物污染的水平[13],并被作为模式菌株来研究自然环境中的抗生素耐药性的来源及ARGs在环境微生物中的传播规律[14].研究STPs中大肠杆菌的四环素耐药性及其耐药基因情况,可指示环境中抗生素对细菌耐药性的影响.
目前,对ARGs的检测方法已从最初普通聚合酶链式反应(polymerase chain reaction, PCR)技术对少数耐药基因进行定性,到荧光实时定量PCR技术对一部分已知的耐药基因进行定量,再发展到高通量PCR技术对大量耐药基因进行高灵敏度定量分析.现有的基于高通量测序技术的宏基因组学技术,在发现新型耐药基因,发掘不可培养微生物的全部基因信息方面发挥了巨大作用[15-17].因此,越来越多针对STPs中ARGs的研究倾向于采用宏基因组学技术,或多种技术手段相结合的方法来开展[18].
本研究以中国深圳市的两座典型STPs进水和二沉池出水为研究对象,分别分离得到大肠杆菌菌株,分析各菌株在添加四环素前后培养基中的生长曲线,得到四环素的耐药菌和敏感菌,再利用PCR技术和宏基因组学方法对耐药菌和敏感菌的四环素耐药基因进行分析,探讨典型STPs不同的处理工艺对四环素耐药菌和耐药基因的传播是否存在抑制作用,从而对比两种不同工艺的处理效果.同时研究四环素耐药菌基因型与表型之间的关系,为耐药菌的快速检测提供潜在的指示性基因,也为进一步挖掘新型的耐药基因奠定基础,为污水处理系统中耐药菌的环境行为和风险评估提供参考.
1 材料与方法
1.1 水样采集
2018-03-28使用不锈钢浸入式水样采集器采集深圳市N污水处理厂和F污水处理厂的进水和二沉池出水.F厂采用改进型的A2O(厌氧-缺氧-好氧)工艺,N厂采用改进的UCT(modified University of Capetown, MUCT)工艺.每个水样采集500 mL并置于采集瓶中,采集前先用水样润洗采集器和采集瓶.水样分别标记为N污水处理厂进水(NJ)、N污水处理厂二沉池出水(NC)、F污水处理厂进水(FJ)和F污水处理厂二沉池出水(FC).水样采集完毕,用封口膜封住瓶口,立刻送回实验室,置于4 ℃冰箱中,并于24 h内开始大肠杆菌的分离培养实验.
1.2 培养基的配制
首先配置麦康凯琼脂培养基,用于分离和筛选水样中的大肠杆菌.利用电子分析天平称取12.50 g麦康凯琼脂培养基粉末,溶于250 mL超纯水中,于121 ℃的立式自动压力蒸汽灭菌器中灭菌15 min.灭菌完成后,待灭菌器与外界压力差为0时,取出培养基并置于超净工作台中冷却至约70 ℃,再往每个培养皿中倒15 mL培养基,冷却静置12 h后备用.
配置LB(Luria Broth)液体培养基用于大肠杆菌菌种的保存.分别称取胰蛋白胨(Tryptone)2.00 g、酵母提取物(Yeast extract)1.00 g和氯化钠2.00 g,并溶于200 mL超纯水中,于121 ℃灭菌20 min,所得培养基置于超净工作台中冷却至室温备用.
为检测大肠杆菌中的四环素耐药菌和敏感菌,配置质量浓度为10 mg/L四环素盐酸盐的LB液体培养基.首先配制质量浓度为400 mg/L四环素盐酸盐溶液作为母液.称取4.00 mg四环素盐酸盐粉末(Sigma,分析纯),用超纯水定容到10 mL,并经0.22 μm滤膜过滤.然后配制质量浓度为10 mg/L四环素盐酸盐的LB液体培养基,移取250 μL质量浓度为400 mg/L 四环素盐酸盐溶液于已灭菌的9 750 μL LB液体培养基中,混匀备用.
1.3 大肠杆菌的分离与保存
为分离大肠杆菌菌株,使用稀释1 000倍的NJ和FJ水样分别在装有麦康凯琼脂培养基的培养皿上涂布培养.NC和FC水样由于经过污水处理厂处理后微生物浓度大幅降低,故可直接使用未稀释的出水分别进行大肠杆菌的培养分离.分离得到的大肠杆菌菌株保存于96孔板中.在超净工作台中向96孔板每孔添加75 μL的LB液体培养基,利用已灭菌的牙签挑取培养基上分离较好的红色单菌落分别接种于96孔板中,并留出3个孔不添加菌种,作为空白对照,用封口膜封口.将96孔板置于225 r/min、37 ℃的全温振荡培养箱(上海知楚,ZQZY-70BS)中培养12 h,每个孔对应一株大肠杆菌.将50%甘油置于121 ℃的立式自动压力蒸汽灭菌器中灭菌20 min,灭菌后往每个孔添加75 μL的50%甘油,轻轻摇匀,用封口膜封口,再将96孔板置于-20 ℃ 冰箱中保存,作为母板备用.
1.4 菌种的活化与生长曲线的绘制
利用甘油保存的菌株由于生长活性被抑制,不能直接用于生长曲线实验,要先通过活化实验恢复其活性.在全新的96孔板中都添加150 μL LB液体培养基,对应地往各孔分别接种1.5 μL甘油保存的菌株,用封口膜封口,置于37 ℃的全温振荡培养箱中培养12 h.
待菌株活性恢复后,使用多功能微孔板检测仪(BioTek,Synergy HTX,美国)测其每隔30 min在600 nm处的光密度(D(600)), 连续测定12 h.培养基分别采用纯LB液体培养基和添加10 mg/L四环素盐酸盐的LB液体培养基.以时间为横坐标,D(600)为纵坐标,绘制生长曲线.所有大肠杆菌菌株在不同培养基中的生长曲线测定均做3个平行组.对比添加四环素盐酸盐溶液前后生长曲线的变化,作为判断该大肠杆菌是否具有四环素耐药性的依据.
1.5 DNA的提取和质量测定
为获取大肠杆菌的DNA,在梯度PCR仪(Biometra TOne 96G, Bio-Rad, 美国)通过95 ℃和4 ℃的预变性处理后,使用小型Sigma高速离心机以4 000 r/min离心1 min得到上清液,温度变化促使菌株破壁,将DNA释放并溶于上清液中.DNA的浓度和纯度使用多功能微孔板检测仪和核酸测定仪(Qubit 3.0,Life,美国)测定.DNA的完整性通过质量分数1%的琼脂糖凝胶电泳法测定.
1.6 四环素耐药基因的测定
利用PCR扩增法检测大肠杆菌中四环素耐药基因的分布,选择扩增的四环素耐药基因为tet(A)、tet(B)、tet(L)和tet(M). 其中,tet(A)和tet(B)是典型且检出率较高的外排泵基因,外排泵是将细胞内的毒性底物(包括大多数临床使用的抗生素)从细胞内排出到外部环境中的转运蛋白[19].tet(L)是主要存在于小的传递质粒中的典型基因,tet(M)是典型的核糖体保护蛋白的编码基因[20].本研究选择这4个耐药基因进行扩增,其引物信息如表1[21-22].本次实验PCR扩增的体系为30 μL,包括15 μL 2倍Premix、2 μL F-Primer(10 μmol/L)、2 μL R-Primer(10 μmol/L)、2 μL DNA、9 μL 水.PCR热循环过程为:首先于94 ℃预变性5 min;然后进行35个扩增循环,在每个循环中,94 ℃保持1 min,55 ℃或56 ℃退火1 min 和72 ℃ 延伸1.5 min;最后72 ℃延伸10 min.PCR扩增产物利用琼脂糖凝胶电泳法来初步判断是否存在该耐药基因目标片段.
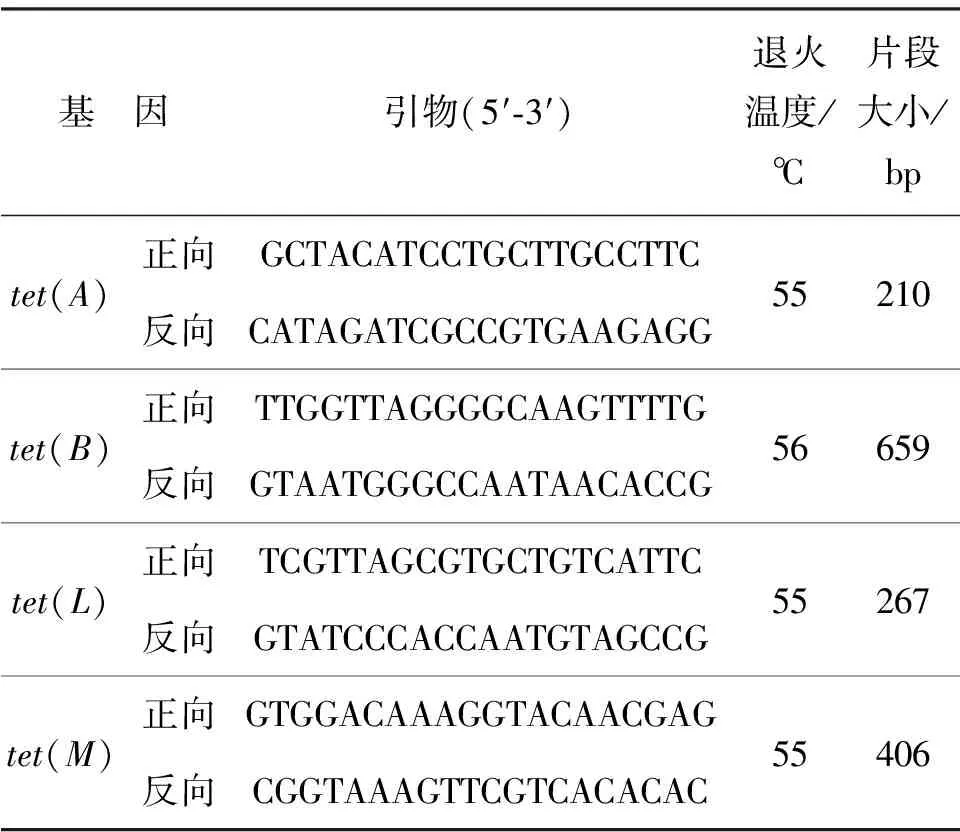
表1 四种四环素耐药基因的PCR引物的相关信息[21-22]
2 结果与讨论
2.1 大肠杆菌对四环素耐药性的表型分析
从4个水样NJ、NC、FJ和FC中分别得到86、46、88和52株大肠杆菌,使用多功能微孔板检测仪,测绘其在LB液体培养基和四环素盐酸盐质量浓度为10 mg/L的LB液体培养基的12 h生长曲线,通过对比添加四环素前后的生长曲线,分析得到NJ、NC、FJ和FC对四环素耐药性表型检出率分别为36%、4%、23%和8%.两座污水处理厂二沉池出水大肠杆菌中四环素耐药菌的检出率均明显低于进水,说明所选取的两个典型污水处理厂通过对污水进行2级处理后,能显著降低四环素耐药菌丰度,有效抑制了四环素耐药菌的传播,这与现有报道结果基本相同[25].采用MUCT工艺的FC水样四环素耐药菌检出率降低了32%;采用改进型的A2O工艺的F污水处理厂的出水四环素耐药菌检出率降低了15%,初步说明N污水处理厂的MUCT工艺,与F污水处理厂的A2O工艺相比,前者对四环素耐药菌丰度的降低和传播的抑制效果更好.
2.2 四环素耐药基因的PCR扩增结果分析
由于原水样中大肠杆菌数较多,故从NJ水样的耐药菌和敏感菌各随机挑选6株大肠杆菌,从NC水样中挑选2株耐药菌(分离到的全部耐药菌)和6株敏感菌,从FJ水样中的耐药菌和敏感菌各随机挑选6株大肠杆菌,从FC水样中挑选4株耐药菌(分离到的全部耐药菌)和6株敏感菌,共耐药菌18株和敏感菌24株,对四环素耐药基因tet(A)、tet(B)、tet(L)和tet(M)进行PCR扩增检测,再对PCR扩增产物利用琼脂糖凝胶电泳法来判断是否存在耐药基因的目标片段.四环素耐药基因分析统计结果如表2,其中检出率指含该耐药基因菌株占总菌株数的比例,阳性检出率指含该耐药基因的耐药菌株数占总耐药菌株数的比例.从表2可见,4个样品中的耐药菌普遍能检测到耐药基因,且部分耐药菌含有多个耐药基因.其中,tet(A)的阳性检出率高达77.8%,说明它作为四环素外排泵基因,可能在具有四环素抗性的大肠杆菌中广泛分布,在四环素耐药性方面起到主要作用.事实上目前已有研究得到了类似结论[26],如FAN等[27]在世界范围内广泛收集了107株耐四环素大肠杆菌分离株,采取多重PCR的方法检测四环素耐药基因,发现其中的49.5%含tet(A)基因,35.5%含tet(B)基因,5.6%含tet(C)基因,1.9%含tet(D)基因.
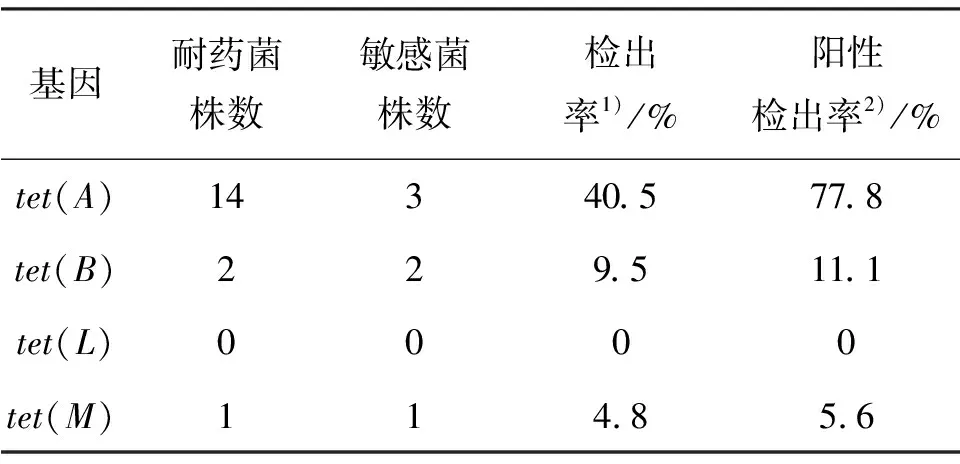
表2 四环素耐药基因分析结果统计
1)检出率指含该耐药基因菌株占总菌株数的比例;
2)阳性检出率指含该耐药基因的耐药菌株数占总耐药菌株数的比例
值得注意的是,4个样品中有7株敏感菌也检测到了耐药基因,但它们并未表现出抗性,推测其耐药基因未表达.同时,有1株耐药菌并未检测到耐药基因,这可能是因为所挑选检测的耐药基因数量不够多,或这株耐药菌存在其他抵抗四环素的机制,亦或因为这株耐药菌携带的耐药基因仍属未被发现类,需要进一步探索新的四环素耐药基因.
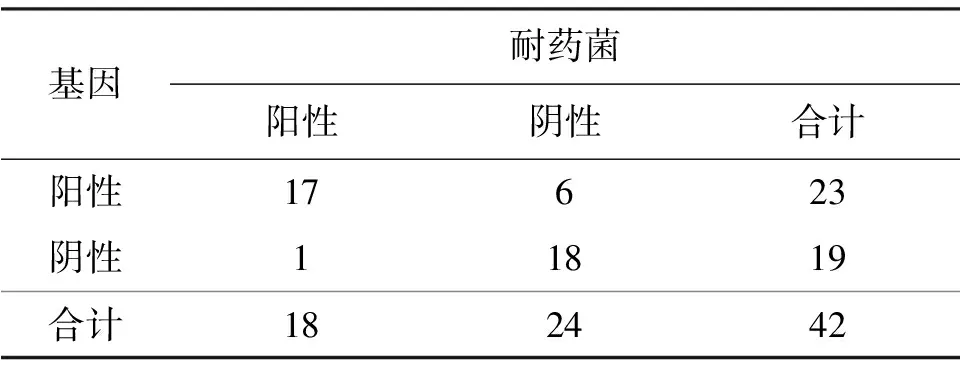
表3 四环素耐药表型与基因型分析1)
2.3 宏基因组的结果分析
为进一步揭示四环素耐药菌和敏感菌的耐药基因,并与PCR的检测结果进行对比分析,采用宏基因组学方法对所选取的大肠杆菌菌株进行高通量测序.通过NovaSeq平台测序和序列质量控制,每个提取的DNA样品得到19 954~77 434条序列,力求每个大肠杆菌菌株的基因组测序覆盖度达到10倍以上.用ARG-OAP(v2.0)平台分析序列,得到四环素耐药基因的类型和数量(表4).由表4可见,在这4个水样中,耐药菌和敏感菌均检测到tet(A), 耐药菌中所含的耐药基因的类型和数量较敏感菌更多.此外,样品中除了检测到四环素耐药基因外,还检测到大环内酯类、喹诺酮类和磺胺类等多种抗生素耐药基因.与传统PCR技术相比,宏基因组学方法能更快且更高效地检测到多种四环素抗性基因,为后续研究其他抗生素的耐药基因提供了方法.目前已有对于不同耐药基因联合作用的相关研究[28],但不同耐药基因对抗生素耐药性的表达有何具体影响,以及耐药基因联合作用的机理还有待进一步研究.

表4 宏基因组序列分析结果1)
1)tet(E)、tet(G)、tet(H)、tet(J)、tet(O)、tet(P)、tet(Q)、tet(R)、tet(S)、tet(T)、tet(U)、tet(V)、tet(W)、tet(X)、tet(Y)、tet(Z)、otr(A)、tcr(3)、tet(31)、tet(32)、tet(34)、tet(35)、tet(36)、tet(37)、tet(39)、tet(40)、tet(41)、tet(43)和tet(44)等四环素类耐药基因均未检测到.
通过对比分析两个STPs的进出水样品发现,采用改进型的A2O工艺和MUCT工艺,都能显著降低污水中耐药基因的比例.其中,tet(A)在耐药菌和敏感菌中均广泛存在,故tet(A)不适合作为检测四环素耐药菌指示性基因.然而,tet(B)、tet(C)、tet(D)和tet(M)存在于大多数的四环素耐药菌中,虽然在敏感菌中未检出,仍可作为快速检测四环素耐药菌的潜在指示性基因.部分耐药菌含有tet(A)、tet(B)、tet(C)、tet(D)、tet(L)和tet(M)中的多个耐药基因,因此仍需进一步研究多耐药基因的联合作用及其机制.
本研究采用两种方法对四环素耐药基因进行检测,即基于高通量测序技术的宏基因组学与传统的PCR技术相比,检测结果基本一致,表明四环素耐药基因与四环素耐药性有明显相关性.采过宏基因组学方法能同时检测到样品中携带的多种抗生素抗性基因.运用宏基因组学和多组学方法相结合的手段研究STPs中耐药基因的源与汇是目前的研究热点[29],下一步我们将基于本研究成果,探究大肠杆菌其他主要抗生素的耐药性与其耐药基因的关系,并探讨不同耐药基因之间联合作用的机理.
结 语
本研究所选的两个典型城市污水处理厂分别采用改进型A2O工艺和MUCT工艺处理污水后,四环素耐药菌和耐药基因检出率明显降低,说明这两种处理工艺均能有效降低四环素耐药菌和耐药基因的丰度,显著抑制了四环素耐药菌的传播.检测结果表明,四环素耐药菌的表型与基因型显著相关,tet(A)在耐药菌和敏感菌中都有检出,tet(B)、tet(C)、tet(D)和tet(M)在大多数四环素耐药菌中检出,在敏感菌中没有检出,可作为快速检测四环素耐药菌的潜在指示性基因.然而少数耐药菌并未检测到耐药基因,需进一步探究新型的四环素耐药基因或者新的四环素耐药机制.样品中有部分敏感菌也检测到耐药基因,推测这些敏感菌的耐药基因未表达.此外,四环素耐药菌中还含有其他多种抗生素的耐药基因.未来我们将继续研究不同耐药基因之间的相互作用机理,通过进一步解析污水处理厂中耐药菌和耐药基因的分布和传播的影响因素,为评价其对生态环境和人体健康的影响及潜在风险提供依据.
