二甲双胍对肺纤维化大鼠肺组织肺泡上皮-间充质转化的抑制作用及机制*
2019-11-21左东泽张俊秀蒋莉莉李先伟杨解人
郝 伟, 左东泽, 张俊秀, 蒋莉莉, 熊 莺, 李先伟, 杨解人△
(1皖南医学院机能学实验实训中心, 2皖南医学院中医药管理局中药药理三级实验室,安徽 芜湖 241002)
肺纤维化(pulmonary fibrosis,PF)是一种主要累及肺间质、肺泡和(或) 细支气管的肺部弥漫性疾病,肺泡-毛细血管功能单位逐渐丧失,最终发展为弥漫性肺纤维化和蜂窝肺,其发病率高,预后差,缺乏可靠的治疗方法[1]。肺纤维化的典型特征是肺组织内大量成纤维细胞聚集,细胞外基质(extracellular matrix,ECM)沉积并伴有炎症细胞浸润和损伤。研究表明,肺泡上皮细胞向间充质细胞转分化,即上皮-间充质转化(epithelial-mesenchymal transition, EMT)进程是成纤维细胞的重要来源[2]。因此,抑制EMT进程对防治肺纤维化具有重要意义。
目前临床上治疗肺纤维化的药物主要以皮质类固醇类和其它免疫抑制剂为主,但这些药物仅对部分肺纤维化患者有效,因此,寻找有效的药物治疗肺纤维化尤为重要。
二甲双胍是一种成熟且广泛使用的口服降糖药,并因其潜在的抗肿瘤作用而受到关注。 最近的报道也证明了其在抑制EMT和纤维化中的作用,此外,二甲双胍还可以通过抑制转化生长因子β1(transforming growth factor-β1,TGF-β1)信号转导通路来改善吉非替尼诱导的肺纤维化[3]。但是二甲双胍是否可以通过抑制TGF-β1信号转导通路来抑制肺纤维化过程中的EMT,未见文献报道。因此,本研究以博来霉素诱导的肺纤维化大鼠为研究对象,以TGF-β1转导的信号通路为切入点,探讨二甲双胍能否通过抑制肺泡EMT进程来减轻肺纤维化的发生与发展,从而为临床用药提供参考资料。
材 料 和 方 法
1 动物
清洁级健康雄性8周龄Sprague-Dawley (SD)大鼠48只,体重180~220 g,许可证号为SCXK(浙)2014-0001,购于南京市江宁区南京青龙山动物养殖场。
2 主要试剂
盐酸二甲双胍片(批号:48150513)购于上海信谊药厂有限公司;注射用盐酸博来霉素(批号:15042611)购于海正辉瑞制药有限公司;Masson染色试剂盒(批号:20160406)购于南京建成生物技术研究所;增强型HRP-DAB底物显色试剂盒(编号:PA110)购于天根生化科技(北京)有限公司; PCR引物设计合成(上海生工);TRIzol RNA提取试剂盒(批号:P4907)购于Invitrogen;荧光定量PCR试剂盒(批号:AH80230A)和逆转录试剂盒(批号:AK6301)购于日本TaKaRa公司;GAPDH小鼠抗大鼠IgG(编号:AF0006)、辣根过氧化物酶标记的山羊抗小鼠IgG(编号:A0216)、辣根过氧化物酶标记的山羊抗兔IgG(编号:A0208)和BCA蛋白检测试剂盒(编号:P0012S)购于碧云天生物技术研究所;小鼠抗大鼠TGF-β1单克隆抗体(批号:1714116)购于博士德公司;兔抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)多克隆抗体(批号:GR244953-1)、兔抗大鼠collagen I(批号:GR214135-1)及collagen III多克隆抗体(批号:GR245245-1)购于美国Abcam公司;小鼠抗大鼠波形蛋白(vimentin)单克隆抗体(批号:B1914)、兔抗大鼠上皮钙黏蛋白(E-cadherin)多克隆抗体(批号:K0614)和大鼠抗大鼠紧密连接蛋白1(zonula occludens-1,ZO-1)单克隆抗体(批号:J0616)购于Santa Cruz;小鼠抗大鼠细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)单克隆抗体(批号:21)及p-ERK1/2单克隆抗体(批号:17)、兔抗大鼠Smad2/3多克隆抗体(批号:0003)及p-Smad2/3多克隆抗体(批号:0006)购于Cell Signaling Technology; Luminata Crescendo发光液(批号:1702302)和蛋白预染 marker(批号:00471191)购于Thermo Scientific。
3 主要仪器
BioPhotometer D30核酸蛋白测定仪(Eppendorf);StepOnePlus Real-Time PCR System(ABI);Mini PROTEAN电泳系统和Mini PROTEAN转膜系统(Bio-Rad);FluorChem FC3凝胶成像系统(ProteinSimple);Infinite M200 Pro多功能酶标仪(Tecan)。
4 方法
4.1肺纤维化大鼠模型的建立[4]48只健康雄性SD大鼠,适应性喂养一周后,按体重随机分为对照(control,n=12)组与模型(model,n=36)组。模型组大鼠用1%的戊巴比妥钠(0.4 g/kg)腹腔注射麻醉后,仰卧于手术台,固定好头部和四肢,常规消毒后用手术刀片行颈部正中切一小口,钝性分离暴露气管,将注射器刺入大鼠气管软骨环间隙并注入博来霉素药液(5 mg/kg),迅速直立并同时旋转大鼠,使药液均匀分布于两侧肺内。对照组注入等量生理盐水。将造模成功大鼠随机分为模型组(5 mg/kg)、二甲双胍低剂量(100 mg/kg)组和二甲双胍高剂量(300 mg/kg)组[5];治疗组于造模后第2天开始灌服相应剂量的二甲双胍(100 mg/kg及300 mg/kg),对照组及模型组均给予等体积蒸馏水,连续4周。
4.2肺组织标本的采集与处理 给药4周后,进行腹主动脉采血处死大鼠。立即打开胸腔,经右心室用PBS灌流液将肺组织冲洗干净后,迅速取出,再用预冷的PBS将其漂洗干净。称取100 mg左肺组织置于-80 ℃冰箱保存,用于real-time PCR检测。右肺置于4%多聚甲醛固定,常规石蜡包埋,用于病理学观察及免疫组化检测。剩余肺组织置于-80℃冰箱保存,用于Western blot检测。
4.3病理学检查 取右肺组织,4%多聚甲醛固定48 h,乙醇梯度脱水,常规石蜡包埋,切片(5 μm/片),依次脱腊、入水,进行HE染色和Masson染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜观察右肺的病理学变化及胶原沉积情况。 Masson胶原染色按试剂盒说明书进行。
4.4免疫组化检测右肺TGF-β1蛋白表达 肺组织石蜡切片,每片约5 μm,依次脱腊、入水,抗原修复液修复 15 min ,加封闭液,37 ℃封闭 1 h,加 TGF-β1(1∶150)Ⅰ抗4 ℃过夜,37 ℃复温1 h,加Ⅱ抗(1∶100),37 ℃孵育1 h;加SABC,37 ℃孵育2 h;DAB显色,苏木素复染,中性树胶封片观察,结果判断:TGF-β1主要定位于胞浆。阳性细胞表达成黄至棕黄色颗粒。
4.5Real-time PCR实验 用TRIzol等试剂提取组织总 RNA 后 ,核酸蛋白测定仪检测RNA浓度,按逆转录试剂盒操作步骤进行 RT反应。合成cDNA,再进行PCR扩增。 PCR引物由上海生工公司设计并合成。按TaKaRa 公司的Power SYBR Green PCR Master Mix试剂盒的说明书进行扩增。反应条件为:95 ℃预变性 30 s; 95 ℃ 变性5 s,60 ℃ 31 s, 40个循环。统计各组2-ΔΔCt值,计算相应RQ值,比较各组 mRNA的表达水平。引物设计见表1。

表1 引物序列
4.6Western blot实验 左肺组织加入RIPA裂解液在冰上匀浆,BCA 法测定蛋白浓度。制备10%分离和5%浓缩胶,,每孔上样50 μg,凝胶电泳分离后转膜,封闭,分别滴加Ⅰ抗和Ⅱ抗孵育。 洗膜后将高灵敏度Luminata Crescendo 发光液加到膜的正面,采用FluorChem FC3凝胶成像系统进行拍照分析。图像用ImageJ 1.43软件进行灰度值分析并比较各组蛋白表达差异。
5 统计学处理
数据以均数±标准差(mean±SD)表示,统计分析采用SPSS 16.0软件。多组均数间比较采用单因素方差分析及Newman-Keuls-Student多重比较t检验。以P<0.05认为差异有统计学意义。
结 果
1 二甲双胍对肺纤维化大鼠一般状况的影响
正常对照组大鼠精神良好,且无死亡现象发生;肺纤维化模型组大鼠精神萎靡,在麻醉过程中有2只死亡,饲养过程中死亡3只;二甲双胍低剂量组在麻醉过程中死亡2只,饲养过程中死亡3只;二甲双胍高剂量组在麻醉过程中死亡1只,饲养过程中死亡2只。
2 二甲双胍对肺纤维化大鼠肺组织病理改变的影响
HE染色显示,正常组大鼠肺泡结构正常,肺泡上皮细胞完整,未见到成纤维细胞明显增生;模型组大鼠肺组织结构破坏严重,肺泡壁厚度明显增加,肺泡间隔内成纤维细胞显著增多,纤维化明显,且局部实变;而给予不同剂量的二甲双胍治疗4周后上述病理变化均有不同程度的改善,见图1。
3 二甲双胍对肺纤维化大鼠肺组织胶原沉积的影响
Masson染色显示正常组大鼠肺组织仅有少量呈蓝染的胶原纤维;模型组大鼠肺组织有大量蓝色深染,胶原纤维沉积增多;而给予不同剂量的二甲双胍治疗4周后肺组织内蓝染逐渐减少,见图2。
4 二甲双胍对肺纤维化大鼠肺组织EMT标志物表达的影响
与正常组比较,模型组大鼠肺组织α-SMA和vimentin mRNA及蛋白表达水平显著升高(P<0.01),E-cadherin和ZO-1 mRNA及蛋白表达水平显著降低(P<0.01);与模型组比较,二甲双胍低、高剂量组α-SMA和vimentin mRNA及蛋白表达水平均有不同程度降低,E-cadherin和ZO-1 mRNA及蛋白表达水平均有不同程度升高(P<0.05或P<0.01),见图3。

Figure 1.The effect of metformin on the histopathological changes of lung tissues in the rats with pulmonary fibrosis (HE staining). The scale bar=200 μm. A: control group; B: model group; C: metformin (low) group; D: metformin (high) group
图1 二甲双胍对肺纤维化大鼠肺组织病理改变的影响
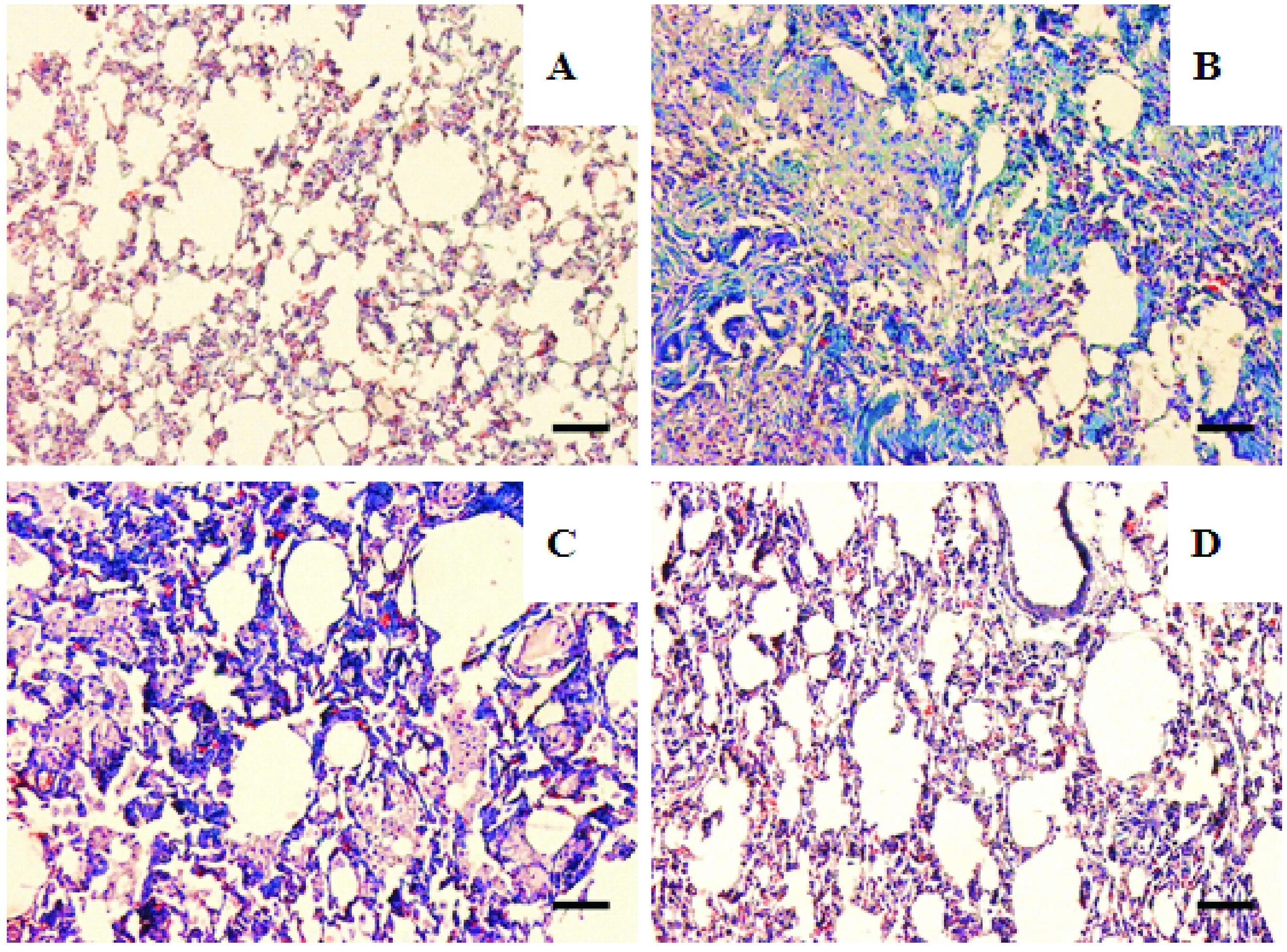
Figure 2.The effect of metformin on collagen deposition in lung tissues of the rats with pulmonary fibrosis (Masson staining). The scale bar=200 μm. A: control group; B: model group; C: metformin (low) group; D: metformin (high) group.
图2 二甲双胍对肺纤维化大鼠肺组织胶原沉积的影响
5 二甲双胍对肺纤维化大鼠肺组织collagen I表达的影响
与正常组比较,模型组大鼠肺组织collagen I mRNA及蛋白表达水平显著升高(P<0.01);与模型组比较,二甲双胍低、高剂量组collagen I mRNA及蛋白表达水平显著降低(P<0.05或P<0.01),见图4。
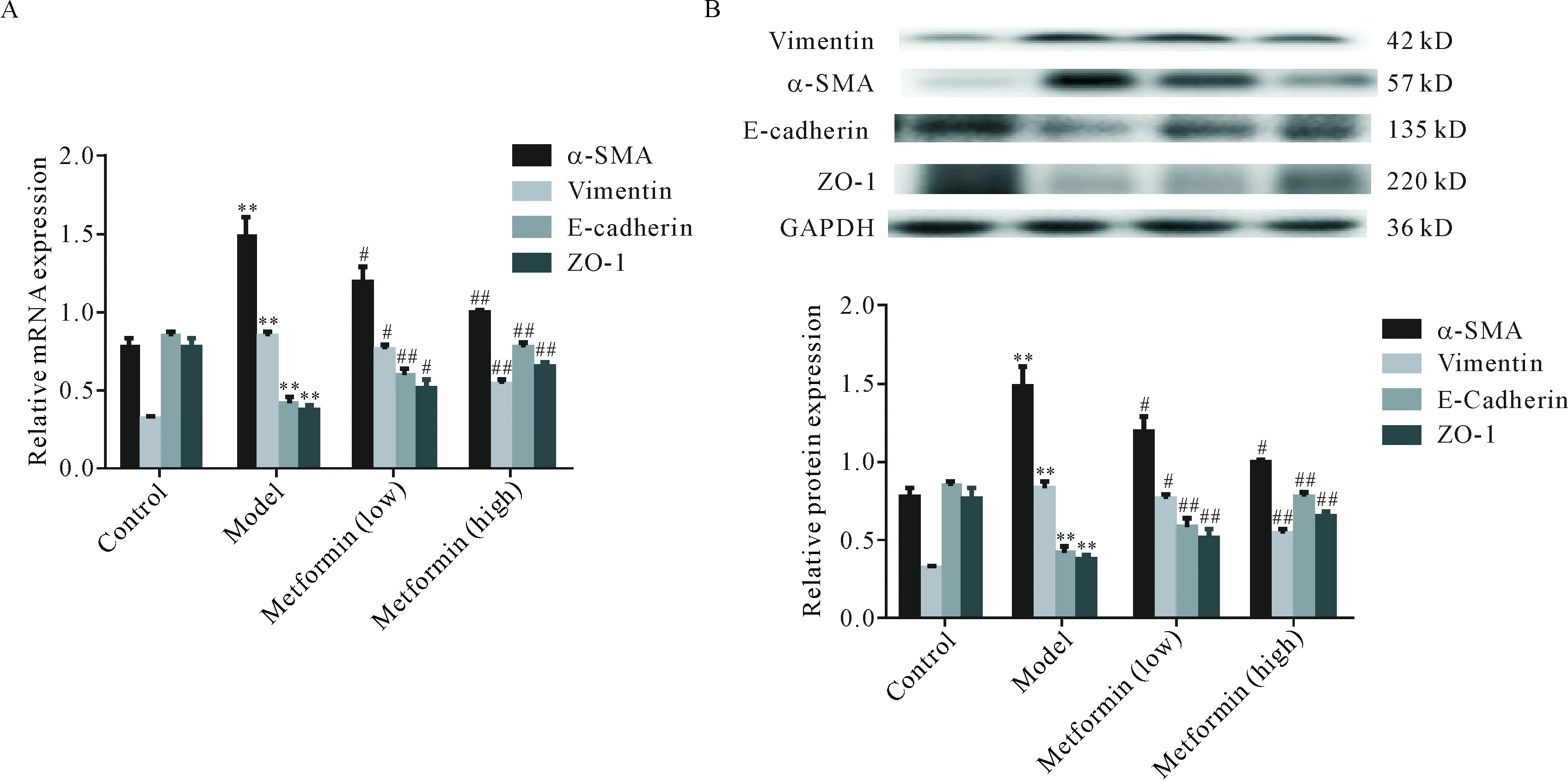
Figure 3.The effect of metformin on the expression of EMT markers in lung tissues of the rats with pulmonary fibrosis. A: the mRNA expression of EMT markers was determined by real-time PCR; B: the protein expression of EMT markers was determined by Western blot. Mean±SD.n=3.**P<0.01 vs control group;#P<0.05,##P<0.01vsmodel group.
图3 二甲双胍对肺纤维化大鼠肺组织EMT标志物表达的影响
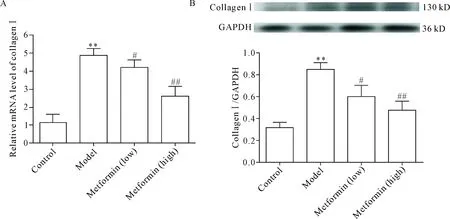
Figure 4.The effect of metformin on the expression of collagen I in lung tissues of the rats with pulmonary fibrosis. A: the mRNA expression of collagen I was determined by real-time PCR; B: the protein expression of collagen I was determined by Western blot. Mean±SD. n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图4 二甲双胍对肺纤维化大鼠肺组织collagen I表达的影响
6 二甲双胍对肺纤维化大鼠肺组织collagen III表达的影响
与正常组比较,模型组大鼠肺组织collagen III mRNA及蛋白表达水平显著升高(P<0.01);与模型组比较,二甲双胍低、高剂量组collagen III mRNA及蛋白表达水平显著降低(P<0.05或P<0.01),见图5。
7 二甲双胍对肺纤维化大鼠肺组织TGF-β1表达的影响
与正常组比较,模型组大鼠肺组织TGF-β1mRNA及蛋白表达水平显著升高(P<0.01);与模型组比较,二甲双胍低、高剂量组TGF-β1mRNA及蛋白表达水平均有不同程度下降(P<0.05或P<0.01),见图6、7。
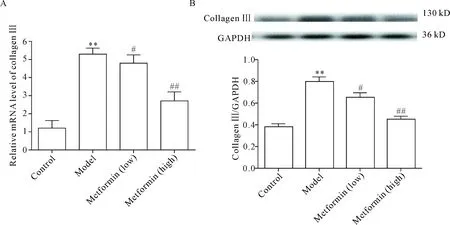
Figure 5.The effect of metformin on the expression of collagen III in lung tissues of the rats with pulmonary fibrosis. A: the expression of collagen III mRNA was determined by real-time PCR; B: the expression of collagen III protein was determined by Western blot. Mean±SD. n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图5 二甲双胍对肺纤维化大鼠肺组织collagen III表达的影响
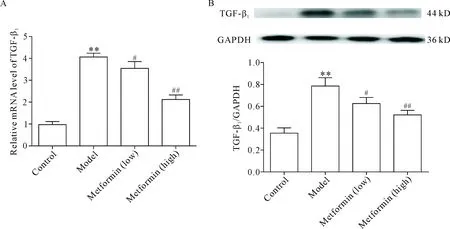
Figure 6.The effect of metformin on the expression of TGF-β1in lung tissues of the rats with pulmonary fibrosis. A: the mRNA expression of TGF-β1was determined by real-time PCR; B: the protein expression of TGF-β1was determined by Western blot. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图6 二甲双胍对肺纤维化大鼠肺组织TGF-β1表达的影响
8 二甲双胍对肺纤维化大鼠肺组织Smad2/3蛋白磷酸化水平的影响
与正常组比较,模型组大鼠肺组织Smad2/3蛋白磷酸化水平显著升高(P<0.01);与模型组比较,二甲双胍低、高剂量组Smad2/3蛋白磷酸化水平均有不同程度下降(P<0.05或P<0.01),见图8。
9 二甲双胍对肺纤维化大鼠肺组织ERK1/2蛋白磷酸化水平的影响
与正常组比较,模型组大鼠肺组织ERK1/2蛋白磷酸化水平显著升高(P<0.01);与模型组比较,二甲双胍低、高剂量组ERK1/2蛋白磷酸化水平均有不同程度下降(P<0.05或P<0.01),见图9。
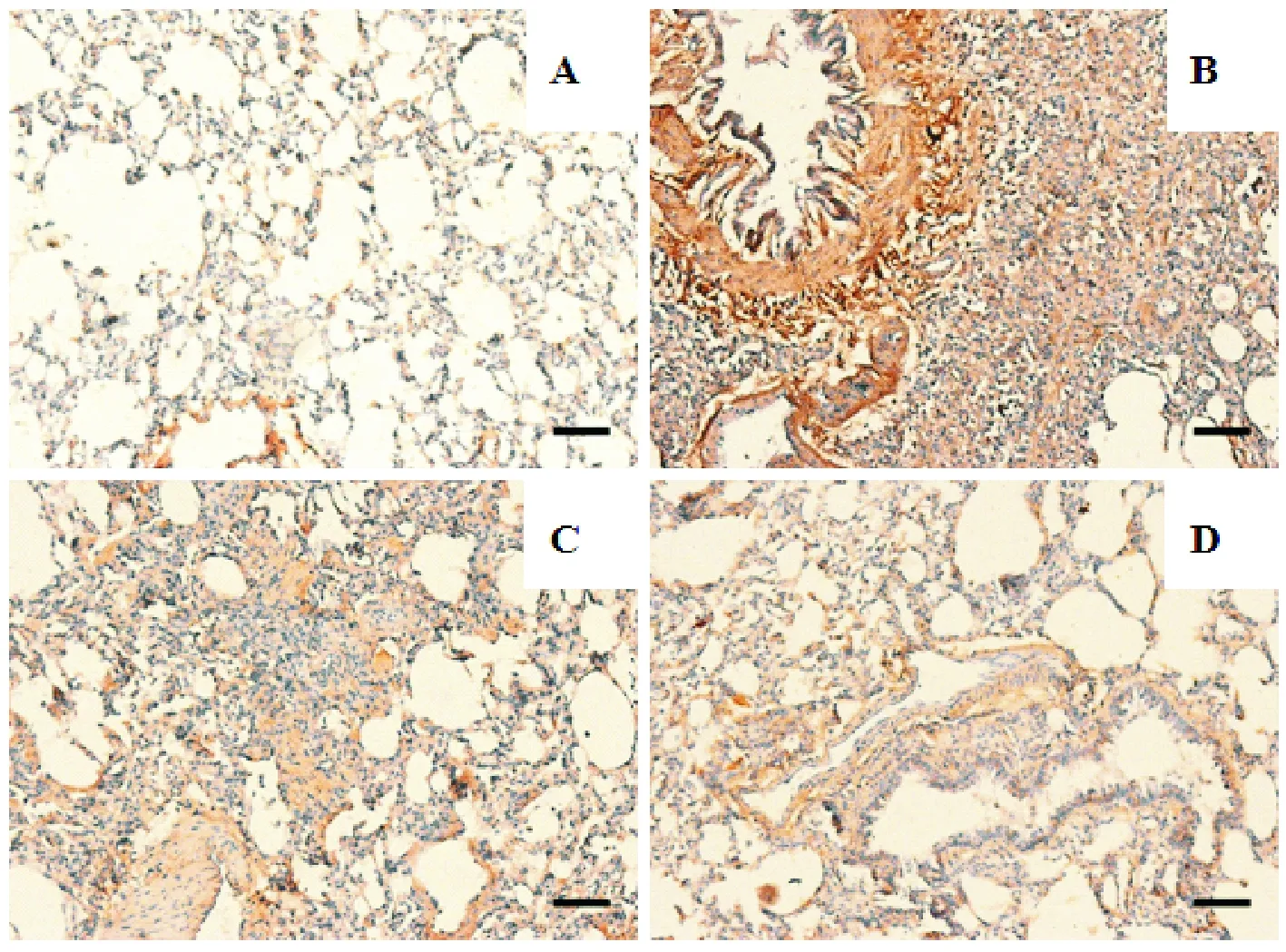
Figure 7.The expression of TGF-β1protein in lung tissues of the rats with pulmonary fibrosis was determined with immunohistochemistry staining. The scale bar=200 μm. A: control group; B: model group; C: metformin (low) group; D: metformin (high).
图7 免疫组化染色检测二甲双胍对肺纤维化大鼠肺组织TGF-β1表达的影响
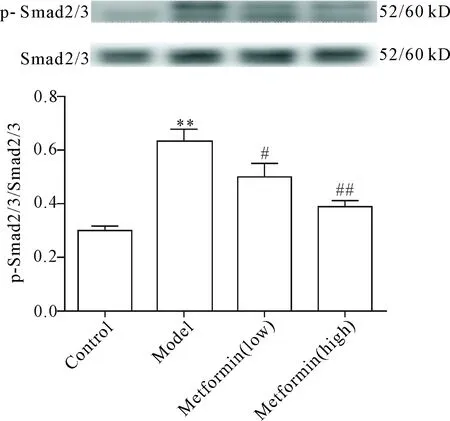
Figure 8.The effect of metformin on the phosphorylation of Smad2/3 in lung tissues of the rats with pulmonary fibrosis. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图8 二甲双胍对肺纤维化大鼠肺组织Smad2/3蛋白磷酸化水平的影响
讨 论
肺纤维化是一种慢性、渐进性、不可逆转的下呼吸道疾病。研究发现肺泡EMT在PF发生发展起着重要作用,vimentin和α-SMA是肺泡EMT过程中常见的标志物,是肌成纤维细胞(myofibroblasts,MFb)大量聚集的重要特征。MFb的过量增殖是造成ECM聚集并导致肺纤维化的主要原因[6]。此外,肺泡ECM主要由I、III型胶原组成[7-8],其可下调或分解细胞之间的连接成分,如ZO-1和E-cadherin蛋白[9-10],E-cadherin蛋白表达逐渐降低被认为是EMT的标志[10]。
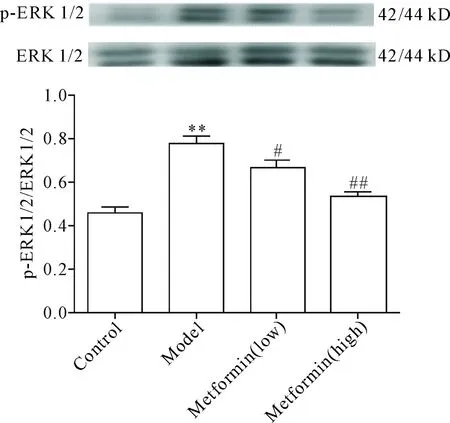
Figure 9.The effect of metformin on the phosphorylation of ERK1/2 in lung tissues of the rats with pulmonary fibrosis. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05;##P<0.01vsmodel group.
图9 二甲双胍对肺纤维化大鼠肺组织ERK1/2蛋白磷酸化水平的影响
二甲双胍是一种应用广泛且耐受性良好的降糖药,临床证据表明接受二甲双胍明显降低糖尿病病人的患癌风险和死亡率,因此,二甲双胍作为一种潜在的抗癌药物引起了研究的重视[11-13]。二甲双胍可以调节乳腺癌细胞的EMT,并显著下调多种EMT标志物的表达[14]。
本研究的HE及Masson染色结果显示,模型组大鼠肺组织结构破坏严重,肺泡壁厚度明显增加;胶原沉积增多;表明BLM诱导了肺纤维化。不同剂量的二甲双胍处理明显改善肺泡壁厚度,降低肺组织中的胶原沉积;并且二甲双胍处理促进E-cadherin 和ZO-1 表达,降低α-SMA、vimentin及I、III型胶原表达,结果提示二甲双胍可改善BLM诱导的肺纤维化。
TGF-β1是一种分泌型细胞因子,其参与组织的纤维化,因此也被认为致纤维化因子[15-16]。TGF-β1通过与膜上的跨膜丝氨酸/苏氨酸受体相结合,激活下游的Smad2或Smad3,与Smad4形成三聚体并转位到核内,并与其他转录因子的结合调节与EMT相关基因的转录,进而使细胞间连接分散、细胞骨架重排及细胞移行和侵袭能力明显增加,使肺泡EMT[17-18]。此外,TGF-β还可通过MAPKs通路参与肺泡EMT。MAPKs通路包括ERK1/2、JNK及p38 MAPK信号通路。其中,ERK1/2信号通路在调控细胞生长、发育、分裂及细胞间功能的同步性等多种生理功能中起着重要作用。ERK1/2信号通路的激活也参与了TGF-β1诱导的肺泡EMT,是TGF-β1诱导细胞间紧密迹接的解离和细胞移动的必要条件[19]。ERK和Smad通路之间在肺组织胶原的产生上存在着协同的作用,它们在肺纤维化的病程中相互促进从而导致了肺纤维化的形成[20-21]。本研究显示,在博来霉素诱导的肺纤维化大鼠肺组织中,TGF-β1的表达明显上调,Smad2/3、ERK1/2蛋白磷酸化水平明显升高。给予不同剂量的二甲双胍治疗4周后,肺纤维化大鼠肺组织中,TGF-β1的表达明显下调,Smad2/3、ERK1/2蛋白磷酸化水平明显降低,提示二甲双胍可调节TGF-β1/Smad2/3及TGF-β1/ERK1/2信号通路。
综上所述,二甲双胍可能通过调节TGF-β1信号而缓解肺纤维化大鼠肺泡EMT的进程,进而影响肺纤维化的发生发展,其详细机制尚需进一步的研究。
