NET-1通过激活EMT过程促进肺鳞癌转移*
2019-11-21拉毛卓玛孙智娜张晓岩何秀琴才德吉
拉毛卓玛, 孙智娜, 张晓岩, 何秀琴, 才德吉
(青海省红十字医院, 青海 西宁 810000)
肺癌致死率在所有肿瘤中排名第一,全球每年大约有170万人死于肺癌,并且发病率还在逐年增加[1-2]。无早期特异性诊断方法及较易发生转移是肺癌致死的主要原因。由于无有效的早期诊断方法,大部分肺癌被证实时已处于晚期,极易发生转移。因此,在诊断方法未取得重大进展之前,抑制肺癌转移成为延长肺癌患者生存时间,降低肺癌致死率的主要治疗手段。但转移机制的复杂性给抑制肺癌转移的治疗带来了巨大挑战,因此,阐明肺癌转移机制将对肺癌的诊治具有重大意义。
神经上皮细胞转化基因1(neuroepithelial cell transforming gene-1,NET-1)是小G蛋白RhoA特异的鸟苷酸交换因子,通过激活RhoA信号调节细胞增殖、分化、细胞周期和细胞骨架重排,具有类似原癌基因的功能。目前已发现,NET-1的表达与子宫颈癌、肺癌、胃癌、肝癌和胶质细胞瘤等多种肿瘤发生、发展有关[3]。作为原癌基因,NET-1在肿瘤中的异常激活可促进癌细胞的增殖、迁移、黏附、血管生成以及抗凋亡等[4-5]。有研究显示NET-1在宫颈癌[6]、皮肤鳞癌[4]和肝癌[7-8]等肿瘤中的表达均与转移呈正相关。作为治疗肿瘤的候选靶点之一,NET-1与肺鳞癌转移的关系及其相关分子机制尚未见报道,本研究将首次探索NET-1对肺鳞癌转移的影响及分子机制,为肺鳞癌转移治疗寻找有效的靶蛋白。
材 料 和 方 法
1 材料
HEK293细胞、人肺鳞癌细胞系H226、H1703、H2170、SK-MES-1、H520和YTMLC-90细胞及正常肺上皮细胞系BEAS-2B购自中国科学院典型培养物保藏委员会细胞库。
临床病理检材选取我院2016年1月~2017年6月期间的53例肺鳞癌(lung squamous cell carcinoma,LSC)、24例正常肺上皮(normal lung epithelium,NLE)及27例肺鳞状上皮内病变(lung squamous intraepithelial lesion,SIL)。53例肺鳞癌患者年龄25~88岁,中位年龄49岁,男30例,女23例。临床TNM分期按国际抗癌联盟(UICC)2009标准分为,Ⅰ期12例,Ⅱ期13例,Ⅲ期19例,Ⅳ期9例;高中分化23例,低分化30例;有淋巴结转移者21例,无淋巴结转移者32例。所有患者取标本前均未行放、化疗,临床资料完整。所有患者均知情同意,并经我院医院伦理委员审议批准。
2 主要试剂
空病毒载体Ad-control和Ad-NET-siRNA(含靶向抑制NET-1基因的NET-siRNA重组腺病毒)由上海生工构建完成;DMEM高糖培养液购自Gibco;胎牛血清(fetal bovine serun,FBS)购自北京四季青生物科技有限公司;胰蛋白酶、SP9001免疫组化试剂盒、RIPA裂解液、超敏型ECL检测试剂、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液、SDS-PAGE电泳液以及蛋白质印迹转膜液均购自上海碧云天生物技术有限公司;抗NET-1、E-cadherin、vimentin、Snail1抗体均属于兔单克隆抗体,皆购自Abcam;HRP标记的山羊抗兔IgG购自CST;TRIzol、逆转录试剂盒和实时定量PCR试剂盒购自TaKaRa;引物由TaKaRa合成,E-cadherin的上游引物序列为 5’-CCTACGATTTCCCATCACCA-3’,下游引物序列为 5’-GTCCACGGTCTCCTGTCTGT-3’;vimentin的上游引物序列为 5’-GGATTTCTCTGCCTCTTCCA-3’;下游引物序列为 5’- CACCTGTCCGTCTCTGGTTT-3’;β-actin的上游引物序列为 5’-AGGGAAATCGTGCGTGACAT-3’,下游引物序列为 5’- GAACCGCTCATTGCCGATAG-3’。
3 方法
3.1免疫组化实验 将烘烤过的组织切片脱蜡至水,微波-酸抗原修复后,用3%过氧化氢室温孵育10 min,消除内源性过氧化物酶的活性。PBS冲洗3次,每次3 min。山羊血清室温封闭15 min。滴加适量1∶200稀释的 I 抗,4 ℃过夜。PBS冲洗3次,每次3 min。将SP试剂盒中生物素标记的 II 抗滴加适量于切片的组织上37 ℃孵育30 min。PBS冲洗3 次,每次3 min。将辣根过氧化物酶标记的链霉卵白素工作液滴加适量于切片的组织上,37 ℃孵育10 min。PBS 冲洗3次,每次3 min。DAB室温显色5 min,在显微镜下观察,至显色程度适宜,以自来水冲洗,终止反应。苏木素复染2 min,用自来水冲洗切片。将切片在0.5%的盐酸乙醇中浸蘸一下即取出,用自来水冲洗浸泡3 min后浸入PBS中3 min。将切片脱水后二甲苯透明,中性树胶封片,晾干后保存,拍照分析。根据切片的阳性细胞百分比及阳性信号强度(棕黄色)进行评分,随机选取每张切片的5个高倍镜视野,阳性细胞所占的百分比计分:阴性为0分,阳性细胞<25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分,同时对每个视野中阳性细胞的信号强度进行评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;二者乘积>3者为阳性(+),反之为阴性(-)。
3.2细胞培养 将HEK293细胞、YTMLC-90细胞和BEAS-2B细胞均用含有10%胎牛血清的DMEM高糖培养液,置于37 ℃、5% CO2的培养箱中培养,待细胞贴壁生长至80%~90%的融合度时传代。
3.3重组腺病毒的扩增及最佳感染效价的筛选 在对数增殖期的YTMLC-90细胞中加入Ad-control(1 μL)或Ad-NET-siRNA(1 μL)病毒原液进行病毒扩增,待细胞变圆呈串珠样,约60%漂浮起来后离心收集细胞,液氮冷冻15 min,37 ℃水浴融解并振荡处理1 min,如此反复冻融3次;4 ℃、11 950 ×g离心5 min;取上清液(含病毒)加入HEK293细胞反复感染。通过以上步骤反复扩增,最终获得高效价的Ad-NET-siRNA和Ad-control重组腺病毒。 测定病毒效价,最后计算重组腺病毒效价为5×1016pfu/L。取生长良好的YTMLC-90细胞接种于24孔板中,待细胞贴壁生长至50%的融合度时进行重组腺病毒的感染;共设6组细胞,分别加入0.1、0.3、0.5、0.7、0.9 和1.1 μL重组腺病毒[感染复数(multiplicity of infection,MOI)分别为5、15、25、35、45和55],每组设置4个复孔;分别在24、48和72 h时观察记录细胞中荧光表达情况及细胞生长状态;以感染率>70%,且不影响细胞状态为最佳感染效价(MOI = 25)。剩余的病毒分装于-80 ℃冰箱保存备用。
3.4重组腺病毒感染 YTMLC-90细胞传代培养,待贴壁细胞增殖至50%~60%融合度时,分别加入相应最佳感染浓度的腺病毒,于24 h后观察记录各组细胞荧光表达情况。实验分组如下:(1)BEAS-2B组:BEAS-2B细胞;(2)空白对照(blank)组:未用任何病毒处理的YTMLC-90细胞;(3)Ad-control组:感染空载体腺病毒Ad-control的YTMLC-90细胞;(4)Ad-NET-siRNA组:感染重组腺病毒Ad-NET-siRNA的YTMLC-90细胞。
3.5qPCR实验 取对数生长期YTMLC-90细胞,加入Ad-control空载体和Ad-NET-siRNA载体,处理24 h,加入1.5 mL TRIzol于冰上吹打细胞,室温静置5 min,13 000 r/min离心5 min,吸取上清,加入氯仿,静置离心,吸取上清加入异丙醇,静置离心,弃去上清,75%乙醇清洗沉淀,离心弃上清,保留沉淀并干燥处理,用DEPC水溶解。然后按照反应试剂盒依次经过去除基因组DNA反应、反转录反应和qPCR进行扩增,扩增程序为 预变性 95 ℃ 10 min,1循环数;扩增 95 ℃ 15 s、60 ℃ 15 s、72 ℃ 30 s,40个循环数。
3.6侵袭实验 取4 ℃放置30 min 的24 孔板和Transwell小室。在超净工作台上,将Transwell小室放入24孔板,用4 ℃无血清DMEM培养基稀释Matrigel基质胶(培养基 ∶胶=8 ∶1),取50 μL稀释好的基质胶铺于Tranwell小室微孔膜的上表面,放入培养箱1 h,使胶凝固。同时将对数生长期的各组细胞,胰蛋白酶消化,用无血清 DMEM培养基吹打成单细胞悬液,细胞密度为4×108/L。取出24孔板,下室中加入600 μL含有20% FBS的DMEM培养基,上室中加入400 μL配制好的单细胞悬液,盖上盖子,放入37 ℃、5% CO2培养箱培养24 h后,取出小室,小心吸弃培养基,PBS漂洗,甲醇固定30 min后,用棉签轻轻拭去未迁移过去的细胞,0.1%结晶紫染色2 min,PBS反复漂洗至未结合染料全部洗去,显微镜下观察迁移情况,每个浓度选取不同视野拍照记录。
3.7Western blot实验 取各组细胞,PBS洗涤后,加入RIPA裂解液在冰上裂解细胞,待细胞裂解后收集于离心管中,继续裂解30 min,13 000 r/min离心,收集上清,测定蛋白浓度,加入4×上样缓冲液,煮沸5 min,充分变性,-20 ℃保存备用。制备10%分离胶和5%浓缩胶;按蛋白浓度确定上样量;然后经过电泳,转膜,封闭,I 抗孵育过夜(其中NET-1、E-cadherin以及vimentin以1 ∶1 000稀释,Snail1以及β-actin以1 ∶800稀释),PBS洗涤,II 抗室温孵育1.5 h(以1 ∶2 000稀释),PBS洗涤,ECL发光液显色,X射线片显影,拍照,用Image Pro Plus软件对灰度值进行分析。
4 统计学处理
数据采用SPSS 21.0进行统计学分析,不同临床病理学特征间的同一指标比较采用2检验,检验水准α=0.05;3组间2检验采用卡方分割,检验水准α=0.0167。多组比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 NET-1在肺组织的表达
利用免疫组化实验检测NLE、SIL及LSC中NET-1的蛋白表达,各组中NET-1阳性表达率见表1。由表1可知LSC组中NET-1阳性表达率为50.94%,显著高于NLE组的12.5%和SIL组的22.22%(P<0.05),NLE组和SIL组NET-1阳性表达率的差异无统计学显著性,见图1、表1。

Figure 1. NET-1 positive expression in NLE, SIL and LSC tissues (×100).
图1 NLE、SIL和LSC 3组组织中NET-1阳性表达情况
表1 NLE、SIL和LSC 3组中NET-1阳性表达分布的差异
Table 1.The differences in NET-1 positive expression distribution among NLE, SIL and LSC groups
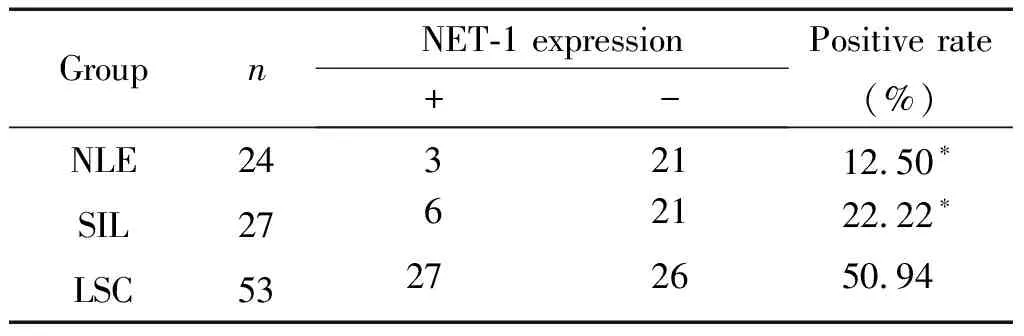
GroupnNET-1 expression+-Positive rate(%)NLE2432112.50∗SIL2762122.22∗LSC53272650.94
*P<0.05vsLSC group.
2 NET-1表达与肺鳞癌临床病理特征的关系
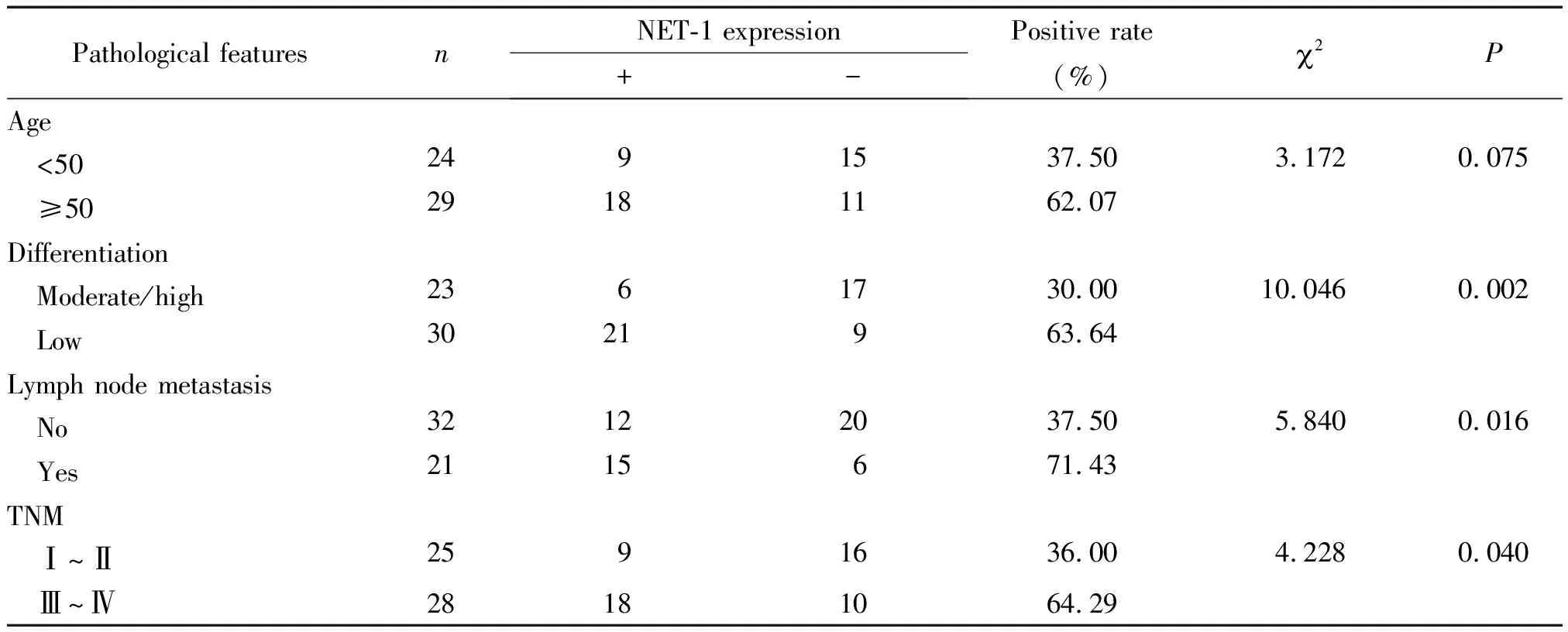
表2 NET-1表达与肺鳞癌临床病理特征的关系
3 NET-1在不同细胞中的表达情况
NET-1表达量由高到低的细胞排列依次为YTMLC-90、H2170、H226、SK-MES-1、H520和H1703,见图2。
4 转染Ad-NET-siRNA对YTMLC-90细胞中NET-1蛋白表达的影响
与BEAS-2B组相比,YTMLC-90细胞blank组和Ad-control组的NET-1蛋白含量显著上升;与Ad-control组相比,Ad-NET-siRNA组的NET-1蛋白含量显著下降(P<0.05),见图3。
5 转染Ad-NET-siRNA对YTMLC-90细胞侵袭能力的影响
与BEAS-2B组相比,YTMLC-90细胞blank组和Ad-control组的侵袭能力显著提高;与Ad-control组相比,Ad-NET-siRNA组的侵袭能力显著下降(P<0.05),见图4。
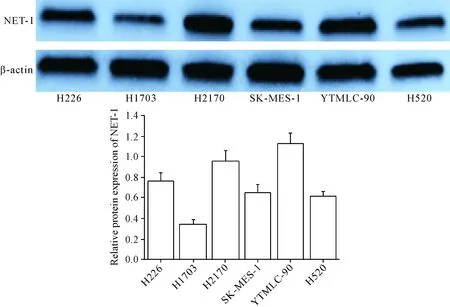
Figure 2.The protein expression of NET-1 in different cell lines. Mean±SD.n=3.
图2 NET-1在不同细胞株中的表达情况

Figure 3.The effect of Ad-NET-siRNA transfection on the protein expression of NET-1 in the YTMLC-90 cells. Mean±SD.n=3.*P<0.05vsBEAS-2B group;#P<0.05vsAd-control group.
图3 转染Ad-NET-siRNA对YTMLC-90细胞中NET-1蛋白表达的影响
6 各组细胞E-cadherin、vimentin 蛋白和mRNA表达的变化
与BEAS-2B组相比,YTMLC-90细胞blank组和Ad-control组E-cadherin的mRNA和蛋白表达显著下降,与Ad-control组相比,Ad-NET-siRNA组细胞E-cadherin的mRNA和蛋白表达显著上升;与正常BEAS-2B组相比,YTMLC-90细胞的blank组和Ad-control组vimentin的mRNA和蛋白表达显著上升,与Ad-control组相比,Ad-NET-siRNA组vimentin的mRNA和蛋白表达显著下降(P<0.05),见图5。
7 各组细胞Snail1蛋白表达的变化
与正常BEAS-2B组相比,YTMLC-90细胞blank组和Ad-control组的Snail1蛋白含量显著上升,与Ad-control组相比,Ad-NET-siRNA组的Snail1蛋白含量显著下降(P<0.05),见图6。
讨 论
肺癌是源于呼吸道上皮细胞的恶性肿瘤,依据组织学特点将其分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),其中NSCLC占肺癌患者总数的85%,而NSCLC又可分为腺癌(占40%),鳞癌(占30%),大细胞癌(占10%)[9-11],吸烟和遗传易感性是肺鳞癌的主要致病因素[12-13]。中国吸烟者数目庞大、烟龄长以及吸烟者人均吸烟量大导致肺鳞癌在国内发病率和致死率极高[14]。转移是肺鳞癌致死的主要原因之一,阐明促进转移的分子机制将为肺鳞癌的抗转移治疗提供理论基础和潜在的分子靶点。已有研究表明作为原癌基因,NET-1在多种肿瘤中表达上调,具有促进癌细胞增殖、转移的作用[3-5]。本研究通过对临床标本中NET-1的表达检测发现肺鳞癌中NET-1蛋白的阳性表达率显著高于肺正常上皮组织和肺鳞状上皮内病变组织,提示NET-1在肺鳞癌中表达普遍上调。进一步对比不同临床病理资料分类的肺鳞癌患者中NET-1阳性患者的比例发现低分化、有淋巴结转移以及TNM分期 Ⅲ~Ⅳ的患者中NET-1阳性患者比例均显著高于中、高分化、无淋巴结转移以及TNM分期Ⅰ~Ⅱ期的患者,提示NET-1表达上调与肺鳞癌的恶性程度呈正相关性,其可能促进肺鳞癌的发生、发展以及转移。

Figure 4.The effect of Ad-NET-siRNA transfection on the invasive ability of YTMLC-90 cells(×400). Mean±SD.n=3.*P<0.05vsBEAS-2B group;#P<0.05vsAd-control group.
图4 转染Ad-NET-siRNA对YTMLC-90细胞侵袭能力的影响
肿瘤的发生发展是一个失去组织性的“脱分化”,同时获得侵袭、转移特性的过程[15-16],因此分化程度、有无转移和TNM分期均为反映肿瘤恶性程度的指标。大量研究提示“脱分化”过程在上皮癌中表现的尤为突出,其分子机制在于上皮间质细胞转化(epithelial-mesenchymal transition,EMT)[17-18]。研究发现EMT过程在肿瘤获得转移特性的过程中扮演重要作用。在肺鳞癌中,NET-1是否可通过激活EMT过程促进肺鳞癌转移,本研究在体外选取肺鳞癌细胞做了进一步实验。首先本实验发现与BEAS-2B细胞相比,YTMLC-90细胞中NET-1蛋白高表达,同时具有较高的侵袭能力;YTMLC-90细胞中高表达的NET-1被沉默后,YTMLC-90细胞侵袭能力显著下降,以上提示在YTMLC-90细胞NET-1高表达,并促进YTMLC-90细胞侵袭,与YTMLC-90细胞的侵袭能力直接相关。进一步在分子水平发现,与BEAS-2B细胞相比,YTMLC-90细胞中E-cadherin的mRNA和蛋白低表达,vimentin的mRNA和蛋白高表达; 敲减NET-1表达的YTMLC-90细胞E-cadherin的mRNA和蛋白表达升高,vimentin的mRNA和蛋白表达降低。E-cadherin与vimentin的变化与EMT直接相关,其中E-cadherin是维持细胞间连接的重要蛋白,vimentin是维持细胞形态,参与细胞有丝分裂、分化的重要骨架蛋白[19-20]。在分子生物学层面上,E-cadherin表达下降,vimentin表达上升是细胞间连接下降、极性消失,发生EMT的重要标志。多个转录因子参与E-cadherin基因表达的调控,其中Snail、Twist和Slug等转录因子可与E-cadherin基因启动子相结合,抑制E-cadherin蛋白表达,导致细胞间连接减弱,启动EMT[21-23]。本研究发现与正常BEAS-2B细胞相比,YTMLC-90细胞的Snail1蛋白含量显著上升,敲减NET-1表达后, YTMLC-90细胞的Snail1蛋白含量显著下降,提示YTMLC-90细胞中NET-1的高表达可导致Snail1蛋白含量升高,从而促进YTMLC-90细胞EMT,致使YTMLC-90细胞转移能力升高。
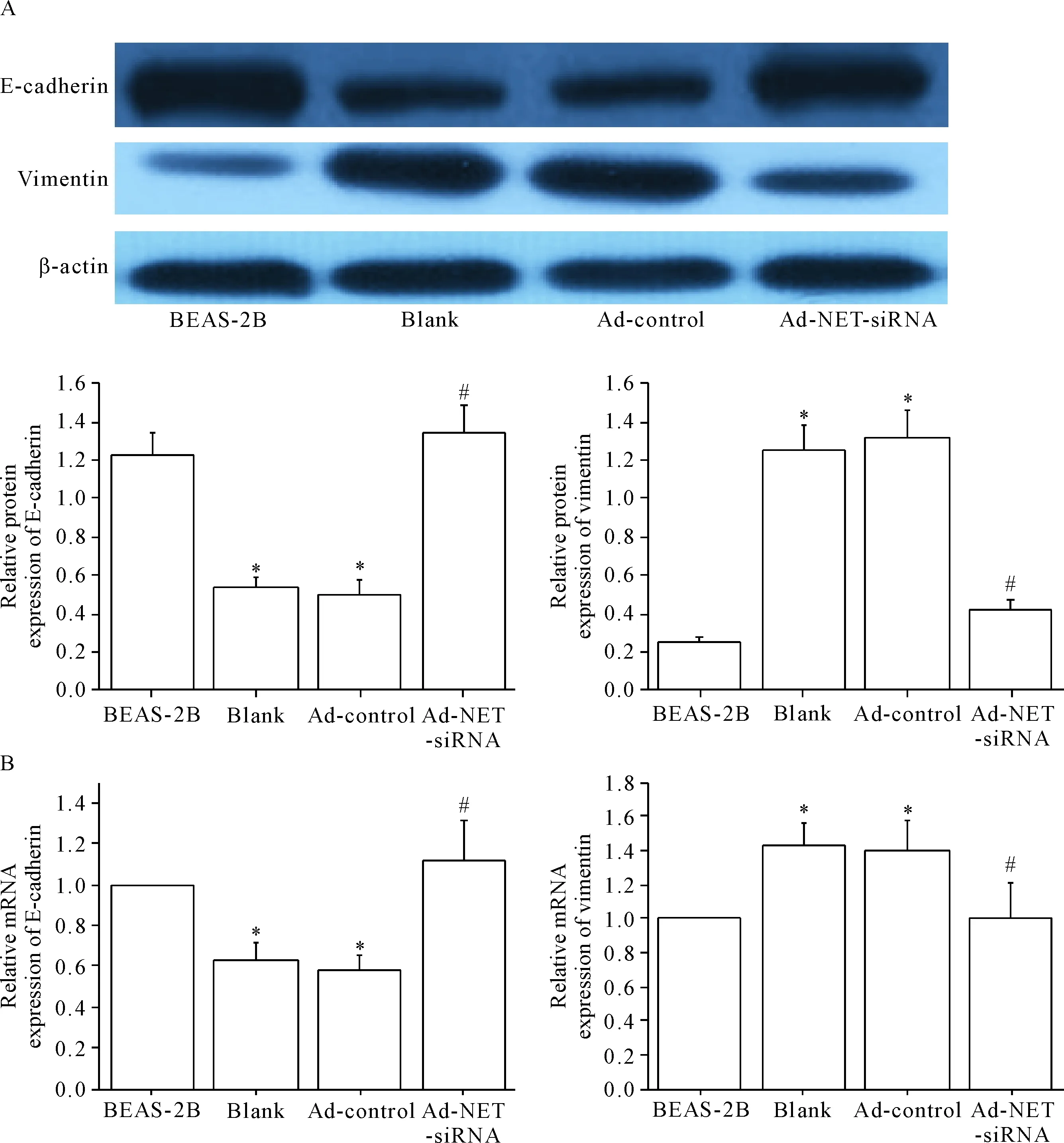
Figure 5.The effect of Ad-NET-siRNA transfection on the expression of E-cadherin and vimentin at protein and mRNA levels in the YTMLC-90 cells. A: the results of Western blot for determining the protein levels; B: the quantitative analysis of mRNA expression. Mean±SD. n=3. *P<0.05 vs BEAS-2B group; #P<0.05 vs Ad-control group.
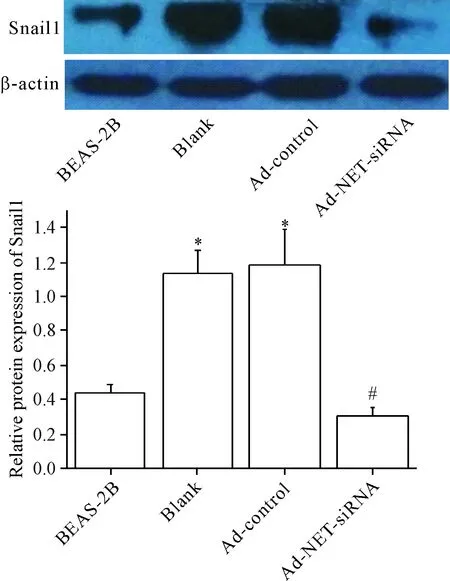
Figure 6.The effect of Ad-NET-siRNA transfection on the protein expression of Snail1 in the YTMLC-90 cells. Mean±SD. n=3. *P<0.05 vs BEAS-2B group; # P<0.05 vs Ad-control group.
综上所述,在肺鳞癌中NET-1蛋白高表达,且这种高表达与肺鳞癌的分化程度呈负相关,与TNM分期、有淋巴转移呈正相关。通过体外细胞实验证实NET-1可通过促进肺鳞癌细胞中Snail1蛋白的表达,启动EMT,提高肺鳞癌细胞的转移能力。
