饲料分解对不同养殖水体生态环境的影响
2019-11-21宣雄智李文嘉李绍钰魏凤仙王树启刘金根
宣雄智,李文嘉,李绍钰,魏凤仙,徐 彬,王树启,刘金根
(1.苏州农业职业技术学院,江苏 苏州 215008; 2.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 3.汕头大学 海洋生物研究所,广东 汕头515063)
养殖池塘生态系统结构简单,主要包括养殖动物、水生生物和微生物等,系统稳定性差,一旦恶化难以自我修复[1]。高密度养殖模式下,饲料残饵是污染养殖系统水质的主要外源物质[2]。研究表明,与养殖动物尸体和排泄物相比,残饵是引起水质恶化的关键因子[3]。养殖池塘残饵分解会降低水体pH值,增加水体化学耗氧量及氨氮等无机营养物含量,同时,在残饵分解过程中,水体细菌尤其是条件致病菌会迅速生长繁殖,可在短时间内耗尽水体溶解氧,从而严重威胁养殖动物的生长[4-6]。养殖水质恶化的速度和程度与残饵的类型和数量有关,残饵越多,水质恶化越快[7-8]。生产中,养殖户通常7~15 d 换一次水来改善池塘水环境,排放出的养殖废水易导致江河水体富营养化,然而鲜有学者研究饲料残饵分解对不同水体水质、浮游植物和可培养细菌等生态因子的影响及这些因子的变化规律。由于影响养殖水体生态环境的因子众多,且变化规律复杂,水体环境调控始终是养殖生产中的重点和难点。为此,通过室内模拟试验,探索饲料存在与否对不同养殖水体生态因子的影响,为养殖生产中的科学投饲及水环境精确调控提供依据。
1 材料和方法
1.1 供试饲料
商业沉性颗粒饲料模拟饲料残饵(通威通用型淡水养殖专用饲料1038型),采用国标法(GB/T 6432—94、GB/T 6433—2006、GB/T 6438—2007)测定该饲料营养成分(干物质):粗蛋白含量为29.23%、粗脂肪3.12%、粗灰分11.83%、水分9.80%。
1.2 供试水体
3种试验水体分别取自广州市南沙区某养殖基地的养殖池塘(主养草鱼、罗非鱼和乌鳢)0.2 m水深处。
1.3 试验设施
将18个40 cm×40 cm×40 cm敞口水族缸置于玻璃房内,试验开始前用0.10 g/kg高锰酸钾消毒清洗;试验水温维持在22~24 ℃,试验周期为15 d。
1.4 试验设计
试验开始前,用13号浮游生物网过滤试验养殖水体,并静置平衡24 h以减少水体中浮游动物、固体悬浮物对试验数据测定产生的影响[9]。将不做任何处理的草鱼、罗非鱼和乌鳢养殖水体设为对照组C1、对照组C2和对照组C3;将均匀投放5 g(试验期间只投放1 次)[3]沉性颗粒饲料的3种水体分别设为试验组T1、试验组T2和试验组T3,以观测没有或存在饲料残饵时,不同养殖水体生态环境的变化。每个敞口水族缸中加入的水体体积均为50 L,每组3个重复,水族缸接受自然光照。
测定水体水质指标有溶解氧(DO)含量、pH值、总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝酸盐(NO3-N)、亚硝酸盐(NO2-N)含量、化学耗氧量(COD)。
1.5 样品收集与指标测定
试验周期15 d,每天10:00在水族缸中央离缸底20 cm处取水样1 L用于测定试验指标,取样结束后用初始水体补充至原水位。
试验水体水质指标参照于洋[10]描述的方法,水体总氮含量采用碱性过硫酸钾紫外分光光度法测定;总磷含量采用钼酸盐分光光度法测定;氨氮含量采用纳氏试剂光度法测定;硝酸盐含量采用酚二磺酸光度法测定;亚硝酸盐含量采用N-(1-奈基)-乙二胺光度法测定;溶解氧含量使用哈希 HACH HQ40d分析仪测定;pH值用梅特勒-托利多FE20型 pH计测定;化学耗氧量采用高锰酸钾法测定。
试验水体中可培养细菌数量参照高程等[11]描述的方法利用平板菌落计数法测定,培养基配方:牛肉膏 5 g、蛋白胨 10 g、NaCl 5 g、琼脂15 g、水 1 000 mL、pH值 7.2~7.4。
试验水体中浮游植物种类鉴定和密度计算于试验开始前和试验结束后进行。浮游植物的识别与鉴定参照胡鸿钧等[12]的方法;浮游植物密度用浮游生物计数框测定[13],采用Shannon-Wiener指数公式估算试验水体浮游植物多样性指数。
1.6 数据统计
采用SPSS 22.0软件中Pearson简单相关系数法分析水体不同生态因子之间的相关性,以P<0.01且相关系数绝对值大于0.75为显著相关,用Excel 2016软件制图。
2 结果与分析
2.1 初始水体指标及无残饵污染时不同水体水质指标的变化
由表1可知,同一种养殖水体的对照组和试验组之间,初始水质指标基本相同。草鱼养殖水体偏碱性,pH值高于其他两组;罗非鱼养殖水体溶解氧和总磷含量较高,而乌鳢养殖水体溶解氧含量较低,但总氮、氨氮、硝酸盐和亚硝酸盐含量及化学耗氧量均高于其他两组。
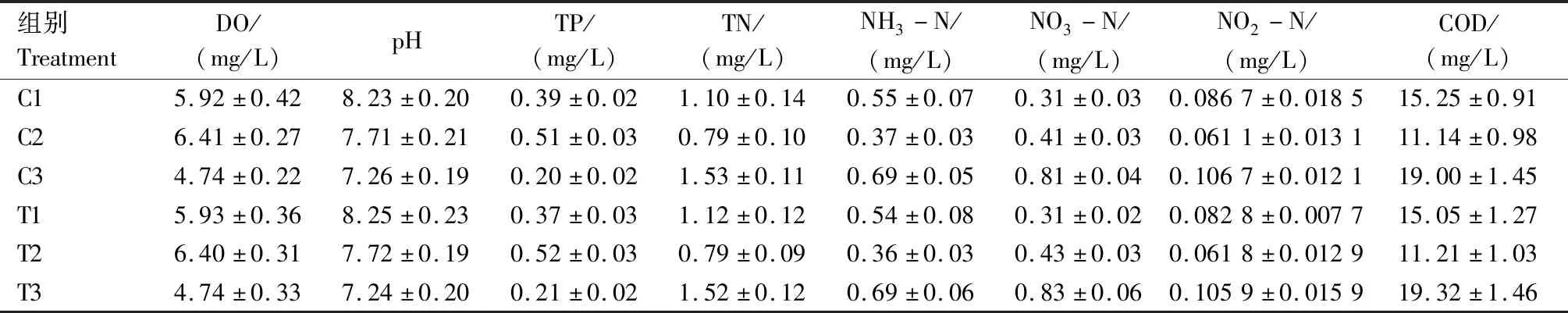
表1 草鱼、罗非鱼、乌鳢养殖水体指标初始值Tab.1 Initial water quality parameters in aquaculture water of the grass carp,tilapia and snakehead
图1显示,试验过程中C1、C2和C3组溶解氧含量均呈缓慢下降趋势,表明3个对照组水体中生物呼吸作用消耗的溶解氧均大于浮游植物光合作用产生的氧气。试验第13天起至第15天结束,C2和C3组溶解氧含量分别下降1.27 mg/L和1.02 mg/L,可能与浮游植物衰亡、降解过程中消耗水体溶解氧有关。图2显示,试验过程中,各对照组pH值均呈下降趋势,相关性分析表明,各对照组水体pH值与溶解氧含量呈显著正相关(P<0.01)(表2—4)。
图3和图4显示,与试验初相比,C1和C2组总磷含量在试验结束时分别下降0.08 mg/L和0.04 mg/L,总氮含量分别降低0.17 mg/L和0.11 mg/L,C3组总氮、总磷含量基本稳定。图5显示,C1、C2和C3组氨氮含量基本稳定,变化范围分别为0.43~0.53 mg/L、0.28~0.38 mg/L和0.55~0.69 mg/L。由此可知,水体中浮游植物生长代谢对氮、磷元素的消耗较少。
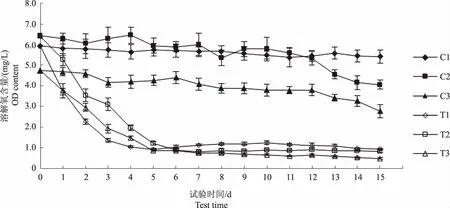
图1 各试验水体溶解氧含量变化趋势Fig.1 The trend of DO content in each experimental water
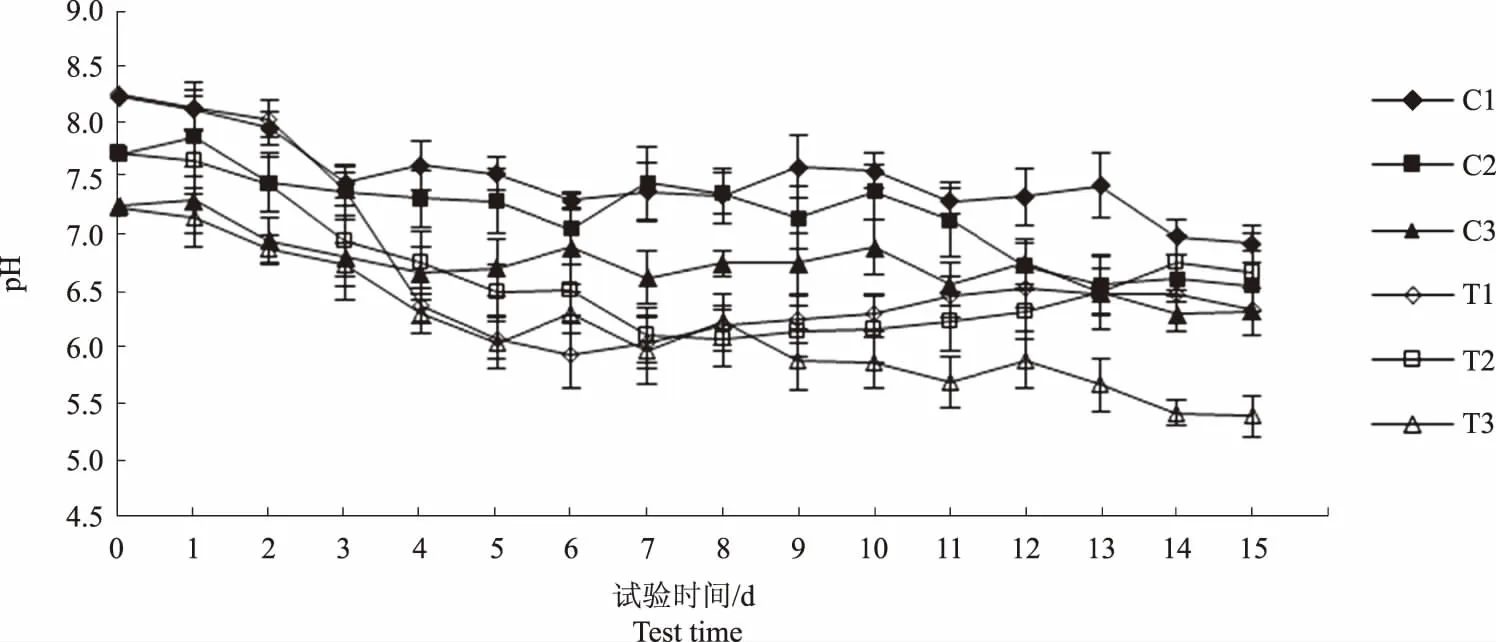
图2 各试验水体pH值指标变化趋势Fig.2 The trend of pH value in each experimental water
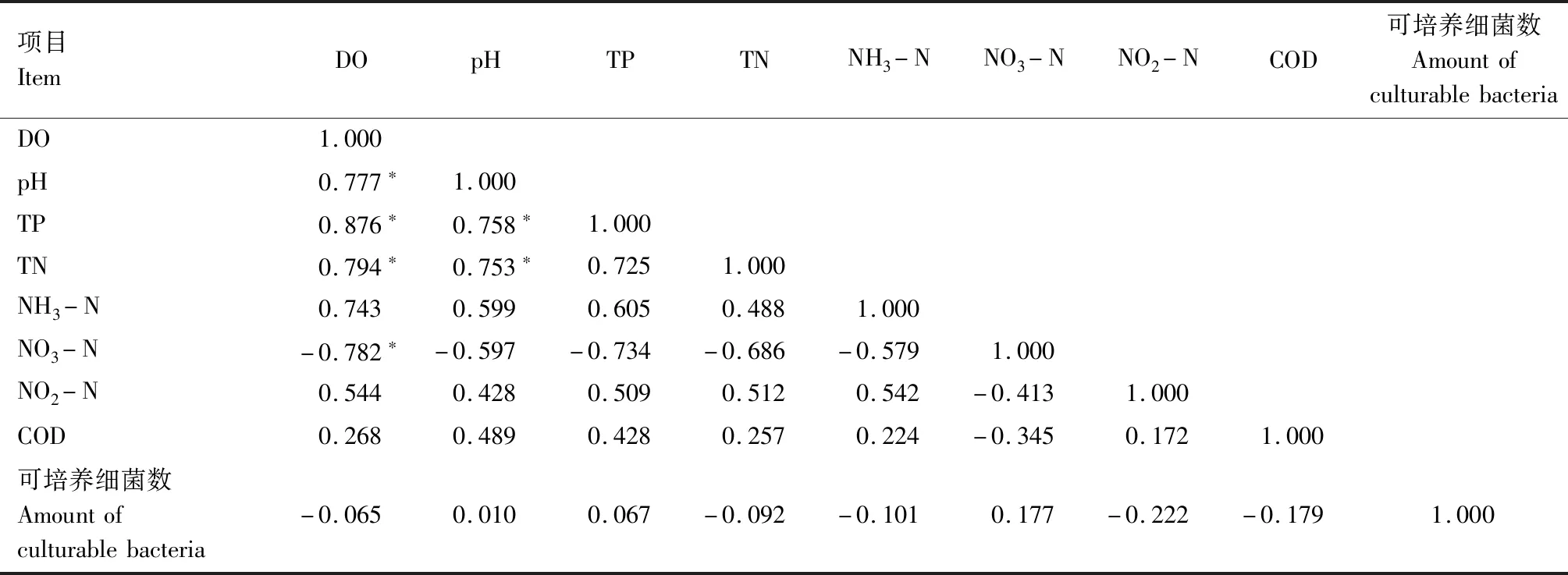
表2 草鱼养殖水体(对照组)各生态因子之间的相关性Tab.2 The correlation between each ecological factor of grass carp aquaculture water(control)
注:*表示在0.01水平(双侧)上显著相关,且相关系数绝对值大于0.75,下同。
Note: Significant correlation at 0.01 level (two-side),and the absolute value of correlation coefficient>0.75,the same below.
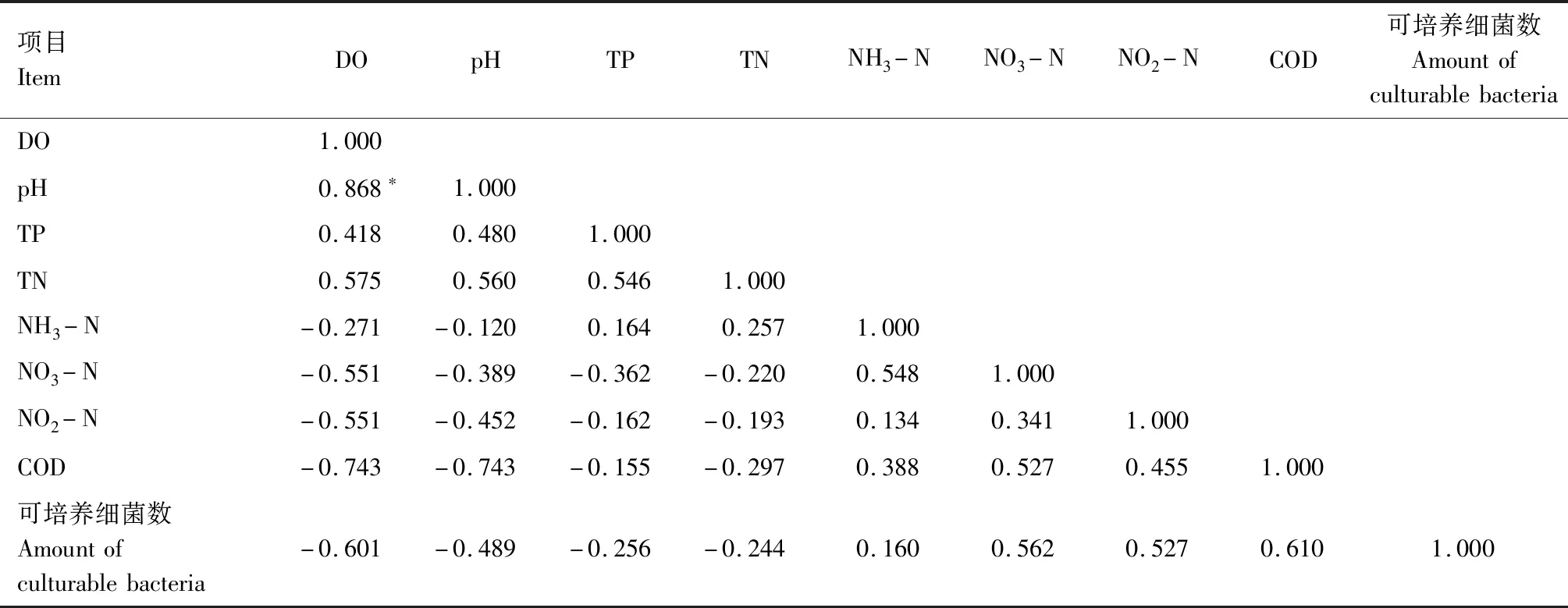
表3 罗非鱼养殖水体(对照组)各生态因子之间的相关性Tab.3 The correlation between each ecological factor of tilapia aquaculture water(control)
图6显示,C1、C2和C3组水体硝酸盐含量变化幅度均很小,无明显变化规律。
图7显示,试验过程中C1组亚硝酸盐含量较稳定,但C2和C3组亚硝酸盐含量在试验后期均呈上升趋势,出现这种差异可能是因为不同水体微生物的数量和代谢强度不同,产生的亚硝酸盐量也不同。

表4 乌鳢养殖水体(对照组)各生态因子之间的相关性Tab.4 The correlation between each ecological factor of snakehead aquaculture water(control)
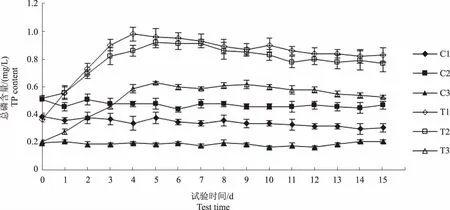
图3 各试验水体总磷含量变化趋势Fig.3 The trend of TP content in each experimental water
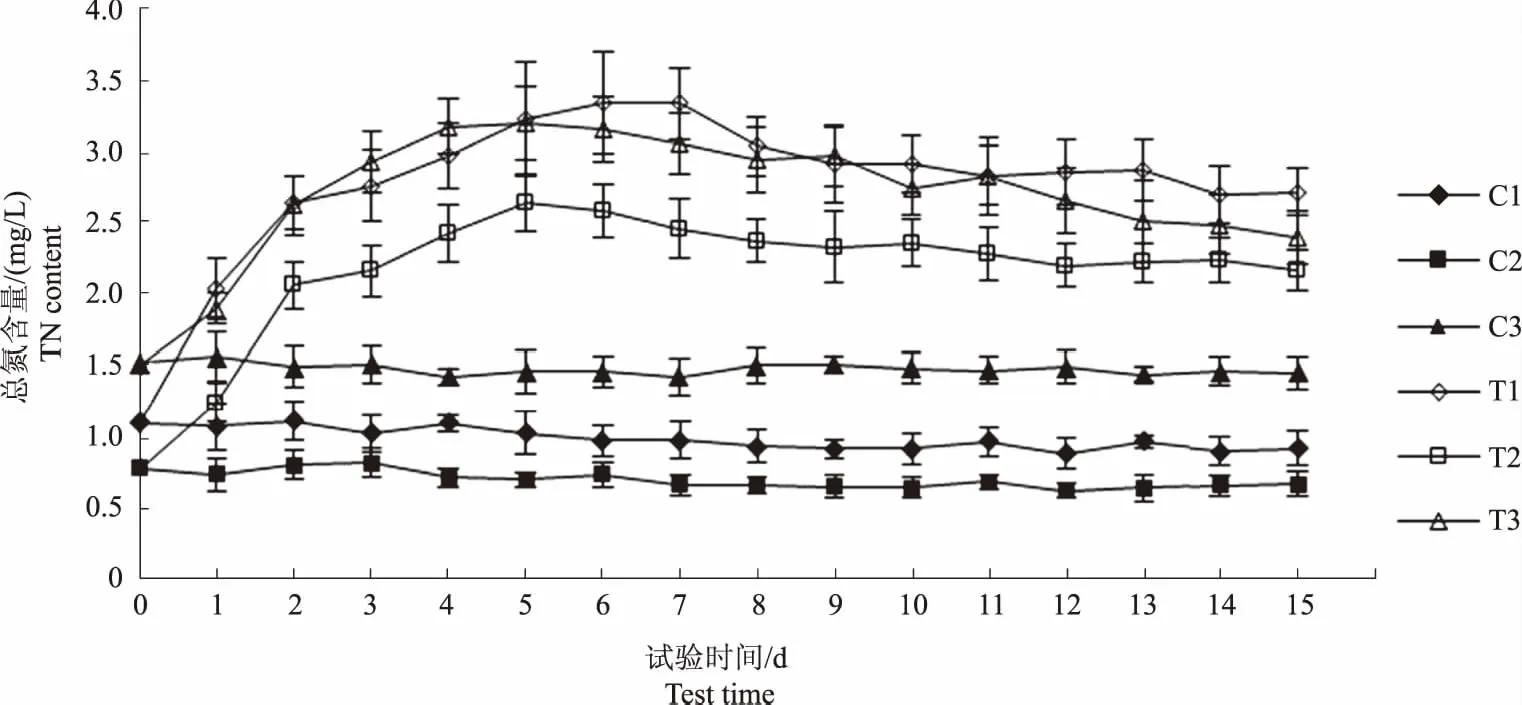
图4 各试验水体总氮含量变化趋势Fig.4 The trend of TN content in each experimental water
C1、C2和C3组水体化学耗氧量变化范围分别为14.04~15.92 mg/L、10.40~12.65 mg/L和18.58~21.28 mg/L(图8),可培养细菌数的变化范围分别是2.73×106~2.91×106cfu/mL、1.70×106~1.93×106cfu/mL和1.11×106~1.41×106cfu/mL(图9),两者变化趋势均无明显规律。
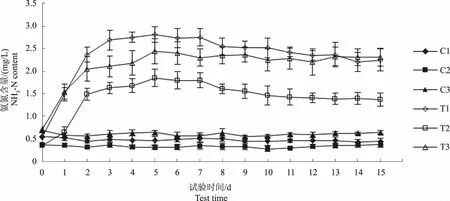
图5 各试验水体氨氮含量变化趋势Fig.5 The trend of NH3-N content in each experimental water
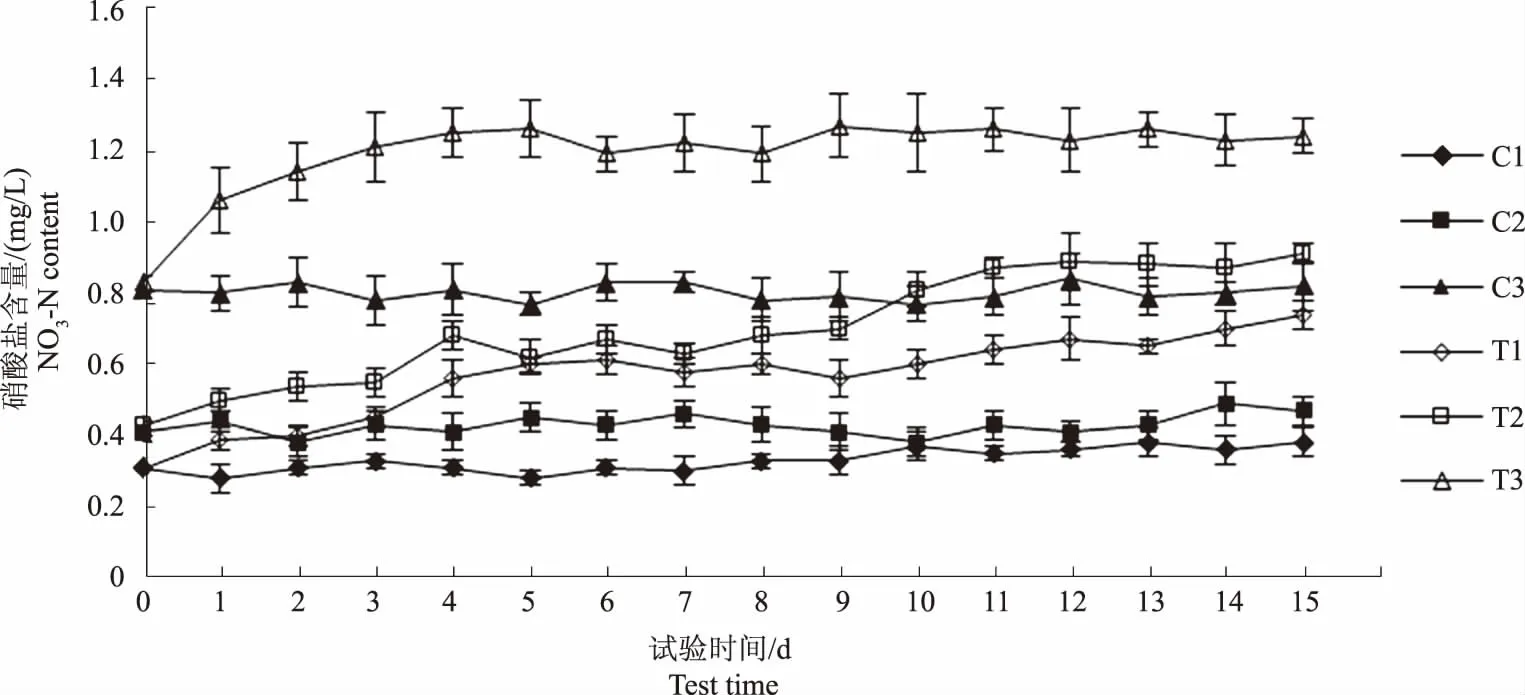
图6 各试验水体硝酸盐含量变化趋势Fig.6 The trend of NO3-N content in each experimental water
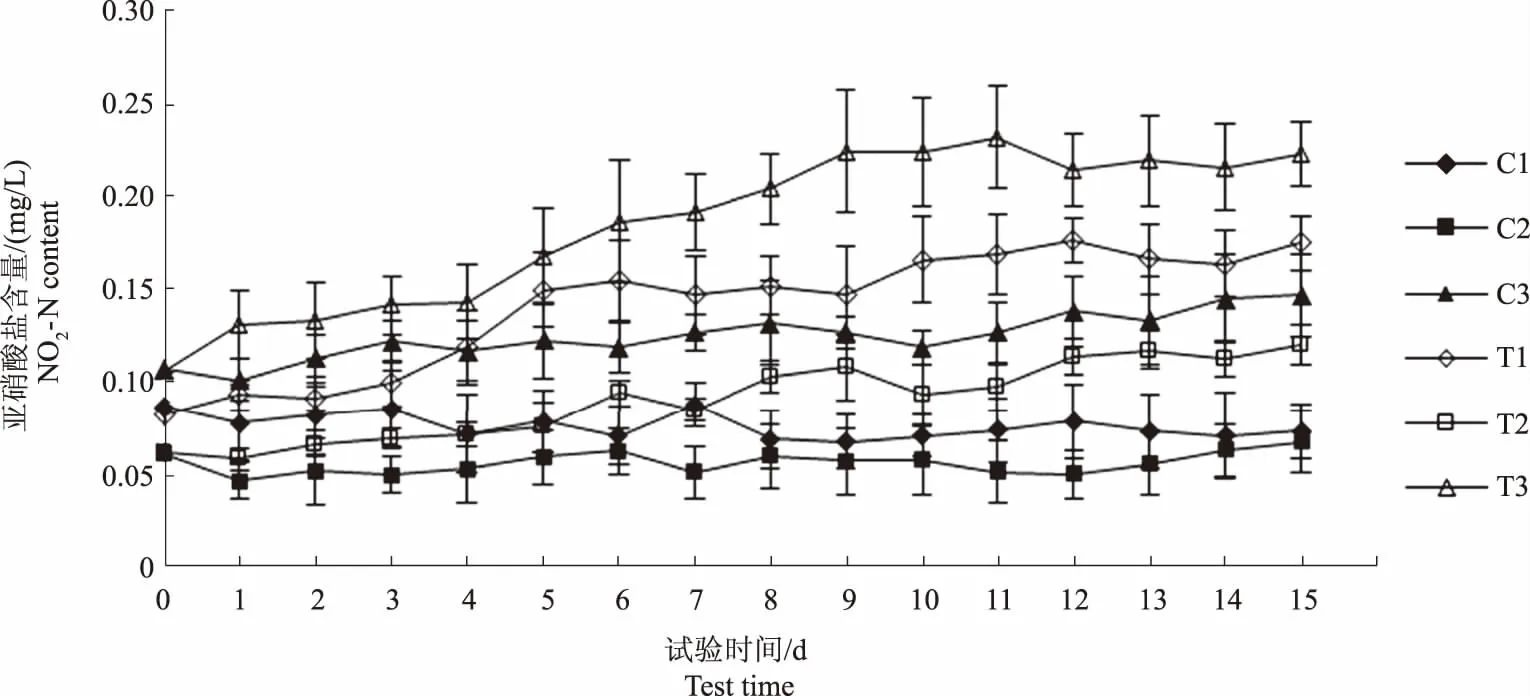
图7 各试验水体亚硝酸盐含量变化趋势Fig.7 The trend of NO2-N content in each experimental water
2.2 存在饲料残饵时不同水体水质指标的变化
图1显示,T1、T2和T3组溶解氧含量在试验第1天分别下降2.21 mg/L、1.14 mg/L和0.98 mg/L,试验中后期,T1和T3组溶解氧含量呈下降趋势,而T2组溶解氧含量较稳定,这种差异可能与水体中浮游植物种类、数量及光合作用强度有关。此外,镜检观察发现,试验结束时各试验组中原生动物和轮虫等数量差异较大,它们呼吸耗氧的差异也可能是造成各试验组水体溶解氧含量变化趋势不同的原因。
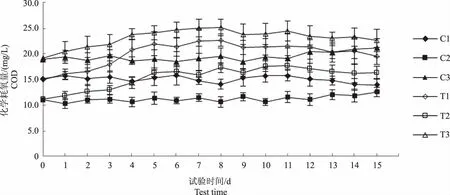
图8 各试验水体化学耗氧量变化趋势Fig.8 The trend of COD in each experimental water
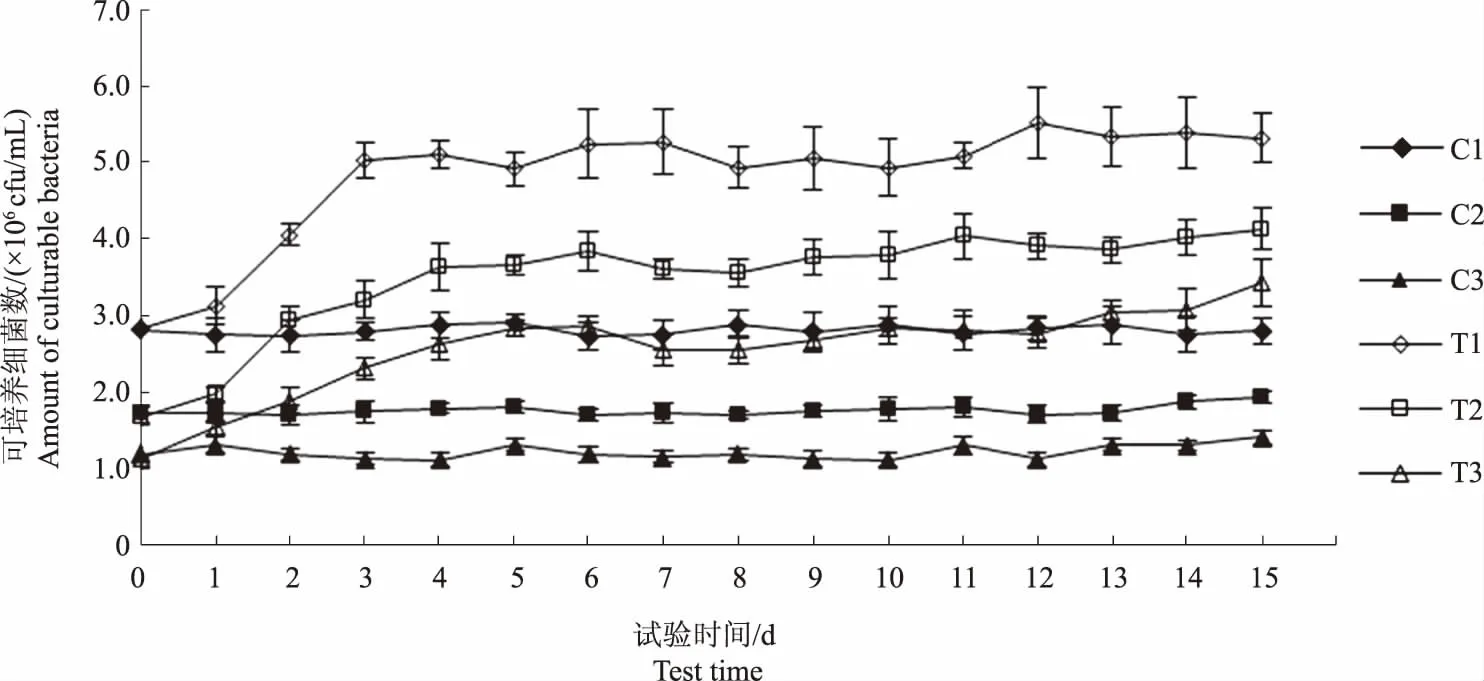
图9 各试验水体可培养细菌数量变化趋势Fig.9 Trend of the amount of culturable bacteria in the water of each experimental
图2显示,各试验组pH值均呈下降趋势,T1和T2组pH值分别于第6天和第8天下降至最低值5.93和6.08,此后均呈上升趋势,然而,T3组pH值则呈持续下降趋势,表明各试验组pH值下降速率和幅度均不相同。
图3和图4显示,至试验第5 天,T1、T2和T3组总磷含量上升0.59 mg/L、0.40 mg/L和0.42 mg/L,总氮含量分别上升2.12 mg/L、1.86 mg/L和1.69 mg/L,当总磷和总氮含量升到最高值后,均转为下降趋势。表2—4相关性分析结果显示,水体总磷与总氮含量的变化趋势呈显著正相关(P<0.01),但各试验组总磷和总氮含量的变化幅度并不相同,表明饲料在不同水体环境下的分解产生总磷和总氮的速率不同。图5显示,至试验第2天,T1、T2和T3组氨氮含量分别上升1.83 mg/L、1.13 mg/L和1.34 mg/L,且均在第5天达到最高值,T1组氨氮增量高于其他两组,可能与水体微生物数量和代谢强度有关,此后,T1和T2组呈下降趋势,T3组基本稳定。
图6显示,至试验第5天,T1、T2和T3组硝酸盐含量分别升高0.29 mg/L、0.19 mg/L和0.43 mg/L,此后,T1和T2组硝酸盐含量继续上升,T3组硝酸盐含量却基本稳定;图7显示各试验组水体亚硝酸盐含量均呈上升趋势,这是由于一方面,微生物持续分解饲料残饵产生亚硝酸盐,另一方面,水体的低溶解氧环境又为亚硝酸盐的积累创造了有利条件。
至试验第4天,T1、T2和T3组可培养细菌数量分别升高2.28×106cfu/mL、1.96×106cfu/mL和1.50×106cfu/mL(图9),化学耗氧量分别升高5.78 mg/L、3.31 mg/L和4.60 mg/L(图8),T1组可培养细菌数和化学耗氧量的增量均高于其他两组。表5显示,T1组可培养细菌数和化学耗氧量呈显著正相关(P<0.01),即间接表明水体可培养细菌数的变化与水体有机物含量相关。图8显示,试验后期各试验组化学耗氧量均有所下降,与整个试验过程中的最高值相比,试验结束时,T1、T2和T3组化学耗氧量分别下降3.09 mg/L、1.42 mg/L和2.46 mg/L,表明试验后期各水体有机物含量呈下降趋势。
表5—7相关性分析结果表明,各试验组水体可培养细菌数量与溶解氧含量和pH值均呈显著负相关(P<0.01),与水体总磷、氨氮、硝酸盐含量均呈显著正相关(P<0.01),表明微生物数量在残饵分解过程中起关键作用,进而影响水体恶化速度与恶化程度。
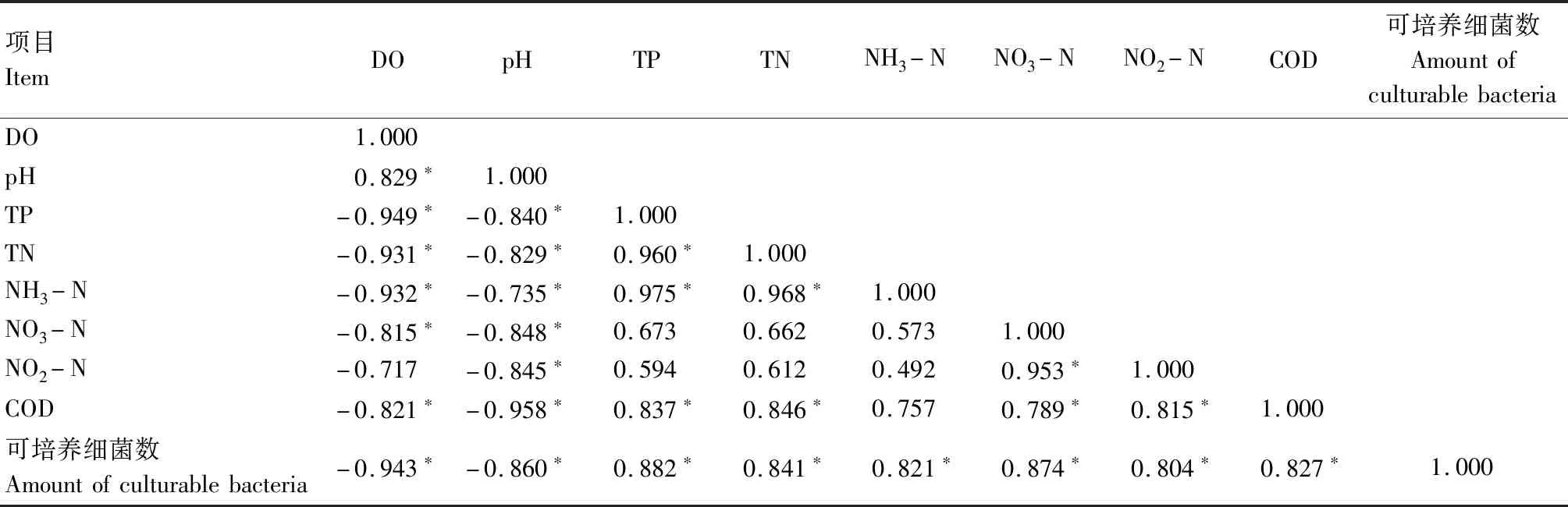
表5 草鱼养殖水体(试验组)各生态因子之间的相关性Tab.5 The correlation between each ecological factor of grass carp aquaculture water(treatment)
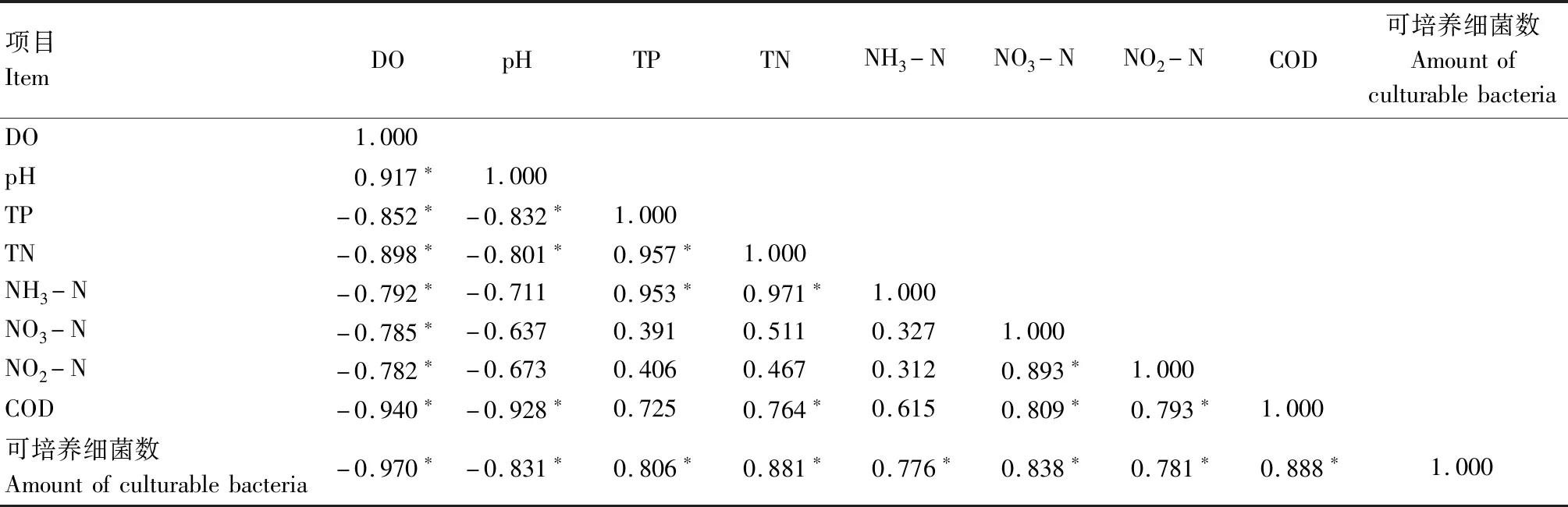
表6 罗非鱼养殖水体(试验组)各生态因子之间的相关性Tab.6 The correlation between each ecological factor of tilapia aquaculture water(treatment)
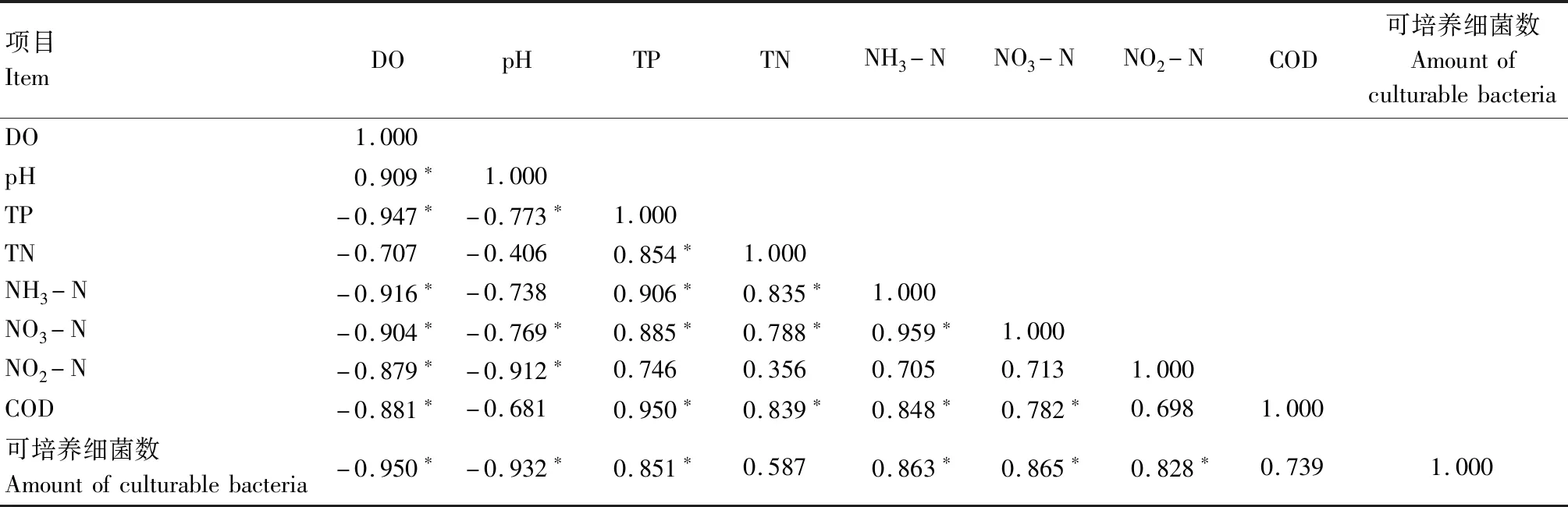
表7 乌鳢养殖水体(试验组)各生态因子之间的相关性Tab.7 The correlation between each ecological factor of snakehead aquaculture water(treatment)
2.3 试验前后浮游植物种类与数量的变化
从图10和图11可以看出,与试验初相比,试验结束时,C1、C2和C3组浮游植物密度分别上升43.50%、36.12%和27.57%,多样性指数分别上升5.76%、8.01%和5.63%;而T1、T2和T3组浮游植物密度分别是试验初的11.54倍、9.57倍和8.68倍,多样性指数分别下降18.11%、12.71%和4.35%。表8显示,试验结束时,各对照组浮游植物种类与试验初期相比无明显变化;T1组的优势种群为微囊藻属和小球藻属藻类、T2组的优势种群为微囊藻属藻类,T3组的优势种群为针杆藻属藻类,各试验组浮游植物数量、种类和多样性指数变化幅度均不同,这可能受水体多种生态因子的影响。
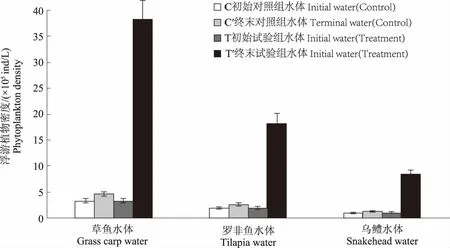
图10 试验前后不同水体浮游植物密度变化Fig.10 Changes of phytoplankton density in different waters before and after the experiment
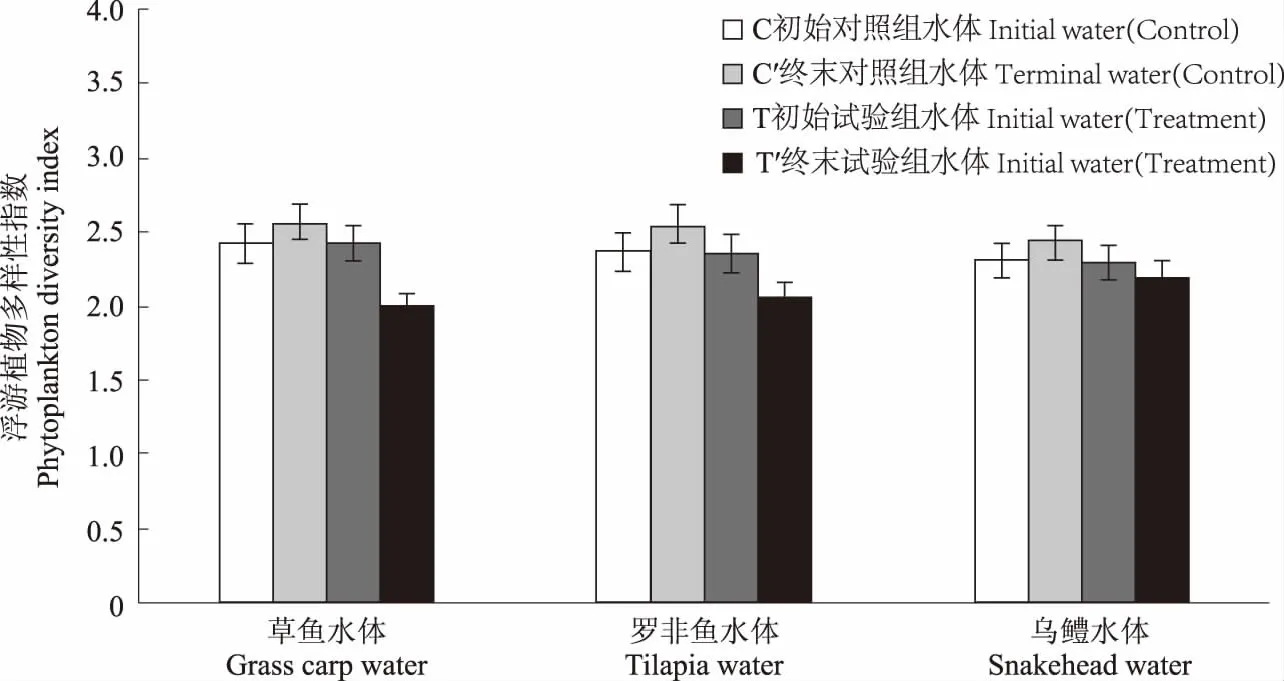
图11 试验前后不同水体浮游植物多样性指数变化Fig.11 Changes of phytoplankton diversity index in different waters before and after the experiment
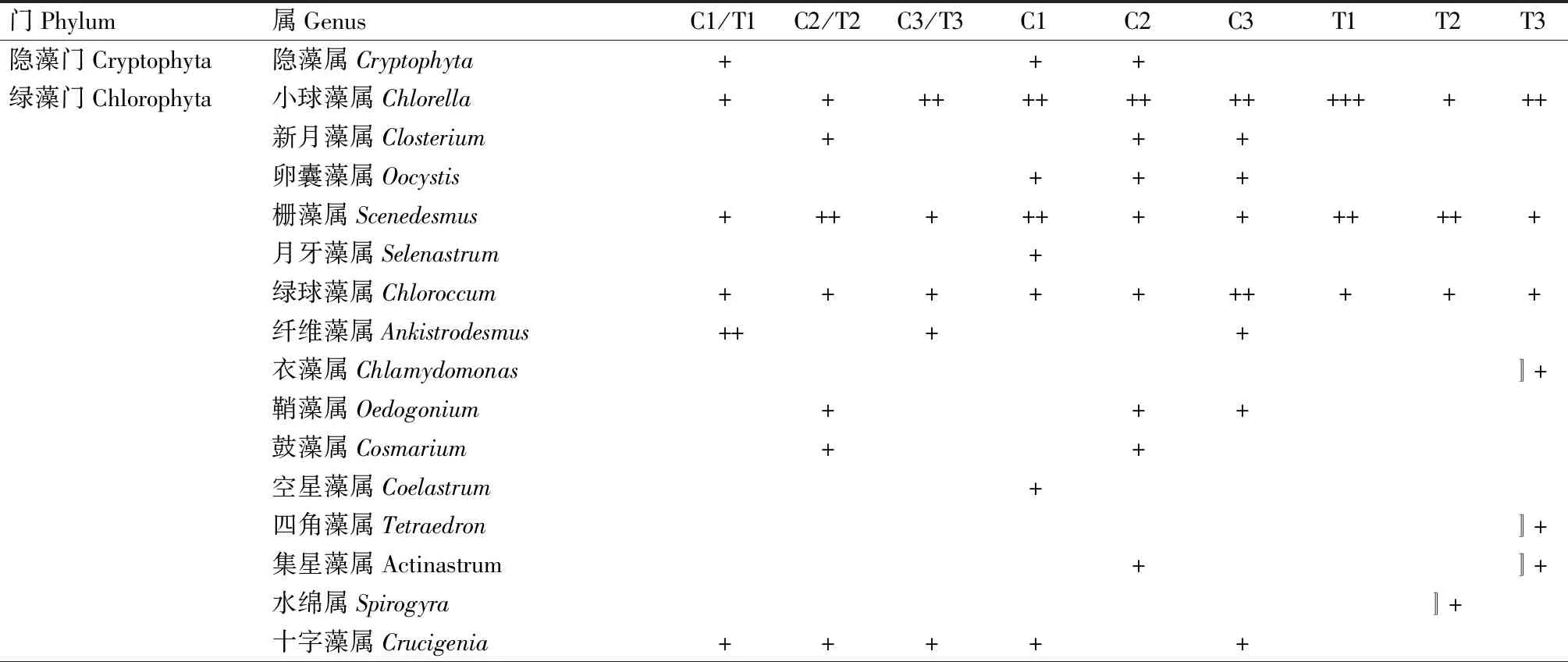
门Phylum属GenusC1/T1C2/T2C3/T3C1C2C3T1T2T3隐藻门Cryptophyta隐藻属Cryptophyta+++绿藻门Chlorophyta小球藻属Chlorella++++++++++++++++新月藻属Closterium+++卵囊藻属Oocystis+++栅藻属Scenedesmus+++++++++++++月牙藻属Selenastrum+绿球藻属Chloroccum++++++++++纤维藻属Ankistrodesmus++++衣藻属Chlamydomonas〛+鞘藻属Oedogonium+++鼓藻属Cosmarium++空星藻属Coelastrum+四角藻属Tetraedron〛+集星藻属Actinastrum+〛+水绵属Spirogyra〛+十字藻属Crucigenia+++++
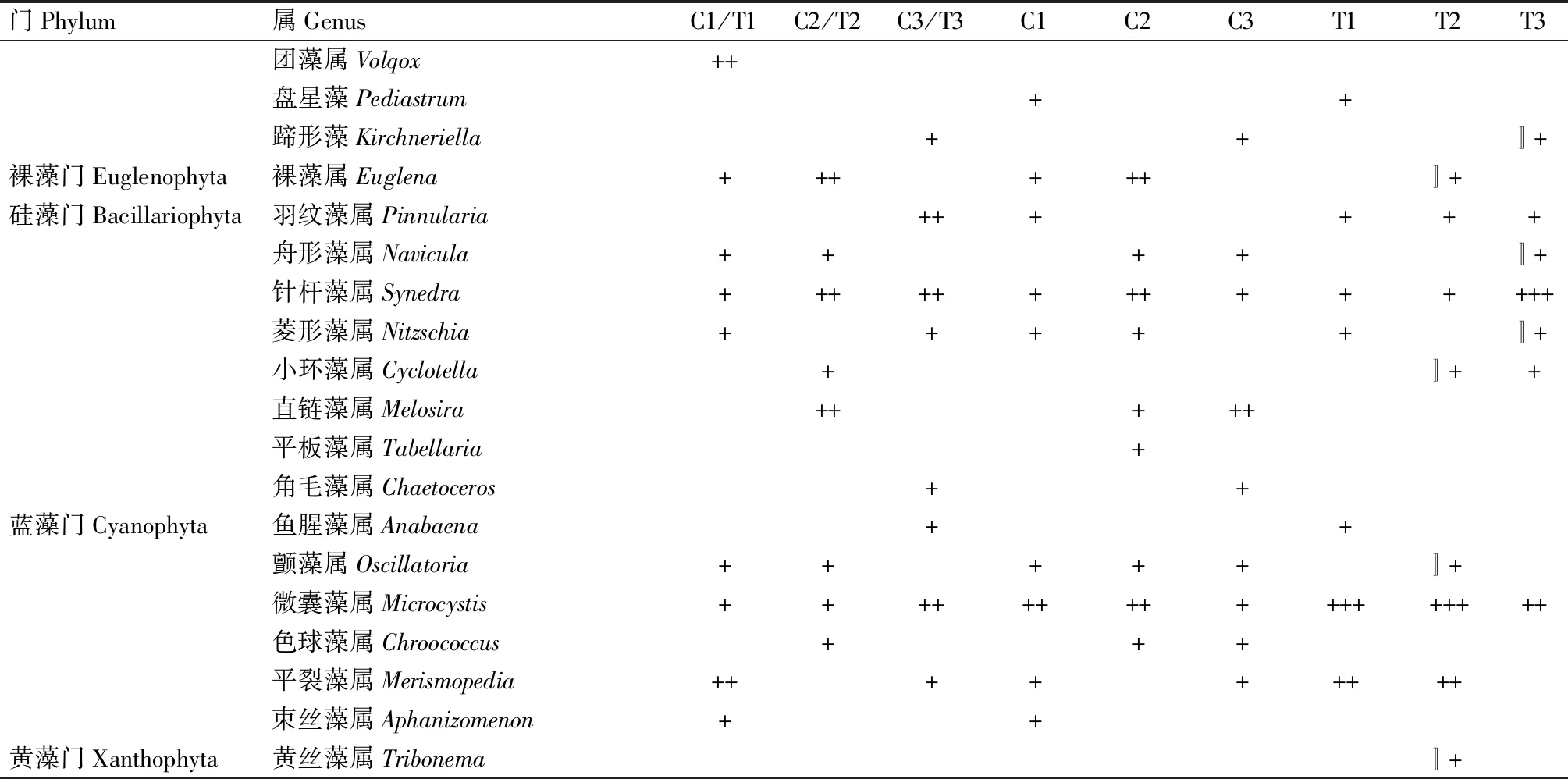
续表8 试验前后不同水体浮游植物种类组成Tab.8(Continued) The species composition of phytoplankton in each group at the begin and at the end of the experiment
注:某属浮游植物数量占总数的比例设为Y。+: 2%≤Y<10%,++:10%≤Y<20%,+++:Y≥20%,Y<2%的不作标记。C1/T1、C2/T2、C3/T3:草鱼、罗非鱼、乌鳢试验初始养殖水体;C1、C2、C3:草鱼、罗非鱼、乌鳢对照组试验终末养殖水体;T1、T2、T3:草鱼、罗非鱼、乌鳢试验组试验终末养殖水体。
Note: The proportion of the amount of phytoplankton in a genus is set as Y.+:2%≤Y<10%,++:10%≤Y<20%,+++:Y≥20%,Y<2% is not marked.C1/T1,C2/T2,C3/T3:the aquaculture waters of grass carp,tilapia and snakehead at the beginning of the experiment; C1,C2,C3: the aquaculture waters of grass carp,tilapia and snakehead(control) at the end of the experiment; T1,T2,T3:the aquaculture waters of grass carp,tilapia and snakehead(treatment) at the end of the experiment.
3 结论与讨论
3.1 饲料残饵分解对不同水体水质指标的影响
溶解氧含量是指溶解于水中的氧的含量,是衡量水质的重要指标。本研究中,当水体中存在饲料残饵时,草鱼、罗非鱼和乌鳢3种不同水体溶解氧含量在试验进行24 h内便迅速下降,与石广福[8]的研究结果一致。本研究中,各试验组水体溶解氧含量与可培养细菌数呈显著负相关,表明饲料分解过程中的细菌增殖是导致水体溶解氧含量降低的主要原因之一[14]。
pH值可间接反映水体溶解氧、CO2、碱度和溶解盐等水质指标情况[15]。试验前期,各试验组pH值均呈下降趋势,可能是氨氧化菌等微生物将氨氮转化为亚硝酸盐的过程中产生酸性物质所致[10]。试验后期,草鱼和罗非鱼试验组pH值呈上升趋势,乌鳢水体pH值则仍呈下降趋势,该结果可能与水体浮游植物数量有关,浮游植物数量多,则消耗的CO2多[16],水体pH值随之升高。
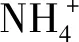
微生物在水生生态系统中扮演着分解者、转化者、生产者等多重角色,易受外源营养物质的影响[19],化学耗氧量则可间接反映水体中有机物的含量[15]。试验前期,各试验组可培养细菌数量增量依次为草鱼组>罗非鱼组>乌鳢组,这可能与水体浮游植物数量有关,浮游植物越多,光合作用代谢产生的可溶性有机物越多,越有利于细菌的生长繁殖[20],试验后期,各水体化学耗氧量有所下降,这与王方雨[15]的研究结果一致,表明微生物生长代谢有利于消除水体的有机物污染。
3.2 饲料残饵分解对不同水体浮游植物的影响
同一属的浮游植物对水环境的指示作用类似[21],因此本研究仅鉴定到属。物种多样性可表征一定区域内生物资源丰富程度,用以描述生物群落的演替方向、速度和稳定程度[22]。有研究表明,浮游微藻对总无机氮和总无机磷的最适含量下限分别为79.9 μg/L和18.0 μg/L[23]。各试验组水体营养盐含量均远高于最适含量下限值,故浮游植物迅速生长,但多样性指数却有所下降,这与刘乾甫等[24]的研究结果一致,表明饲料分解导致水质恶化。有研究表明,低氮磷比环境有助于蓝藻和绿藻的迅速生长[25],水体总氮和总磷含量的比例变化可能是蓝藻门微囊藻属和绿藻门小球藻属藻类成为草鱼和罗非鱼试验组的优势种群的原因。乌鳢试验组针杆藻属藻类在试验结束时成为优势种群,可能是由于乌鳢试验组pH值较低,低pH值环境会抑制藻类的生长,且有利于硅藻的生长繁殖[26]。
综上,饲料分解使草鱼、罗非鱼和乌鳢养殖水体营养盐含量有不同程度的上升,可培养细菌数与溶解氧含量和pH值均呈显著负相关,与总磷、氨氮、硝酸盐含量均呈显著正相关,各水体浮游植物密度上升而多样性指数下降。表明当存在饲料残饵时,不同养殖水体部分水质指标、浮游植物密度和多样性的变化趋势类似,但变化幅度不同;微生物的数量是水体水质变化的关键因素,而浮游植物种类的变化趋势可能与水体营养盐含量、pH值等多种生态因子有关。
