gdo基因RNAi对小麦全蚀病菌的影响
2019-11-21董振杰麦艳娜田修斌李欢欢刘文轩宋玉立
董振杰,麦艳娜,夏 晴,马 超,田修斌,李欢欢,刘文轩,宋玉立
(1.河南农业大学 生命科学学院, 河南 郑州 450002; 2.河南省农业科学院 植物保护研究所, 河南 郑州 450002)
小麦全蚀病,又称黑脚病或立枯病,是一种主要由禾顶囊壳小麦变种(Gaeumannomycesgraminisvar.tritici,Ggt)和禾谷变种(Gaeumannomycesgraminisvar.Graminis,Ggg)侵染引起的小麦毁灭性根部病害[1-2]。在我国,引起小麦全蚀病的主要是禾顶囊壳小麦变种Ggt。小麦全蚀病是一种典型的土传病害,主要侵染小麦根部和茎基部的1~2节,在苗期和成株期均可发病。苗期发病后小麦植株矮小,分蘖少,下部叶片变黄,根和茎变褐、腐烂,抽穗后病株发黄,植株成簇或大片变白枯死,形成白穗,降低有效穗数、穗粒数及千粒质量,导致小麦减产20%以上,甚至绝收[3-4]。我国小麦全蚀病最早在云南省、浙江省被发现,随后在全国多个小麦种植区逐渐蔓延。近年来,小麦全蚀病已经侵袭了大多数小麦种植区,尤其是在河南省、山东省等小麦主产区,该病有加重发生趋势[5]。
抗病品种的选育和利用是防治病虫危害、保障小麦高产稳产最有效的方法。但是,目前小麦抗全蚀病基因资源匮乏,尚未发现高抗的小麦品种[6-9]。据报道,小麦亲缘种属中华山新麦草等极少数种属能够高抗小麦全蚀病[10-12],但外源基因转移到小麦费时费力,还存在将不良基因导入小麦的风险。目前,小麦抗全蚀病育种进展缓慢,小麦全蚀病的防治主要以禁止从病区引种、轮作倒茬以及化学药物防治和生物防治为主[13-14]。近年来,基于RNA干涉(RNA interference, RNAi)的宿主诱导病原菌基因沉默(Host-induced gene silencing, HIGS)技术用于培育小麦抗病品种,从而为防治病原菌危害开辟了新途径[15-16]。HIGS技术通过向宿主植物导入寄主病原菌致病或生长发育关键基因的RNAi载体,在宿主细胞产生病原菌基因双链RNA,通过利用RNAi沉默病原菌基因,达到防治病原菌侵染和扩展的目地。HIGS的关键技术之一是病原菌靶基因的选择,而致病基因或生长发育关键基因都可以作为HIGS的靶基因[17]。
龙胆酸1,2-双加氧酶(Gentisate 1,2-dioxygenase,GDO)是龙胆酸(2,5-二羟基苯甲酸)代谢途径的第1个关键酶,能够催化龙胆酸的开环反应,产生反丁烯二酸或顺丁烯二酸和丙酮酸,并进入三羧酸循环。龙胆酸代谢途径是细菌细胞中芳烃化合物代谢物进入三羧酸循环的一条重要的途径[18]。在小麦全蚀病菌禾顶囊壳菌等真菌细胞中也存在GDO,但目前尚不清楚其作用[14]。有人认为,GDO可能通过催化原儿茶酸氧化环开环反应,使得寄主细胞木质素来源的芳香化合物降解成酚类物质,从而分解木质素[19-20]。木质素代谢已经被证明是植物抵御病原菌侵染的重要途径,可以通过强化植物细胞壁,抵御病原菌对植物细胞成分的破坏[21]。
小麦抗生物胁迫种质创新与利用课题组研究发现,在小麦全蚀病菌生长培养基中加入gdo基因双链RNA能够显著抑制小麦全蚀病菌菌丝生长速率。在此基础上,本研究构建gdo基因的RNAi载体,通过农杆菌介导方法对小麦全蚀病菌进行遗传转化,以获得gdoRNAi转化子,探讨gdo基因在小麦全蚀病菌生长发育和致病力中的作用。
1 材料和方法
1.1 试验材料
植物材料:供试小麦品种周麦18,由河南省农业科学院种植保存。
菌种:小麦全蚀病菌KX-7菌株,由河南省农业科学院植物保护研究所宋玉立研究员提供;根癌农杆菌菌株EHA105和大肠杆菌DH5α菌株在河南农业大学繁殖保存。
载体:真菌表达载体pBHt2-eGFP由河南省农业科学院提供;植物RNAi载体pFGC5941由河南农业大学染色体与基因工程实验室保存;真菌RNAi表达载体(pBHt2-CHSA intron,10 568 bp)是通过将pFGC5941载体上的茶尔酮合成酶基因的内含子(CHSA intron)及两端多克隆位点取代真菌表达载体pBHt2-eGFP上的绿色荧光蛋白基因(eGFP)片段构建而成,具有抗卡那霉素基因(nptⅡ) 和抗潮霉素基因(hptⅡ)2种抗生素选择标记。此外,CHSA intron上游连接NocⅠ、AscⅠ、SwaⅠ 3个酶识别位点,下游连接有BamHⅠ、XbaⅠ、PacⅠ、SmaⅠ 4个限制性内切酶的酶切位点;T载体(pMD20-T vector,编号6028)由Takara宝生物工程(大连)有限公司提供。
1.2 试验方法
1.2.1gdo基因片段 PCR扩增 根据小麦全蚀病菌gdocDNA全长序列(GenBank accession: FJ717712.1)设计1对gdo基因特异引物(5′-ATGCTGGTGAACCCATCTCG-3′、5′-AGGTAGGGCA-
GAGTGGCATA-3′)。以全蚀病菌DNA为模板,利用特异引物扩增gdo基因549 bp片段。PCR产物纯化后连接到pMD20-T vector上,导入大肠杆菌DH5α中繁殖保存。
1.2.2 pBHt2-CHSA intron∶gdoRNAi载体构建 分别通过无缝连接(In-fusion cloning)和双酶切连接的方法在CHSA intron上游和下游插入两段反方向序列的gdo基因PCR片段,构建pBHt2-CHSA intron∶gdoRNAi载体。无缝连接用AscⅠ、SwaⅠ对载体进行双酶切,gdo基因PCR扩增特异引物:5′-CAAACCATGGGGCGCGCCATGCTGGTGAACCCAT-
CTCG-3′、5′-AAATTCTTACACATTTAAATAGGTA-
GGGCAGAGTGGCATA-3′(下划线部分为质粒上的同源区段),利用NovoRec®PCR一步定向克隆试剂盒(近岸蛋白质科技有限公司),将扩增的gdo基因插入到CHSA intron上游;双酶切连接则利用分别引入BamHⅠ和XbaⅠ识别序列的1对特异引物(5′-CGGGATCCCGAGGTAGGGCAGAGTGGCATA-3′、5′-GCTCTAGAGCATGCTGGTGAACCCATCTCG-3′)(下划线部分为BamHⅠ和XbaⅠ识别序列及其保护碱基)扩增的gdo基因反向片段,用BamHⅠ和XbaⅠ双酶切质粒载体和PCR扩增片段,将gdo基因反方向插入CHSA intron下游。将构建成功的pBHt2-CHSA intron:gdo重组载体转化根癌农杆菌细胞。转化子在含有卡那霉素(Kan)和利福平(Rif)的液体LB培养基中28 ℃、220 r/min培养、保存。
1.2.3 小麦全蚀病菌遗传转化 菌丝预处理:(1) 取0.3 g全蚀病菌新生菌丝于2.0 mL离心管中,加入1 mL灭菌的PDA液体培养基和2颗钢珠,用振荡器破碎菌体(破碎程度以200 μL枪头可以轻松吸出并均匀悬浮为宜),备用;(2) 将0.3 g左右的新生菌丝用1 mL的PDA液体培养基悬浮,加入12.5 U的溶壁酶,处理6 h后,用无菌水洗涤2次,重悬于1 mL的PDA液体培养基,备用。
全蚀病菌遗传转化:液体共培养,吸取50 μL预处理的菌丝悬浮液于2 mL含乙酰丁香酮(As) 400 μmol/L的pBHt2-CHSA intron质粒农杆菌LB液体培养基中,28 ℃、100 r/min避光共培养12 h;固体共培养,吸取50 μL预处理的菌丝悬浮液接种在预先涂布有根癌农杆菌的Co-IM培养基上,25 ℃黑暗条件下,连续培养7 d。
转化子筛选鉴定:经过液体共培养的菌丝直接涂布在含潮霉素B(Hyb) 200 μg/mL 和头孢霉素(Cef) 300 μg/mL的固体PDA培养基中,25 ℃避光静置培养。固体共培养的菌丝则用菌饼打孔器(直径5 mm)取边缘新菌丝饼块接种到上述PDA平板上,除去根癌农杆菌污染。培养7 d后,用打孔器选取边缘新生菌丝,在含Hyb 200 μg/mL的固体PDA培养基上连续继代筛选4次。将得到的转化子提取DNA, 利用T-DNA左右边界内的htpⅡ基因特异引物 (5′-GCCCTTCCTCCCTTTATT-3′、5′-TCCATCACAGTTTGCCAGT-3′)和T-DNA区域外的nptⅡ基因特异引物(5′-TGTCATACCACTTGTCCGCC-3′、5′-ATCGAGCTGTATGCGGAGTG-3′)进行PCR扩增。根据htpⅡ和nptⅡ的特异PCR扩增条带(分别为549、328 bp)鉴定gdoRNAi转化子的真实性。
1.2.4gdoRNAi转化子生长速率分析 用打孔器选取gdoRNAi转化子以及野生型全蚀病菌KX-7边缘新生菌丝,接种到无抗生素的固体PDA培养基上,25 ℃下暗培养。第7天用十字交叉方法测量全蚀病菌转化子的生长直径(cm),计算菌丝相对生长速率:相对生长速率=(转化子菌落直径/野生型菌落直径)×100%。试验共分3组(批),每组10个转化子,每个转化子重复4次。利用F测验分析各转化子及野生型菌丝相对生长速率差异显著性。
1.2.5 小麦全蚀病菌致病力接种鉴定 采用全蚀病菌菌饼接种法鉴定致病性。将转化子和野生型全蚀病菌新鲜菌饼分别与蛭石混匀,在其中播种小麦周麦18。28 d后,将小麦拔出,洗掉蛭石,观察小麦根部发病情况,测量株高,计算小麦全蚀病病情指数。病情指数=100×∑(发病级别×该级株数)/(最高级别×总株数)。其中,发病级别0代表无可见发病症状;发病级别1代表病根数占总根数<10%;发病级别3代表病根数占总根数10%~50%;发病级别5代表病根数占总根数50%~100%;发病级别7代表病根数占总根数100%,茎基部变褐,植株黄化矮化;发病级别9代表植株死亡。病情指数=0代表免疫(I);病情指数≤20.0代表高抗(HR);病情指数介于20.1~40.0代表抗病(R);病情指数介于40.1~50.0代表中抗(MR);病情指数介于50.1~60.0代表中感(MS);病情指数介于60.1~80.0代表感病(S);病情指数介于80.1~100.0代表高感(HS)。
2 结果与分析
2.1 菌丝预处理和根癌农杆菌共培养方式对全蚀病菌转化率的影响
对菌丝进行机械破碎预处理,共得到遗传转化后代(菌饼)302个,经过连续4代含200 μg/mL Hyb的PDA平板筛选,得到gdoRNAi转化子110个,转化率为36.42%;而溶壁酶预处理菌丝,共得到遗传转化后代(菌饼)313个,转化子116个,转化率为37.06%。上述结果表明,转化前对全蚀病菌菌丝进行破碎处理或溶壁酶处理对全蚀病菌转化率影响不大,但机械破碎更经济便捷。
机械破碎预处理的全蚀病菌菌丝分别利用液体共培养体系和固体共培养体系进行根瘤农杆菌介导的遗传转化,固体共培养体系得到遗传转化后代279个,其中转化子120个,转化率为43.01%;液体共培养体系得到遗传转化后代246个,其中转化子88个,转化率为35.77%。上述结果表明,根癌农杆菌固体共培养体系的转化率优于液体共培养体系(表1)。

表1 菌丝预处理和根癌农杆菌共培养小麦全蚀病菌转化率Tab.1 Transformation rate of wheat take-all fungus of hypha pretreatment and Agrobacterium tumefaciens co-culture
2.2 转化子菌丝生长情况分析
从434个(表1)gdoRNAi转化子中随机选取30个转化子进行相对生长速率分析(表2),所有gdoRNAi转化子菌丝相对生长速率都显著小于野生菌KX-7。野生型菌落直径平均为4.03 cm, 而30个转化子的菌落直径平均只有2.17 cm,菌丝相对生长速率为54.33%。上述结果表明,gdo基因沉默会明显抑制全蚀病菌的菌丝生长速率。
从表2还可以看出,不同转化子之间菌丝相对生长速率也有很大差异。其中转化子M-7相对生长速率最慢,只有野生型相对生长速率的20.00%,L-5、M-5转化子较慢;而S-4、S-7、L-1相对生长速率较快,达到了85.00%及以上,其中S-4、S-7达到了87.00%。
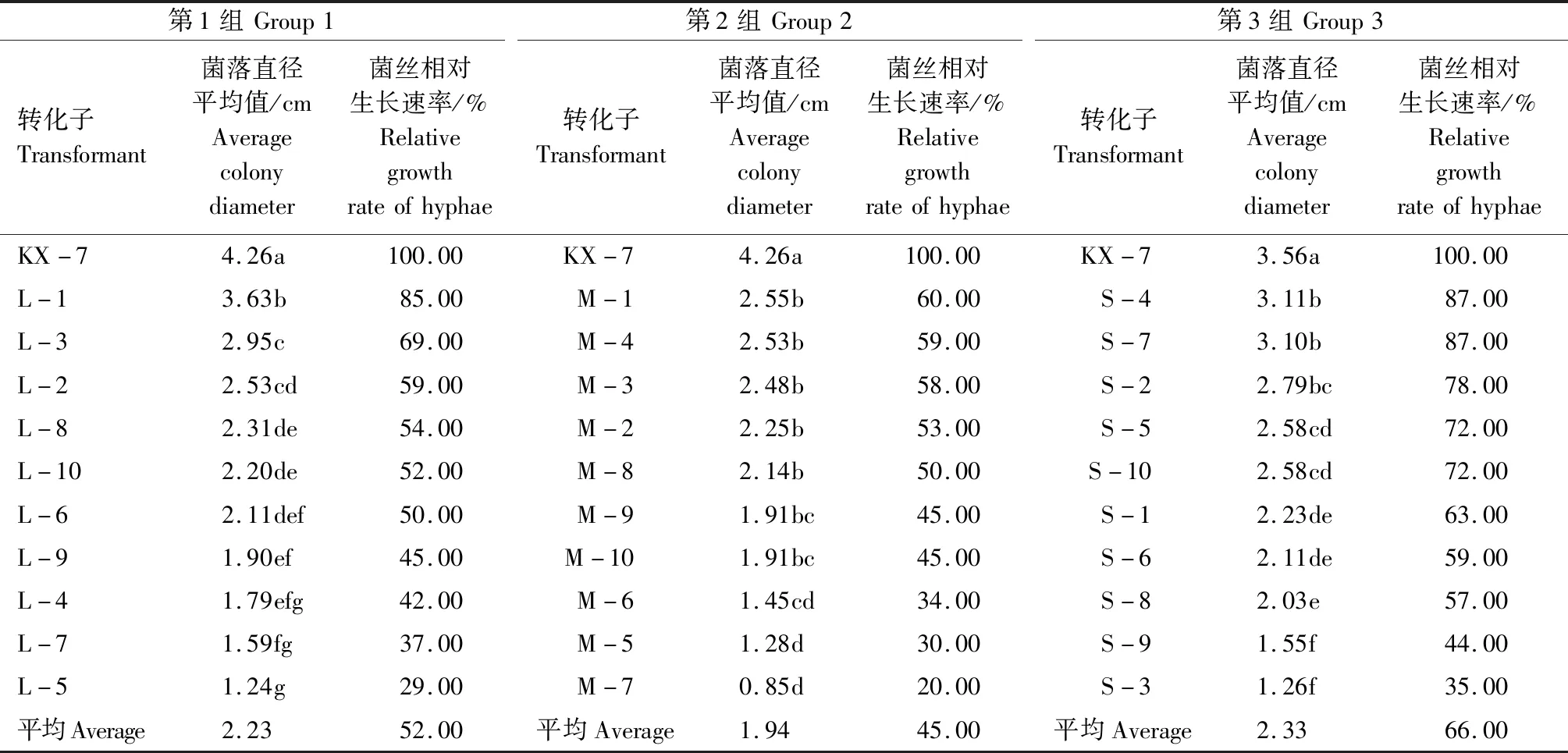
表2 gdo RNAi转化子生长情况Tab.2 Growth of gdo RNAi transformants
注:同列数据后不同的小写字母表示差异极显著(P<0.01)。
Note: Different lowercase letters in the same column indicate significant difference (P<0.01).
2.3 gdo基因RNAi对全蚀病菌致病力的影响
从上述30个gdoRNAi转化子中随机选取了L-4、L-2、M-5、S-6 4个转化子和野生全蚀病菌KX-7进行小麦苗期侵染试验。所用4个转化子的菌丝相对生长速率为S-6 (59.00%)=L-2 (59.00%)>L-4 (42.00%)>M-5 (30.00%)。侵染试验开始前,分别利用hptⅡ和nptⅡ特异引物对这4个转化子的DNA进行PCR扩增,结果均能扩增出位于pBHt2-CHSA-Intron载体T-DNA区的hptⅡ基因特异条带(549 bp),而没有T-DNA区域外nptⅡ基因的特异扩增(图1)。上述结果表明,全蚀病菌转化子不含pBHt2-CHSA intron∶gdo完整重组载体,而是T-DNA整合到了转化子基因组上,表明其是真正的gdoRNAi转化子。
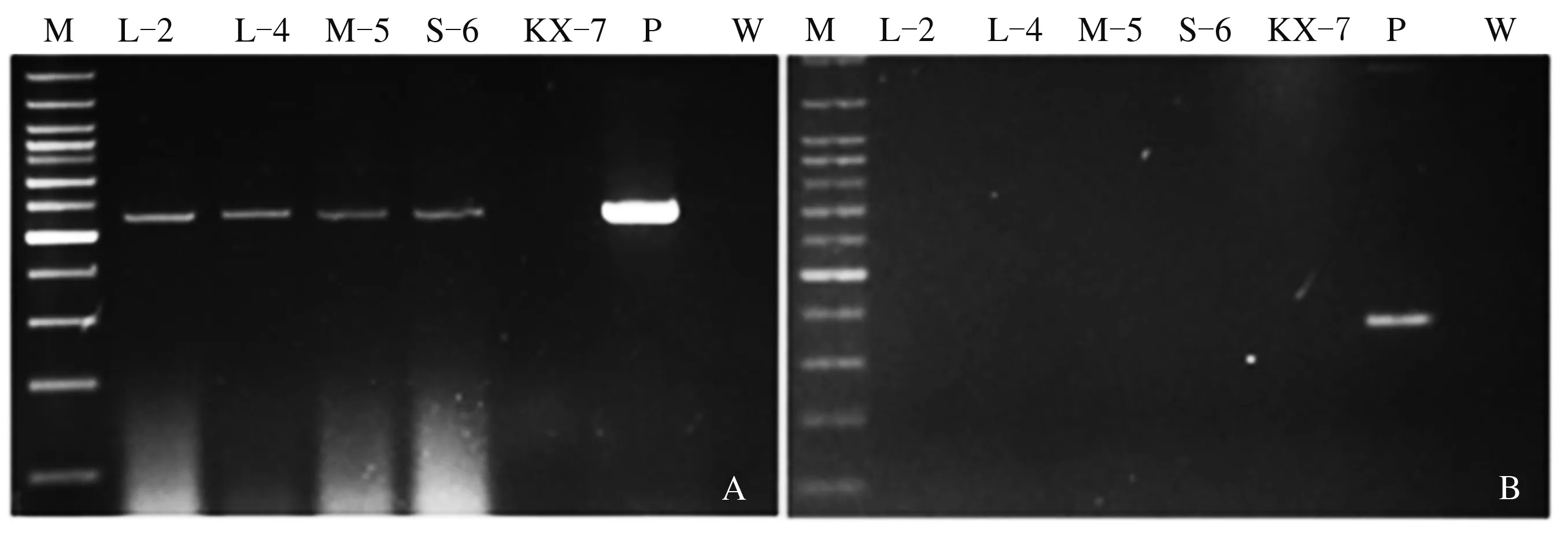
M:100 bp DNA ladder; P:空载体pBHt2-CHSA intron; W:无菌水
分别用4个转化子和野生型全蚀病菌接种侵染小麦品种周麦18,接种28 d后,全蚀病菌gdoRNAi转化子L-2和L-4侵染的小麦与未接种全蚀病菌的正常植株(CK)情况接近,根部呈白色,发根比较多;而M-5和S-6转化子与野生全蚀病菌KX-7侵染的小麦根部发病情况类似,根部发黑严重,且根系短小稀疏(图2)。

KX-7:野生全蚀病菌接种植株;L-2、 L-4、 S-6、 M-5:全蚀病菌转化子侵染植株;CK:未接种全蚀病菌植株
接种28 d后测量小麦株高,并计算4种转化子和野生全蚀病菌所侵染小麦的病害等级及病情指数。结果显示,转化子L-4和L-2所侵染的植株发病情况最轻,平均株高与未接种小麦植株(CK)接近,发病平均级别和病情指数明显低于野生全蚀病菌KX-7,其中L-4病情指数(39.29)大大低于野生型对照(75.93)。转化子M-5、S-6所侵染的植株株高比未接种小麦植株株高分别降低29.63%、30.72%,植株高度、发病级别和病情指数都与野生全蚀病菌KX-7非常接近(表3)。上述结果表明,gdo基因沉默后转化子L-4和L-2的致病力比野生全蚀病菌KX-7明显降低,而M-5和S-6转化子的致病力没有太大变化,受侵染小麦的病情指数表现为S-6(84.00)>M-5(77.08)>L-2(62.07)>L-4(39.29)。
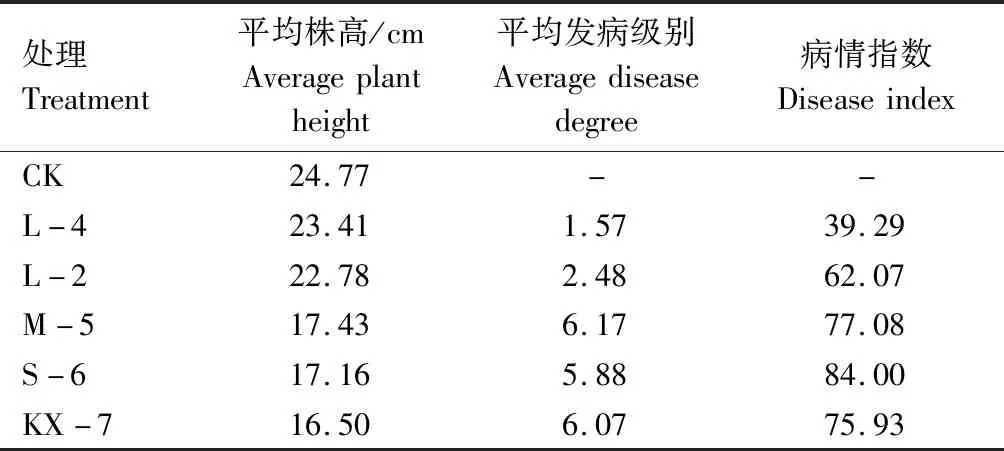
表3 全蚀病菌接种28 d后小麦株高、发病级别及病情指数
3 结论与讨论
小麦全蚀病菌在PDA培养基上产生的菌丝是多细胞结构,在液体培养基中黏连成团块,不利于遗传转化和转化子的筛选与鉴定。本研究在全蚀病菌遗传转化方面作了改进,利用菌丝机械破碎和溶壁酶不完全消化预处理菌丝,可以获得单细胞,并造成菌丝细胞的细胞壁创伤,有利于根癌农杆菌的侵染与T-DNA向全蚀病菌细胞内的转移。此外,用菌饼打孔器取转化后代新生菌丝,在含200 μg/mL Hyb的PDA培养基平板上连续4代继代培养与选择,有效去除了假阳性后代,获得了大批全蚀病菌GgtgdoRNAi转化子。本研究不仅为全蚀病菌提供了遗传转化改良方法,还为进一步研究gdo基因在小麦全蚀病菌生长发育和致病力中的作用奠定了基础。
gdo基因编码的GDO是细菌芳香烃降解3个重要途径中龙胆酸途径的第1个关键酶,而龙胆酸代谢途径是细菌细胞中芳烃化合物代谢进入三羧酸循环的一条重要通路。gdo基因在全蚀病菌等病原真菌中的作用迄今尚不了解。有人推测病原真菌中gdo基因可能通过催化原儿茶酸氧化环开环反应,破坏寄主细胞木质素,从而降低寄主抵御病原菌的能力[19-20]。本研究利用RNAi诱导全蚀病菌gdo基因沉默,发现该基因沉默导致全蚀病菌生长速率显著减缓,转化子致病力明显下降,首次初步证实了gdo基因在全蚀病菌生长和致病方面都具有重要作用。
本研究利用T-DNA区域内hptⅡ基因和T-DNA区域外的nptⅡ的特异引物对所用的4个转化子进行了真实性验证。这4个转化子在无抗生素PDA平板上的菌丝相对生长速率为S-6(59.00%)=L-2(59.00%)>L-4(42.00%)>M-5(30.00%)。接种小麦后,L-4和L-2转化子所侵染的植株发病情况最轻,根部呈白色,发根较多,平均株高、病情指数等与未接种全蚀病菌的小麦植株(CK)接近,病情指数明显低于野生菌KX-7;而转化子M-5、S-6则与野生全蚀病菌KX-7所侵染的植株病情指数相似,说明gdo基因沉默导致L-4和L-2转化子致病能力大幅度下降,但对转化子M-5、S-6的致病性影响不大。通过菌丝相对生长速率和致病性的比较分析发现,全蚀病菌菌丝相对生长速率和致病力两者之间似乎并不存在对应关系。例如,转化子M-5菌丝相对生长速率低于L-4和L-2,但致病能力却明显高于后两者。造成转化子之间在生长和致病力方面差异较大的原因可能与T-DNA整合位置以及拷贝数有关。但是,本研究只是少量转化子初步试验结果,后续研究需要利用更多转化子侵染小麦进行试验,并对转化子gdoRNAi插入位置、拷贝数以及gdo基因沉默程度进行系统分析,深入探讨造成gdo基因沉默转化子的菌丝生长速率和致病力差异的原因,进一步明确gdo基因在Ggt病原菌生长发育和致病性方面的作用。
本研究通过构建全蚀病菌gdo基因RNAi表达载体,转化全蚀病菌诱导gdo基因沉默,初步发现gdo基因与全蚀病菌生长和致病能力有关。但是,利用HIGS技术在小麦中诱导全蚀病菌gdo基因沉默的效果如何,尚待进一步研究证实。
