大豆SERK基因家族生物信息学及盐胁迫下的表达分析
2019-11-20何福林湖南科技学院化学与生物工程学院湖南省银杏工程技术研究中心湖南永州4599
何福林,刘 询,张 斌(. 湖南科技学院 化学与生物工程学院,湖南省银杏工程技术研究中心,湖南永州 4599;
2.南京农业大学 生命科学学院,南京 210095)
体细胞胚胎发生类受体激酶(Somatic embryogenesis receptor-like kinases,SERK)属于富含亮氨酸重复序列类受体激酶(Leucine-rich repeat sequence receptor-like kinase,LRR-RLK)家族的第二亚家族,在进化上高度保守[1]。SERK蛋白编码基因含有11个外显子,且每个外显子倾向于编码一个特定的蛋白结构域[2]。SERK蛋白通常包含7个保守的结构域,从N端到C端分别为1个N端信号肽、亮氨酸拉链结构域、5个富含亮氨酸重复序列结构域、1个SPP(Ser-Pro-Pro)结构域、1个跨膜结构域、胞内激酶活性区域和C末端区域[3]。SERK基因最早是从胡萝卜中分离鉴定出来的,其在体细胞胚胎形成过程中发挥重要作用。目前,已经在多种不同植物中鉴定出SERK家族基因,包括拟南芥[4]、水稻[5]、玉米[3]、小麦[6]、苜蓿[2]、苹果[7]等。然而有研究表明,SERK基因除了参与体细胞胚胎形成过程外,在植物的整个生长周期发挥多种生物学功能,如参与植物对病原菌和真菌的防御反应、响应非生物胁迫以及调控植物衰老过程。
拟南芥AtSERK1和AtSERK2基因在茎、叶、花和果荚中均有表达,但在花和果荚中表达水平相对较高,其可参与控制孢子体分化进而影响雄配子体发育,而AtSERK3和AtSERK4则参与调节油菜素内酯非依赖性的细胞死亡途径[8-9]。水稻OsSERK1可在幼苗叶片、茎和剑叶中表达且在剑叶中表达较高,其能被稻瘟病菌、宿主细胞死亡、防御信号分子(如水杨酸和茉莉酸)以及其他胁迫信号激活表达,过表达OsSERK1基因的转基因水稻则对稻瘟病的抗性增强[5]。而苹果MdSERK家族基因在根、木质部、韧皮部、叶和根尖中均有表达,其中MdSERK1、MdSERK7在根尖的表达相对较高,MdSERK2/5、MdSERK6/11在韧皮部表达较高,MdSERK4、MdSERK12在木质部和韧皮部表达较高,MdSERK3在根中的表达较高,MdSERK8、MdSERK9、MdSERK10在叶中的表达水平较高,另外,苹果MdSERK2/5、MdSERK3、MdSERK6/11基因的表达水平在ABA处理后上调,而盐处理能够激活MdSERK4、MdSERK6/11、MdSERK10的表达,提高其在叶中的表达水平[7]。此外,盐胁迫下大麦小孢子胚性愈伤组织中HvSERK家族所有基因的表达量都上调,其中HvSERK2基因在接种白粉病的大麦叶中表达水平也上调[10]。而苜蓿MtSERK1基因表达能够响应生长素处理[2]。这说明上调SERK基因的表达,可以提高植物对生物胁迫或非生物胁迫的适应能力。
尽管很多植物SERK基因已被分离鉴定并进行深入的功能研究,Yang等[11]从栽培大豆(Glycinemax)中克隆到1个SERK基因(Genbank登陆号:EU869193,即为本研究中的GmSERK16),并对其功能进行探究,发现该基因的表达水平在甘露醇、脱落酸(ABA)、水杨酸(SA)和茉莉酸(JA)处理后均上调,说明其在植物生长发育的多个方面发挥作用。但是关于大豆SERK家族基因的全基因组鉴定及在非生物胁迫下的表达模式的研究还很少。本研究从大豆全基因组中鉴定SERK家族基因,并对基因家族成员的染色体定位、基因和蛋白结构、系统进化关系以及在不同组织中的表达模式和盐胁迫诱导后的表达模式进行了分析,为进一步研究SERK家族基因在大豆生长发育过程和环境适应性方面的功能奠定基础。
1 材料与方法
1.1 SERK家族基因筛选及染色体定位分析
利用已知的拟南芥AtSERK(AtSERK1-5)蛋白序列在大豆数据库(http://soykb.org/search/gene.php)中进行比对,下载同源性较高的序列。下载的所有蛋白序列用数据库SMART(http://smart.embl-heidelberg.de/)和NCBI(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)检查是否含有SERK蛋白通常具有的保守结构域,然后剔除不具备这些保守域的大豆SERK蛋白序列。大豆SERK家族基因的染色体位置信息则从Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_Gmax)数据库获得,大豆染色体长度信息从NCBI数据库(https://www.ncbi.nlm.nih.gov/genome/?term=Glycine+max)中获得,利用Map Chart 2.2软件绘制GmSERKs基因的染色体定位图[12]。
1.2 基因结构、蛋白的保守结构及理化性质分析
大豆GmSERKs基因序列和CDS序列从Phytozome数据库下载,利用在线工具GSDS(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/index.php)绘制基因结构图,分析外显子、内含子的数量组成。采用MEME在线工具(http://meme-suite.org/)分析氨基酸序列上的保守基序(Motif)[13],参数设置:保守基序最小长度为6,最大长度为50,最大数量设置为10。而筛选出的大豆SERK蛋白分子质量(ku)及等电点(PI)则通过在线工具ExPASy(https://web.expasy.org/protparam/)进行预测。
1.3 进化树的构建
为了研究大豆SERKs与其他物种在进化上的关系,从TAIR数据库(https://www.arabidopsis.org/index.jsp)下载拟南芥SERK蛋白序列,水稻SERK蛋白序列从数据库RGAP(http://rice.plantbiology.msu.edu/)下载,玉米和苜蓿SERK蛋白序列从Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_ZmaysPH207)下载,根据已报道的苹果SERK基因号在数据库(https://www.rosaceae.org/)中下载对应的蛋白序列[7]。利用Clustal X对大豆、拟南芥、水稻、玉米、苜蓿和苹果SERK蛋白序列进行多重比较,将比对结果在MEGA 7.0软件中打开,用邻接法(neighbor-joining,NJ)绘制系统进化树,参数设置:Bootstrap为1 000,其他均使用默认参数[14]。
1.4 SERKs基因在大豆中的表达模式分析
大豆SERKs基因在不同组织和发育阶段的表达数据从大豆数据库SoyKB(http://soykb.org/)获得(即转录组数据中的RPKM值,Reads Per Kilobase per Million mapped reads),共列出了基因在嫩叶、花、1 cm果荚、10DAF(花后时间,Days after flowers)果荚壳、14DAF果荚壳、10DAF种子、14DAF种子、21DAF种子、25DAF种子、28DAF种子、35DAF种子、42DAF种子、根和根瘤共13个不同组织或发育阶段的表达数据。利用Heml 1.0软件绘制基因的表达热图[15]。
1.5 植物材料生长和处理
本试验使用的大豆为普通栽培大豆,其对应的全基因组数据库SoyKB(http://soykb.org/)使用的材料也是栽培大豆。大豆(Glycine max)种子用蒸馏水浸泡3 h后直接播种在营养土(品氏泥炭土,10~30 mm,丹麦)中,生长环境条件设置:温度恒温22 ℃,湿度60%~70%,光照为长日照(昼16 h/夜8 h)。待大豆长出三出复叶后,用1/2 Hoagland营养液(CK)和含有250 mmol/L NaCl的1/2 Hoagland营养液处理,分别在处理1 h、6 h、12 h时取三出复叶的其中一个完整叶片,每个时间点取3个独立的单株材料,用液氮速冻后暂存于超低温冰箱备用。
1.6 RNA提取和定量PCR检测
使用RNA提取液TRIzol(Invitrogen)抽提大豆叶片总RNA,然后跑电泳检测RNA提取质量。用Dnase I(TaKaRa)处理提取的总RNA以除去可能含有的DNA,避免检测基因表达水平时产生误差。使用反转录试剂盒(Thermo Fisher)合成cDNA,以合成的cDNA为模板进行qRT-PCR分析,操作步骤参照文献[12],PCR反应总体系为20 μL:用去离子水稀释后的cDNA 8.8 μL、正向和反向引物各0.6 μL和10 μL SYBR Green Mix(康为世纪),利用Bio-Rad CFX-96 PCR仪(美国Bio-Rad)进行PCR扩增反应,反应体系使用两步法:95 ℃,预变性3 min;95 ℃变性10 s,60 ℃退火延伸30 s,共40个循环。基因的相对表达量的计算利用2-ΔΔCT法[16]。以GmActin基因(Genbank登陆号:KP030799)为内参基因[17],具体引物见表1。

表1 本研究中用到的引物Table 1 Primers used in this study
2 结果与分析
2.1 大豆SERK家族基因鉴定及其染色体定位
利用拟南芥AtSERK家族蛋白序列在大豆基因组数据库中共筛选出25个大豆SERK基因,根据这些基因所在染色体顺序及基因编号,将其命名为GmSERK1~GmSERK25。对氨基酸序列分析可知,25个大豆GmSERK基因编码长度为596~644 aa(氨基酸,amino acids)长度的蛋白质,其中 GmSERK21蛋白序列最长(644 aa),而 GmSERK10蛋白序列最短(596 aa)。通过在线工具ExPASy对该家族基因编码蛋白的理化性质进行分析,发现对应的蛋白质的相对分子质量为67.15~70.70,GmSERK17的相对分子质量最大(70.70),而GmSERK10的最小(67.15)。此外,蛋白质的等电点(PI)为4.95(GmSERK12)~8.15(GmSERK2)(表2)。
大豆全基因组共含有20条染色体,而25个GmSERK基因分布在其中的12条染色体上(图1)。在第10、11、15、17、19和20号染色体上均只包含1个GmSERK基因,且主要分布在染色体靠近两端的区域;18号染色体最长(58.02 Mb), 1号染色体次之(56.83 Mb),但在1号和18号染色体上都只有2个GmSERK基因,同样在13号染色体上也包含2个GmSERK基因;而在2号、5号染色体上各包含4个GmSERK基因;8号染色体上GmSERK基因数量最多,共5个。
2.2 系统进化分析
为了研究SERK家族在大豆和其他物种中的进化关系,我们根据已有报道,从数据库下载了拟南芥、水稻、玉米、苜蓿和苹果的SERK蛋白序列,和大豆SERK氨基酸序列一起进行多重比对后,在MEGA 7.0软件中采用邻接法绘制系统进化树。根据SERK家族在苹果中的分组方法[7],大豆SERK家族可分为4个亚家族(Ⅰ、Ⅱ、Ⅲ、Ⅳ)(图2),第Ⅲ亚家族最大,共包含11个SERK成员,而在第Ⅱ亚家族中仅包含2个成员。大豆GmSERK14、GmSERK20基因与苜蓿MtSERK2-6在进化上关系较近,并且和苹果MdSERK1、MdSERK8、MdSERK9以及拟南芥AtSERK3-5共同属于第Ⅰ亚家族。大豆GmSERK4、GmSERK16、GmSERK25基因和拟南芥AtSERK1-2以及苹果MdSERK4关系较近,同属于第Ⅱ亚家族,且该亚族还包含玉米ZmSERK1-2基因和水稻OsSERK1-2基因。而在第Ⅲ亚家族中,大豆GmSERK1、GmSERK3与苹果MdSERK6、MdSERK11关系较近,GmSERK6、GmSERK21与MdSERK2关系较近,GmSERK2、GmSERK5与MdSERK5、MdSERK10进化

表2 本研究鉴定出的大豆SERK家族基因Table 2 Soybean SERK genes identified in this study

左侧的比例尺指示大豆染色体的长度(Mb),每条染色体左侧的数字代表基因定位在染色体上的位置(Mb) The scale bar on the left indicated the length (Mb) of soybean chromosomes,the number on the left of each chromosome represents the gene positions on the chromosome
图1 大豆SERK家族基因的染色体定位
Fig.1 Chromosomal location of SoybeanSERKgenes

进化树中包含25个大豆SERK家族成员,6个苜蓿SERK家族成员,5个拟南芥SERK家族成员,2个水稻SERK家族成员,2个玉米SERK家族成员,12个苹果SERK家族成员。“▲”标注的是大豆SERK家族成员,“●”标注的是拟南芥SERK家族成员 This tree includes 25 SERK proteins fromGlycinemax,6 SERK proteins fromMedicagotruncatula,5 SERK proteins fromArabidopsisthaliana,2 SERK proteins fromOryzasativa,2 SERK proteins fromZeamaysand 12 SERK proteins fromMalusdomestica. “▲”indicates members of the soybean SERK family,“●” indicates members of theArabidopsisSERK family.
图2 大豆和其他物种SERK的系统进化树
Fig.2 Phylogenetic tree of SERK proteins from soybean and other plants
关系较近,而大豆GmSERK15、GmSERK23、GmSERK18、GmSERK24与MdSERK3和MdSERK12的进化关系较近。
2.3 大豆SERK家族基因结构及氨基酸保守基序分析
为了研究大豆SERK家族基因在进化过程中的多样性变化,对基因结构进行分析。结果表明,大豆SERK基因在结构上较为保守,在5′末端和3′末端都含有非翻译区,除了GmSERK10和GmSERK17分别包含10个和12个外显子,其他基因都含有11个外显子。并且在进化关系上较近的基因长度、外显子分布及相同位置的外显子长度均保持类似,如GmSERK1和GmSERK3、GmSERK2和GmSERK5、GmSERK15和GmSERK23、GmSERK16和GmSERK25以及GmSERK18和GmSERK24等(图3)。此外,利用MEME在线工具分析了该家族基因编码的氨基酸序列上包含的保守基序(Motif),结果显示,所有的大豆SERK家族成员都含有10个保守的基序且长度和分布位置类似(图4)。说明大豆SERK家族基因在进化上整体关系较近,推测可能在功能上也类似。
2.4 大豆SERK家族基因在不同组织中的表达
植物基因的表达部位往往和其发挥的功能有紧密的联系,因此通过对大豆13个不同组织或发育阶段材料的转录组数据分析显示(图5),25个大豆SERK家族基因的表达模式呈现多样化。其中GmSERK1、GmSERK3、GmSERK4、GmSERK9、GmSERK16和GmSERK25具有类似的表达模式,在生长发育的各个阶段基本都有较高的表达,说明这些基因可能在植物生长的整个过程都发挥作用。而GmSERK2、GmSERK6、GmSERK7、GmSERK8仅在特定的阶段有较低的表达水平。此外,GmSERK5、GmSERK13、GmSERK14、GmSERK16、GmSERK20都在根中具有较高的表达水平,推测这5个基因可能根中发挥特定的功能。SERK家族基因在不同组织或阶段具有不同的表达模式,说明在进化上也存在差异,在植物生长过程中各自行使功能。
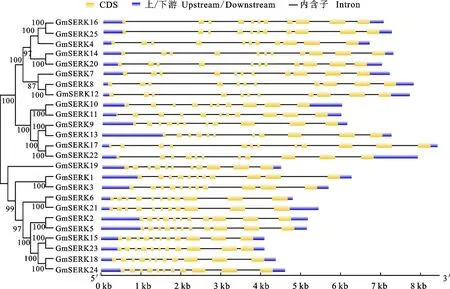
左侧为大豆SERK家族的进化树,右侧为大豆SERK家族成员对应的基因的内含子和外显子的分布结构 Phylogenetic tree ofSERKproteins from soybean (Left),Exon-intron structure ofGmSERKgenes(Right)
图3 大豆SERK家族基因结构及进化树分析
Fig.3 Gene structures of soybeanSERKgenes and phylogenetic relationships

左侧为大豆SERK家族的进化树,右侧为大豆SERK家族成员氨基酸序列上的保守基序分布 Phylogenetic tree of SERK proteins from soybean (Left),Arrangements of conserved motifs in the GmSERK proteins (Right)
图4 大豆SERK蛋白的保守基序分析
Fig.4 Conserved motifs analysis in the soybean SERK proteins

图例中不同的颜色代表不同大小的RPKM值,红色代表的RPKM值最大,蓝色最小 The different colors in the legend represent RPKM values of different sizes,with red representing the largest RPKM value and blue minimum
图5 大豆SERK基因在不同组织中的表达模式
Fig.5 Expression pattern ofGmSERKgenes in different tissues
2.5 盐处理对大豆SERK基因表达模式的影响
为了研究GmSERK基因在响应盐胁迫中的功能,检测部分GmSERK基因在盐处理后在叶片中的表达情况。根据系统进化树可知大豆GmSERK4、GmSERK16基因和苹果MdSERK4同源性较高,GmSERK1/3与苹果MdSERK6/11同源性较高,GmSERK2与MdSERK10同源性较高,而盐处理能够激活MdSERK4、MdSERK6/11、MdSERK10的表达,因此对大豆GmSERK1/3、GmSERK2、GmSERK4、GmSERK16基因在盐处理后的表达模式进行检测。发现GmSERK2基因表达未被诱导,而GmSERK1/3、GmSERK4、GmSERK16基因的表达水平在盐处理1 h、6 h、12 h时均上调(图6)。
3 讨 论
有研究表明,SERK基因能够参与体细胞胚胎形成、植物对病原菌的防御反应、响应非生物胁迫信号以及调节植物生长等多种生物学过程[2,6-7,18]。但是关于SERK基因家族的全基因组学分析的报道却十分有限。之前报道的在其他物种中鉴定出的SERK家族成员数量很少,在拟南芥中有5个SERK基因[4],从水稻中鉴定出2个SERK基因[5],苜蓿中则包含6个[2],而在苹果中共鉴定出12个SERK基因[7]。本研究利用拟南芥SERK家族蛋白序列在大豆全基因组数据库中进行多重序列比对,最终共鉴定出25个大豆GmSERK蛋白。而大豆的这25个SERK家族基因分布在12条染色体上,且它们编码蛋白的长度(596~644 aa)和相对分子质量(67.15~ 70.70)的差别不大。此外,通过构建系统进化树将大豆SERK家族成员分为4个亚族,而在苹果中的研究仅可分为3个亚族。SERK蛋白编码基因的一个典型特征是包含11个外显子,且每个外显子倾向于编码一个特定的蛋白结构域,苜蓿MtSERK1-6基因均包含11个外显子[2]。本研究中也得到类似的结果,25个大豆GmSERK基因中,除了GmSERK10和GmSERK17分别包含10个和12个外显子,其他基因都含有11个外显子。通常氨基酸序列决定着蛋白质的结构,而蛋白结构又决定其发挥的生物学功能,因此,对大豆SERK蛋白家族氨基酸上的保守基序进行了分析,发现所有SERK蛋白均具有相同的保守基序且在氨基酸上的分布情况也较为一致,通过以上结果可知,大豆GmSERK蛋白在进化上比较保守,可能具有类似的结构及生物学功能。

图6 盐胁迫下GmSERK基因的表达模式Fig.6 Expression pattern of GmSERK genes under salt stress
大豆25个GmSERK基因在嫩叶、花、不同发育阶段的果荚和种子、根和根瘤中的表达水平存在差异,如GmSERK1、GmSERK3、GmSERK4、GmSERK9、GmSERK16和GmSERK25基因的表达模式相近,都在生长发育的各个阶段有较高的表达水平;而GmSERK2、GmSERK6、GmSERK7、GmSERK8仅在个别组织或阶段有较低的表达;GmSERK5、GmSERK13、GmSERK14、GmSERK16、GmSERK20均在根中具有很高的表达水平,说明不同的SERK基因家族成员具有不同的表达模式,这和其他物种中SERK基因的表达模式一致。苹果MdSERK家族成员在根、木质部、韧皮部、叶和根尖中均有表达,其中MdSERK1、MdSERK7在根尖的表达量较高,而MdSERK2/5、MdSERK6/11在韧皮部表达较高,MdSERK4、MdSERK12在木质部和韧皮部表达较高,MdSERK3在根中的表达较高,MdSERK8、MdSERK9、MdSERK10在叶中的表达水平较高[7];而拟南芥SERK家族基因AtSERK1和AtSERK2在茎、叶、花和果荚中均有表达,但在花和果荚中表达水平较高[18]。有研究表明SERK基因在植物生物和非生物胁迫调控途径中发挥重要作用,因此本试验分析了盐处理后部分GmSERK基因的表达情况,发现GmSERK1/3、GmSERK4、GmSERK16基因的表达水平在盐处理后上调,这和苹果MdSERK4、MdSERK6/11、MdSERK10基因的表达模式一致,即MdSERK4、MdSERK6/11、MdSERK10基因也能够被盐胁迫诱导表达[7]。其中大豆GmSERK4、GmSERK16基因和苹果MdSERK4在进化关系上较近,GmSERK1/3与苹果MdSERK6/11较近。此外,与大豆GmSERK4、GmSERK16基因和苹果MdSERK4进化关系较近的苜蓿MtSERK1基因表达水平在生长素处理后表现出上调[2],同样苹果MdSERK4基因表达也能被植物激素诱导[7],推测大豆GmSERK4、GmSERK16基因可能也能被激素诱导表达。这说明大豆SERK基因可能通过复杂的机制参与植物盐胁迫适应过程。而本研究也为进一步研究SERK家族基因在大豆生长发育过程和环境适应性方面的功能奠定了基础。
