钛表面阳极氧化制备仿生化的微纳复合结构
2019-11-18王学玖2黄晓波
张 孟,王学玖2,黄晓波
(1.太原理工大学 表面工程研究所,太原 030024; 2.北京大学口腔医院 口腔颌面外科,北京 100050)
1 前 言
钛及钛合金因具有良好的力学性能、耐蚀性以及生物相容性而被广泛应用于骨植入体材料领域[1-3]。利用表面仿生改性的方法进一步提高其生物活性并用于骨植入材料正逐渐成为研究热点[4-7]。仿生化方法主要针对植入体在体内服役期间因骨整合不佳导致的松动乃至最后的植入失效问题,其基本思路是仿照天然骨组织的微观形貌(微纳复合结构)以及物质组成(胶原等有机物以及羟基磷灰石等无机物)方面的特点,利用物理、机械以及化学方法赋予植入体与骨组织类似的形貌及成分特点,来实现更佳的骨整合效果[5]。微弧氧化(MAO)主要依靠阀金属(如Zr、Ti、Ta、Mg、Al及其合金)瞬时弧光放电过程产生的高温高压条件在其表面原位生长出具有微米级孔的膜层,其主要成分为基体金属氧化物的陶瓷层[4, 8]。钛及其合金阳极氧化的研究主要集中于在F-电解液中制备TiO2纳米管阵列,利用其与骨组织中胶原纤维结构相似这一特点进行仿生学研究, 同时还可利用其较大的比表面积特点,进行功能元素的掺杂以提高其抗菌、骨生成以及血管化等方面的能力[6,9-10]。然而由于制备过程中F-会富集在纳米管阵列底部,形成水溶性的富氟层(FRL),而且各纳米管之间并不互相连接,极易产生膜层崩塌破坏,导致结合力较差,限制了其进一步应用[11]。因此也有学者采用其他刻蚀离子对钛及其合金进行阳极氧化制备类似的纳米管、孔状结构研究[12-13]。

2 实 验
2.1 微纳复合结构的制备
实验材料为纯钛(TA2,Φ14×2mm),采用SiC砂纸打磨并抛光,随后在丙酮、无水乙醇以及去离子水中分别超声清洗10min,60℃烘干备用。用铜胶带将铜导线固定于样品背面,随后用硅胶(704#)进行封装,自然晾干后用作阳极。采用直流稳压电源用于阳极氧化,石墨棒(Φ20×100mm)为阴极,Zn(NO3)2水溶液作为电解液,浓度梯度分别为1,5和12g/L,控制氧化电压分别为15,30,45和60V,室温下磁力搅拌进行阳极氧化5min,处理后的样品拆除封装物,再按上述方法超声清洗、烘干。
2.2 样品表征
采用场发射扫描电子显微镜(FE-SEM,JSM-6700F)对MNT样品表面微观形貌进行观察,并用附带的能谱仪(EDS,QX200)检测元素组成及含量。采用Nano Measurer软件对纳米孔阵列的孔径分布进行统计。阳极氧化后样品的表面粗糙度(Ra)采用3D-CLSM(C2 Plus)进行定量表征。采用X射线衍射仪(XRD,DX2700)对氧化层的物相组成进行检测。
2.3 细胞相容性检测
对60V电压下硝酸锌电解液阳极氧化制备的各组样品进行了细胞相容性评价,抛光纯钛作为对照。采用小鼠成骨细胞系MC3T3-E1为体外模型,培养基主要成分包含α-MEM干粉(10.2g/L)、NaHCO3(2.2g/L)、链霉素(100μg/ml)和青霉素(100units/mL),去离子水配置,过滤后加入10vol%胎牛血清(FBS)。细胞接种密度为2×104cells/cm2。成骨细胞粘附实验采用荧光染色的方法进行,培养时间分别为0.5,1和4h,到达时间点后采用DAPI染色,CLSM随机拍摄6个视野并统计其细胞数目。细胞活性检测采用Live/Dead染色法,培养周期为1,3和5d,活细胞染成绿色,死细胞则为红色。成骨分化实验中细胞接种至样品表面,用完全培养基培养3d后,完全培养基添加骨诱导成分培养基骨诱导3和7d,随后用碱性磷酸酶试剂盒进行染色,光学显微镜拍照(DM2700 M, 莱卡)。
3 结果与讨论
3.1 微观形貌
图1为控制氧化电压以及电解液浓度制备的氧化层表面形貌照片,选择低倍下有凹坑的区域拍摄纳米孔阵列。从图可见,15V电压下样品形貌平整、无明显变化,也未见纳米孔阵列的出现。在30,45和60V电压下,均可制备出在微米级凹坑内部规整排列的纳米孔阵列,并且随电压及电解液浓度变化,凹坑的起伏有所变化。

图1 控制氧化电压以及电解液浓度制备的膜层形貌照片Fig.1 Surface morphology of the samples prepared by controlling the voltage and electrolyte concentration
图2为纳米孔阵列孔径变化柱状图。从图可见,随电压以及电解液浓度增大,纳米孔平均孔径逐渐增大,且保持在20~40nm之间。同时也说明在硝酸根存在的前提下,氧化电压的大小对于纳米孔形成起到了决定性的作用。由图3的样品表面粗糙度变化结果可见,Ra值呈现出随电解液浓度降低而增大,并且随氧化电压升高而增大的趋势。实验参数范围内,粗糙度最大可达到Ra=2.5μm。并且从图中还可以看到,电解液浓度的变化对于膜层粗糙度的影响明显大于氧化电压。
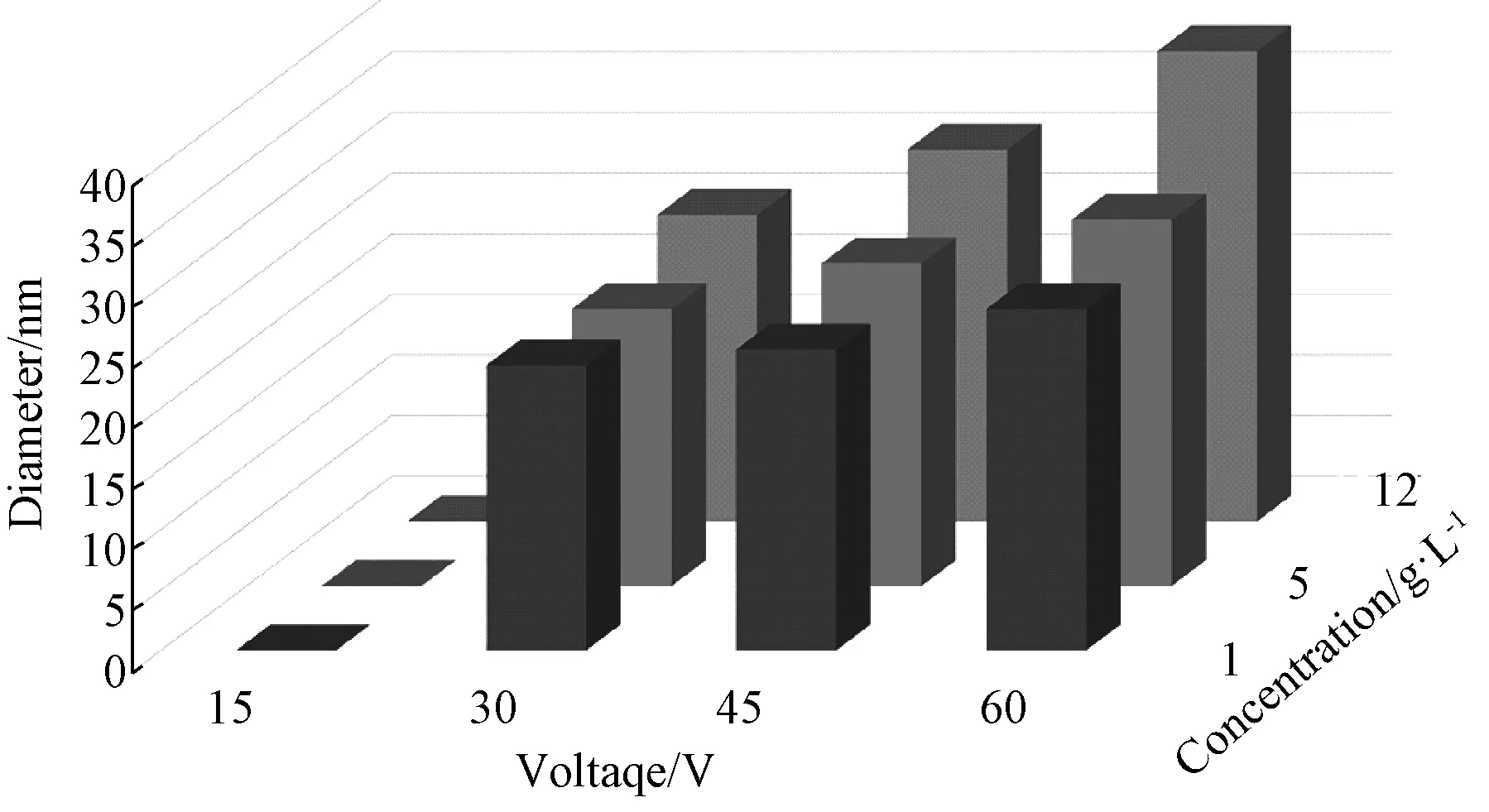
图2 微纳复合结构孔径统计结果Fig.2 Statistical results of pore diameter on MNT film
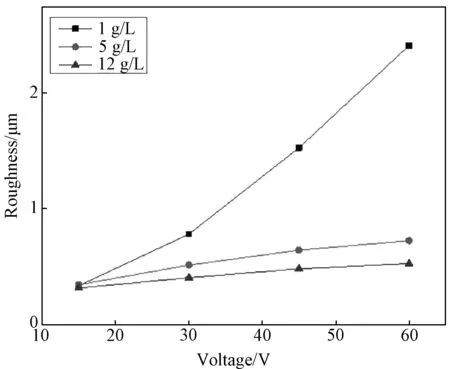
图3 膜层的粗糙度变化Fig.3 Roughness variation of the film
结合微纳复合结构形貌、孔径变化以及微观粗糙度的结果,得到了以下结论,在硝酸根电解液下采用阳极氧化也可以制备出微弧氧化电源高电压加载时类似的微纳复合结构[14]。不同于F-电解液制备出的单一纳米管阵列,该微纳复合结构形成过程中存在一定的电压阈值(30V)。无论采用微弧氧化或阳极氧化电源,都会经历氧化初期大电流放电对于氧化层的击穿以及刻蚀离子稳定刻蚀的阶段;另外,单独增大氧化电压或电解液浓度,都会使得纳米孔孔径增大。但是膜层粗糙度随氧化电压增大而增大,随电解液浓度增大而减小,这可能是由于较大的电解液浓度导致溶液电阻增大,进而对膜层的击穿效应减弱。
3.2 元素及物相组成
表1为氧化电压为60V下各组样品表面元素组成及含量。膜层中含有Ti、O以及少量的C元素。Zn元素含量在0.1at.%左右,因此可以认为没有掺杂到膜层当中。根据Ti、O元素原子比(1∶2左右)可推测膜层主要成分应该为TiO2。样品表面的XRD(图4)结果中仅有较强的基体(Ti)峰,并未出现明显的TiO2峰。这可能是由于采用常规检测方法(非小角掠射),且Ti的氧化物含量较少的原因。实际上,无论采用常规检测或小角掠射,XRD结果中均未检测到明显晶态TiO2物质存在,结合前期工作,可以认为硝酸根电解液中阳极氧化制备的样品表面主要由少量非晶态的TiO2以及纯钛(Ti#44-1294H)组成[14-15]。
3.3 细胞相容性
细胞早期粘附能力如图5所示。三个培养时间点下,5g/L电解液制备的样品表面粘附细胞数较其他各组显示了统计学上的差异,而其他各组之间并无明显差异。这可能是由于5g/L制备的样品表面粗糙度较小,而粗糙度的大小会影响成骨细胞黏着斑蛋白的合成以及细胞与微纳复合的外基质接触时的界面压力,进而影响细胞粘附效果[16]。
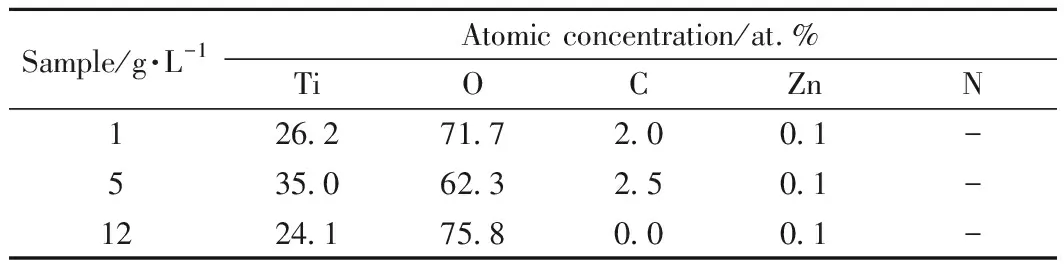
表1 60V电压下各组样品的EDS结果Table 1 EDS results of each group at 60 V
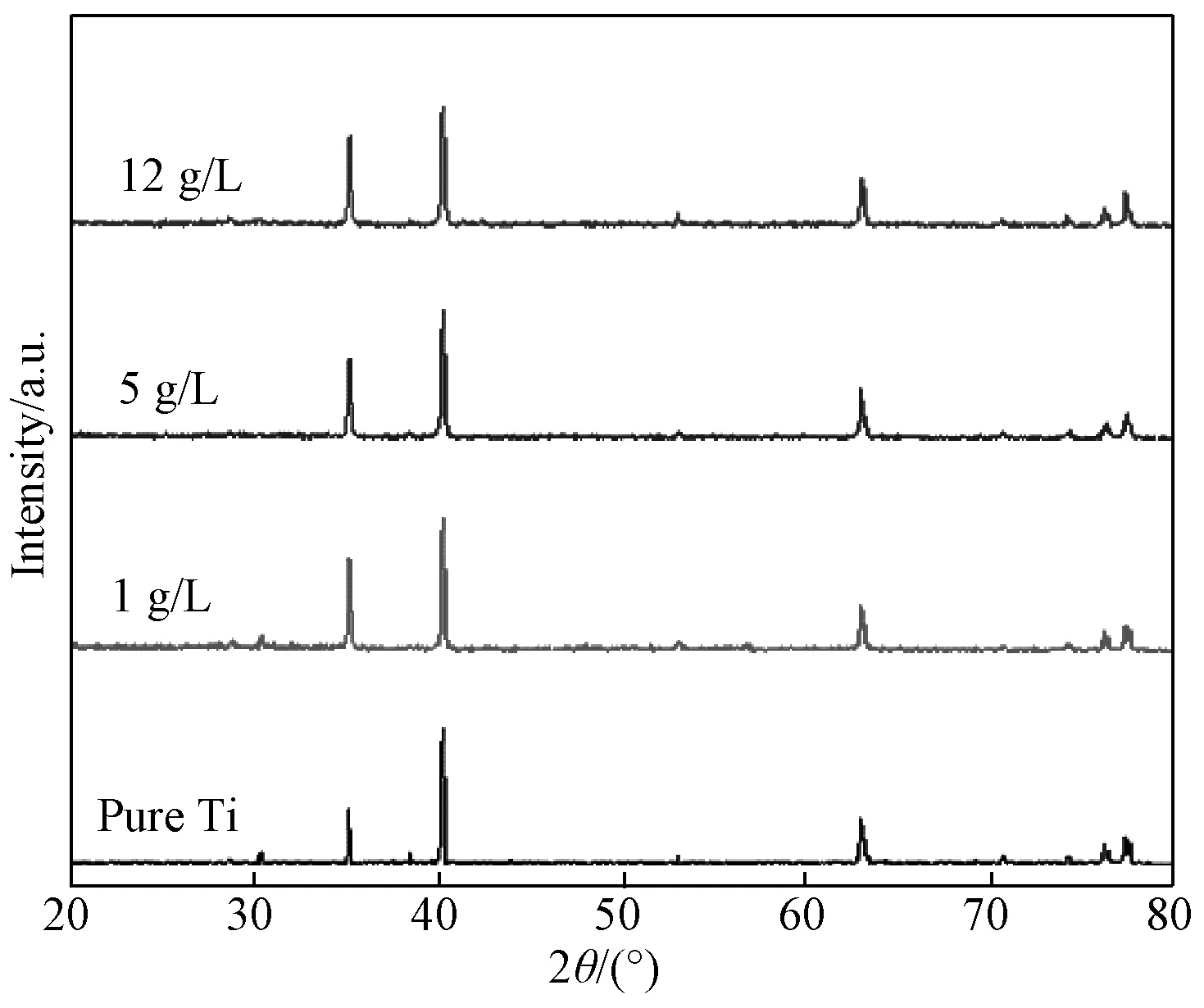
图4 60V电压下各组样品的XRD图谱Fig.4 XRD spectra of each group at 60V
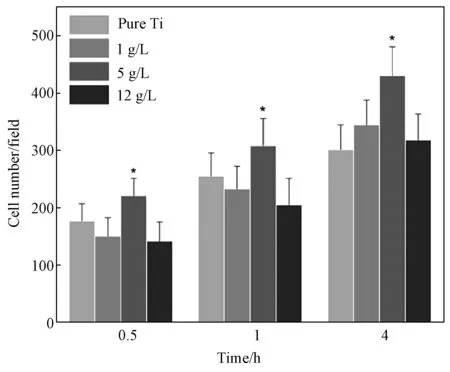
图5 成骨细胞在微纳复合结构上的粘附能力,*p 表示相对于5g/L下的样品为一般显著Fig.5 Osteoblasts adhesion ability on MNT film, *p<0.05 compared to samples anodized in 5g/L electrolyte
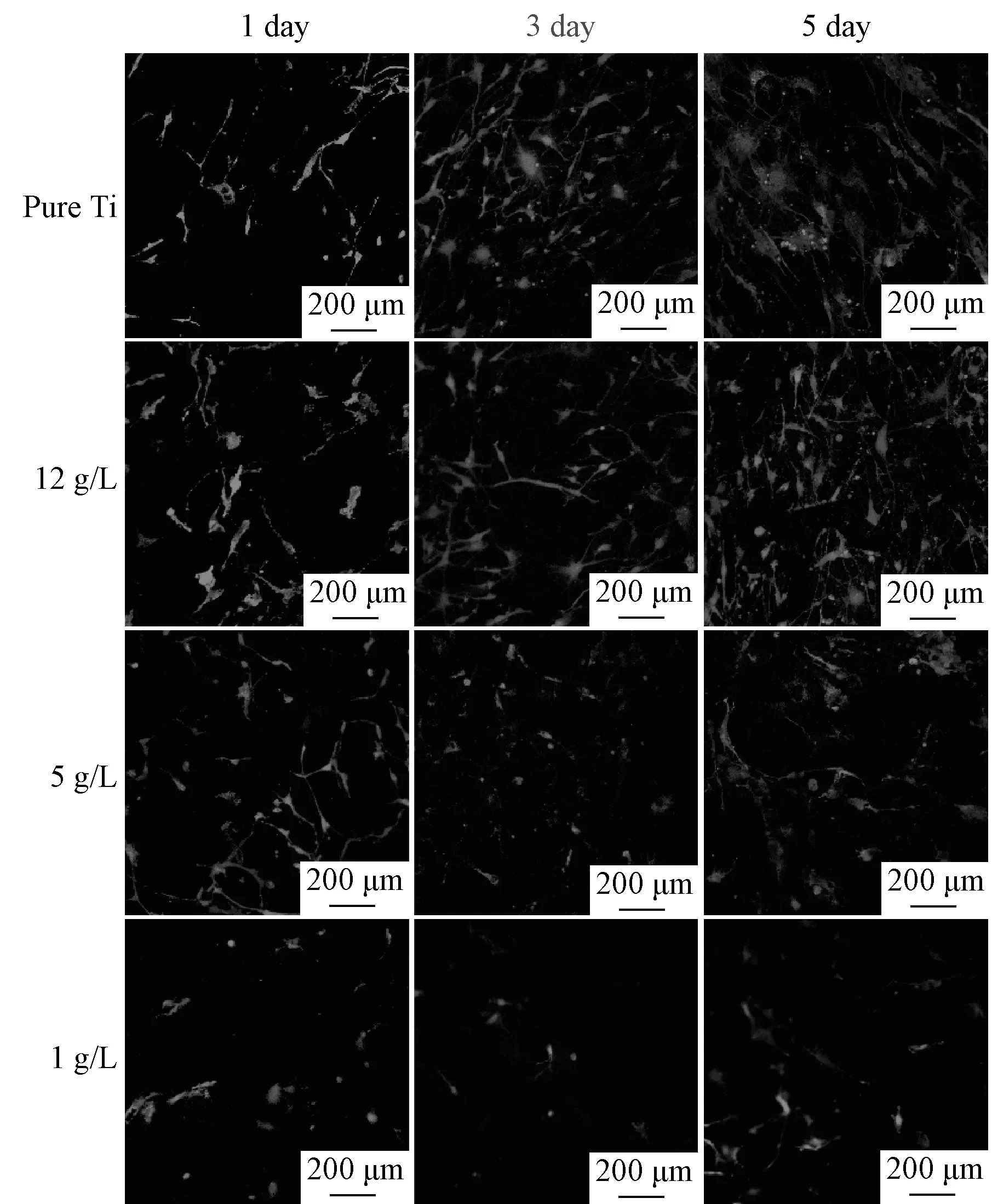
图6 成骨细胞活性检测(本刊黑白印刷,预知具体颜色请联络作者)Fig.6 Viability assay of osteoblasts
图6为细胞活死染色结果,其中绿色为活细胞,红色为死细胞。随着培养时间的延长各组样品表面绿色荧光强度逐渐增大,而未见明显的死细胞(红色)。除纯钛外,其他各组样品体现出随电解液浓度降低,细胞数量以及形态均逐渐变差的趋势。原因可能是,经阳极氧化后,样品表面由生物惰性的纯钛转变为生物活性的TiO2膜层,使得其细胞活性有所提高;另一方面,仿生化的微纳米复合膜层也在一定程度上促使细胞迁移、增殖等活动受到抑制,使得与细胞分化相关的物质(诸如骨钙素、碱性磷酸酶等)提前表达[17]。从上述的结果及理论层面来看,具有生物活性的TiO2膜层表面成骨细胞活性组间差异较大,这主要是由于表面粗糙度对于细胞的增殖以及分化之间的调节作用。

图7 膜层上成骨细胞的碱性磷酸酶活性Fig.7 ALP activity of osteoblasts on the MNT film
碱性磷酸酶分泌的出现通常被认为是细胞进入分化阶段的主要标志。成骨细胞经诱导分化后的ALP活性检测结果(图7)说明,随着电解液浓度的逐渐降低(Ra增大),成骨细胞在样品表面的ALP活性逐步增强。当Zn(NO3)2浓度为5g/L时,成骨细胞表现出最佳的ALP活性,而浓度为1g/L时反而有所下降。这是因为氧化后的样品表面粗糙度较大,导致细胞粘附数量较少所引起的。另外,平整的表面虽然对细胞活性或者增殖有一定的促进作用,但相比于有微米级形貌的样品而言,其表面的细胞较晚结束细胞增殖阶段,而微米级形貌表面的样品则较早进入细胞分化阶段,因此会显示出较强的细胞分化能力[18]。
4 结 论
1.采用Zn(NO3)2电解液对纯钛进行阳极氧化,在电压大于30V时可稳定形成TiO2微纳复合结构。膜层的表面粗糙度随电压增大,随电解液浓度降低而增大,纳米孔孔径则随电压及Zn(NO3)2浓度增大而增大。
2.膜层主要由非晶态TiO2组成。
3.经氧化后的样品表面粗糙度在Ra=0.8μm左右可以促进细胞的粘附以及ALP活性,较为平整的表面(Ra<0.5μm)则有利于提高细胞活性。
