表面介孔柞蚕丝素蛋白微球的制备及药物释放性能
2019-11-18
(1.中原工学院 纺织学院,河南 郑州 451191; 2.河南省功能性纺织材料重点实验室,河南 郑州 451191)
1 引 言
药物释放系统是以高分子作为载体或介质,使药物或其他生物活性物质等制剂,按照设计剂量和可控方式释放的装置,以达到缓释给药、靶向给药和智能给药等目的。在药物缓释体系中,药物载体起着关键性作用,常为微球、微囊和丸剂等形状[1]。微球比表面积大、吸附性和表面活性高,现已在生物和医药等领域得到广泛应用[2]。
目前,微球载体主要有海藻酸钠(SA)、聚乳酸-羟基乙酸共聚物(PLGA)、壳聚糖(CS)等及其衍生物以及蚕丝蛋白(SF)等生物降解材料[3]。例如,利用静电喷雾法制备的CS/康普瑞丁载药微球,其平均粒径仅为270nm,但使用戊二醛蒸汽交联使其在生物应用方面受限[4]。同时,相比CS、PLGA、SA等材料,SF因优异的生物相容性及较高的缓释性等优点[5],目前已广泛用作药物、酶和疫苗的载体[6]。近年来,纳米和亚微米尺度的丝素微球成为药物缓释载体的研究热点。已报道的制备SF微球方法有乳化法、喷雾干燥法、层流射流技术和自组装法等[7]。自组装法因其简便性和安全性目前已得到广泛应用。Andreas S. Lammel等[8]利用盐析法制备粒径(0.5~2μm)、二级结构和zeta电位可控的丝素微球,并研究了药物释放性能。研究表明,微球的形成基于丝素分子间及链间相互作用,可以通过调控pH值和盐的浓度;微球的药物释放性能主要受二级结构和电荷之间相互作用的影响。Cao等[9]利用自组装的方法制备粒径在0.2~1.5μm的纯丝素微球,通过控制乙醇添加量、冻干温度和丝素蛋白溶液浓度可以调控丝素微球的粒径和分布。Wang等[10]利用SF/聚乙烯醇(PVA)共混—再溶去PVA—低压冻干制备包埋药物的SF微球,粒径在0.3~20μm,控制药物的分子量及水溶性可以有效调节释放速率和释放量。Pujiang Shi等[11-12]通过丝素蛋白与乙醇和PVA自组装制备丝素微球,微球的形貌、粒径和分布可通过乙醇和PVA的用量调控。Chen等[13]通过抗癌药特素和丝素蛋白溶液自组装,冷冻—解冻3h(快速)制得载药丝素微球,其载药率最大可达6.9%,持续释放时间超过9d。
以上关于丝素微球的研究都基于桑蚕丝。与桑蚕丝相比,具有同源性的柞蚕丝(Tussah Silk Fiber,TSF)除具有和桑蚕丝一样的优异性能外,还含有特殊的精氨酸(Arg)―甘氨酸(Gly)―天门冬氨酸(Asp)三肽序列(RGD)。Minoura等[14]的研究显示,柞蚕丝中特有的RGD三肽序列更有助于细胞的粘附与铺展。本研究采用自组装方法制备TSF微球,意在增加其比表面积,获得表面介孔TSF微球,减少微球初期爆释和延长微球释放时间,以期得到能够应用于药物缓释的柞蚕丝素微球。
2 实 验
2.1 材料与试剂
柞蚕茧(去蛹);磷酸二氢钠、无水碳酸钠、一水合氢氧化锂、硫氰酸铵、磷酸氢二钠,均为分析纯;透析袋(MWCO~14000);5-氟尿嘧啶(5-Fu);实验用水均为去离子水。
2.2 TSF溶液的制备
将柞蚕茧(去蛹)置于0.5%(w/w)Na2CO3溶液于100℃下脱胶3次。将所得的丝素纤维在75 ± 2℃条件下,用硫氰酸锂(硫氰酸铵和氢氧化锂合成)溶解2h,浴比为1∶30。溶液过滤后置于透析袋中(MWCO8000~14000Da)透析3d,过滤得到浓度约为0.5%的丝素蛋白溶液,冷藏备用(4℃)。
2.3 TSF微球的制备
将100mL 0.5%的柞蚕丝素蛋白溶液置于透析袋中,缓慢升高水浴温度至20℃,静置3d,将所得溶液反复洗涤并冷冻离心得到微球。称取所需重量的微球,超声分散于超纯水中配置所需浓度的柞蚕丝素蛋白溶液。同时,进行2组对比实验,分别将等量的TSF溶液置于-20℃冻干和4℃自然晾干,对比其形貌和结构的变化。
2.4 载药TSF微球的制备
使用5-Fu 作为标志性药物,取浓度为1mg/mL 的药物500mL添加到一定浓度的TSF微球悬浮液内,将混合溶液在室温下分散处理10min,然后高速离心15min。使用紫外可见光分光光度计(UV-Vis)测定溶液中剩余5-Fu最大吸收波长为264nm处的吸光度,计算载药率(式(1))和负载率(式(2))。所有实验均重复3次求平均值。

(1)

(2)
2.5 表征与测试
2.5.1形貌观察 样品喷金90s后,用场发射扫描电镜(FESEM,Zeiss Supra 55VP)观察其形貌。同时,随机抽取100个微球,用图形处理软件统计确定微球的粒径和分布。
2.5.2红外光谱分析 样品研磨经溴化钾压片后,利用红外光谱仪(IR,NEXUS670)在4000~600cm-1范围内扫描红外吸收光谱,分辨率为2cm-1。
2.5.3X射线衍射测试 将样品置于X射线衍射仪(XRD,D/max-2550PC)特有的样品槽内并保持表面平整,采用XRD测试样品的结晶程度,扫描速率为2°/min。
2.5.4热学性质 在50~350℃范围内,用差示热量分析仪(DSC,DSC822e)测试样品的热性能。测试条件:N2流量120mL·min-1,升温速度为10℃·min-1。
2.5.55-Fu的体外释放实验 将100ml负载5-Fu的TSF微球溶液置于透析袋内,滴加5mL磷酸缓冲溶液(pH=7.4),充分震荡使其分散均匀。然后将透析袋置于1000mL磷酸缓冲溶液(pH=7.4)中37℃震荡。利用UV-Vis来定期检测浸渍液在264nm处的吸光度(取10mL浸渍液,补充10mL磷酸缓冲液),依据朗伯比尔定律计算TSF微球中5-Fu的释放曲线。所有实验均重复3次,求平均值。
3 结果分析与讨论
3.1 TSF微球的微观形貌及载药性分析
不同温度成形条件下TSF制品的SEM照片如图1所示。从图可见,不同条件所制得的TSF制品形貌有明显差异。经过-40℃冻干形成TSF冻干膜,含有大量纤维状物质,多孔结构明显,但未见微球存在(图1(a))。TSF膜(室温晾干)体系均一,表面平整光滑,成膜性良好(图1(c))。20℃自组装晾干后所得产物为TSF凝胶微球(图1(b)),微球大小均匀,粒径在1.06±0.85μm,但微球之间粘连紧密,无法在溶液中直接分散,限制了其在药物释放中的应用。TSF溶液在20℃水浴中自组装后离心可制得单分散的TSF微球(图1(d)),其形貌近似球形,基本无粘连。经统计计算,其粒径大小为500nm~6μm(图2)。较宽的粒径分布可能有助于药物释放速率的控制。与一般微球相比(表面光滑),所制的TSF微球表面分布有许多小孔,具有多孔结构,且孔的形状均匀规则,孔与孔之间相互贯通(如图1(e)~(f)),这些小孔有利于物质之间的交换或传递。微球的形成主要是由于组成TSF中的疏水链段疏水键的作用形成晶核,亲水链段和疏水链段依次交替沉积,形成微球结构[15]。其表面介孔结构的形成可能是自组装微球表面没有形成氢键的—COOH和—NH2缔合微量的水分子,离心干燥后,水分蒸发所致。
实验所制备出的不同结构的TSF蛋白材料的载药性具有较大的差异。TSF膜、冻干膜(海绵体)和凝胶微球的载药率和负载率均较低,TSF膜的载药性较差(载药率为0.3%,负载率为3.2%)。凝胶微球的载药率和负载率略有提高,达到0.7%和8.6%。TSF冻干膜的载药率和负载率仅为1.2%和11.7%。所制备的单分散表面介孔微球的载药性显著提高,载药率达到2.6%,负载率达到30.4%,TSF生物相容性良好,是理想的药物载体。由于所制备材料均为TSF,说明材料的物理结构,尤其是比表面积和表面微细结构对材料的载药性有明显影响。
3.2 FTIR分析
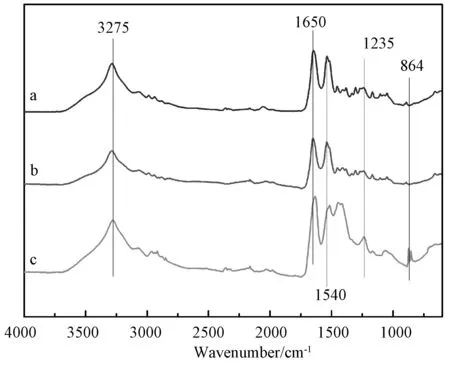
图3 不同TSF制品的红外光谱 (a) 冻干膜(-40℃); (b) 膜(4℃晾干); (c) 单分散微球(20℃水浴,离心)Fig.3 FTIR spectra of TSF products (a) freeze-dried membrane(-40℃), (b) membrane(airing at 4℃), and (c) monodisperse microspheres (water bath at 20℃,centrifugal purification)
TSF的二级结构具有不同的红外吸收峰。其中,α-螺旋结构红外吸收峰在1660~1650cm-1(酰胺Ⅰ)和1550~1540cm-1(酰胺Ⅱ)处;无规卷曲结构在1650~1640cm-1(酰胺Ⅰ)、1545~1535cm-1(酰胺Ⅱ)和1235cm-1(酰胺Ⅲ)处,而β-折叠结构的红外吸收峰位于1640~1610cm-1(酰胺Ⅰ)、1525~1515cm-1(酰胺Ⅱ)和1265cm-1(酰胺Ⅲ)处[15]。图3给出了不同条件下TSF制品的红外光谱。3275cm-1处的强吸收峰归属于蛋白质N-H伸缩振动峰。864cm-1处的吸收峰归属于TSF酪氨酸的吸收峰。TSF冻干膜和晾干膜的主要红外吸收峰均出现在1650cm-1和1540cm-1附近(图3a、b),表明其主要以α-螺旋结构存在。
但表面介孔TST单分散微球具有特殊的二级结构(图3c)。酰胺Ⅰ和酰胺Ⅱ的吸收峰分别出现在1635cm-1和1515cm-1附近,表明TSF微球主要以β-折叠结构为主。同时酰胺Ⅲ(1235cm-1处)的吸收峰明显增强,表明无规卷曲构象增多。微球结构的变化是由于在TSF组装成微球的过程中,α-螺旋结构TSF分子的疏水链段依靠疏水作用规整排列形成晶核,未形成晶核的亲水链段相互缠结,结晶沉降自组装卷曲成为微球,而外层分子排列不均匀,形成无规卷曲结构。864cm-1处酪氨酸的吸收峰明显增强,也说明表面富含极性氨基酸,进一步证实TSF微球表面形成介孔结构的推测。
3.3 XRD分析
以往研究中,研究者一般通过醇处理诱导TSF产生构象转变形成β-折叠结晶结构来提高TSF材料的稳定性,但可能存在醇的残留。样品的XRD图谱如图4所示,表面介孔TSF微球的结晶结构发生明显变化。TSF膜在11.9°和22.97°附近出现归属于α-螺旋结构的特征峰[15],表明TSF主要是以α-螺旋结构存在(图4(a))。表面介孔TSF单分散微球在19.84°附近显示很强的尖峰,在16.84°和23.89°附近分别出现两个肩峰,在29.1°、39.31°和43°附近均出现弱的衍射峰(图4(b)),说明TSF微球主要以β折叠结构为主[16]。这与FTIR分析结果相一致。
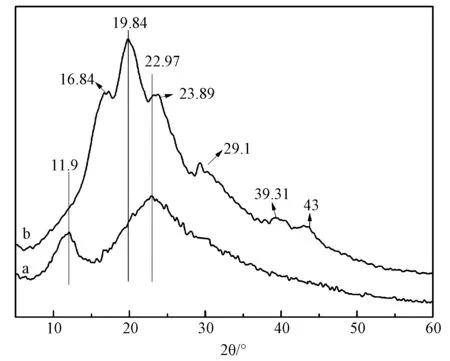
图4 TSF制品的XRD图谱 (a) 膜(4℃晾干); (b) 单分散微球(20℃水浴,离心)Fig.4 XRD patterns of TSF membranes (a) and monodisperse TSF microspheres (b)
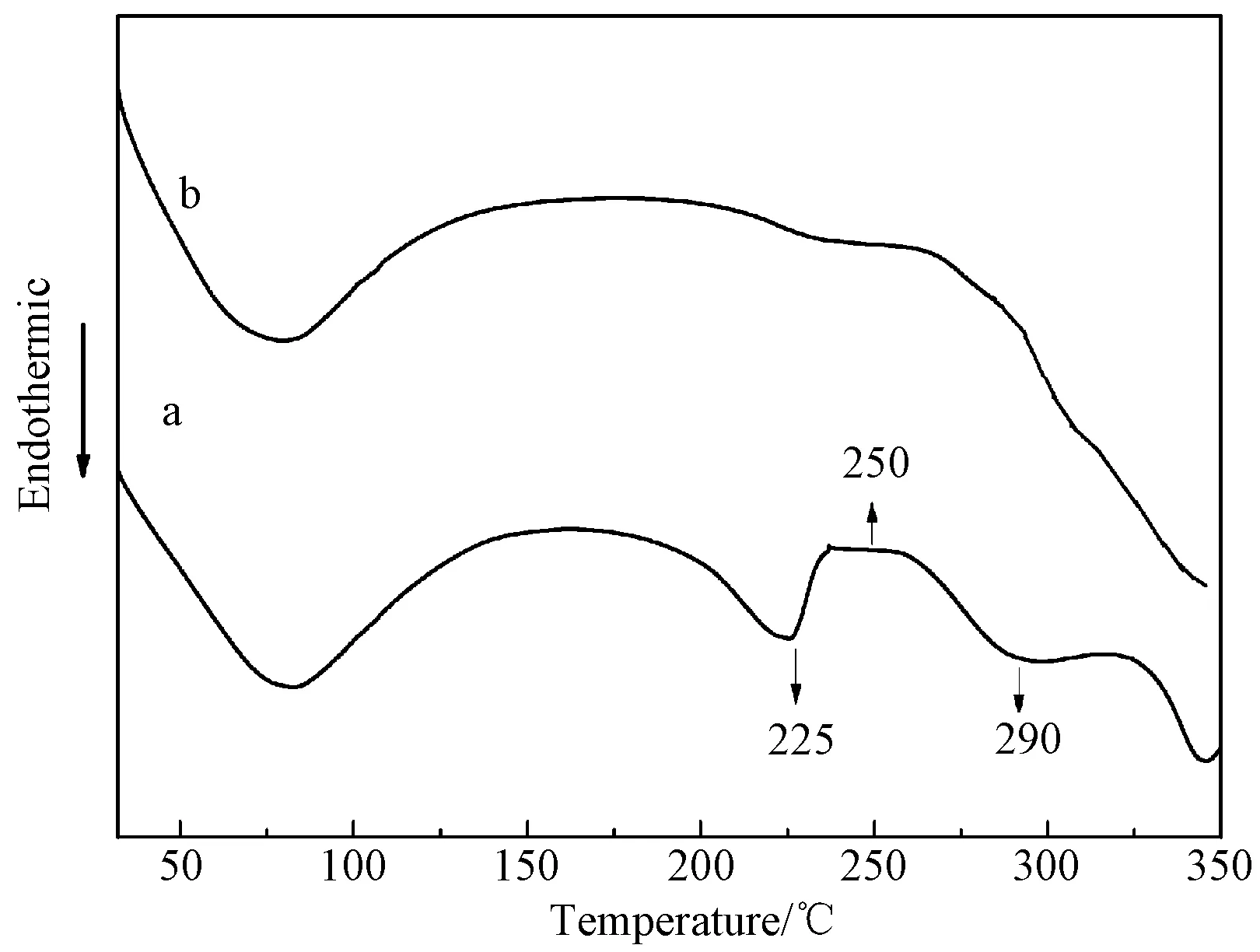
图5 TSF制品的差示扫描热分析曲线 (a) 膜(4℃晾干); (b) 单分散微球(20℃水浴,离心)Fig.5 DSC curves of TSF membranes (a) and monodisperse TSF microspheres (b)
3.4 热性能分析
图5为TSF膜和表面介孔TSF微球的DSC曲线。再生TSF膜在348℃处出现热分解峰,在200~250℃区域显示吸热-放热转变,这应该是由β折叠构象增加引起的[16]。
表面介孔TSF微球DSC曲线与再生TSF膜的有明显差异。在200~250℃区域的吸热-放热转变基本消失,表明微球中TSF分子主要为β结构。这与前面IR和XRD的分析结果一致。这是由于TSF自组装过程中,温度诱导TSF分子产生晶核并形成结晶结构。
3.5 5-FU的体外释放性能
表面介孔TSF微球对5-FU具有明显的缓释作用(如图6所示),且随着时间的增加,缓释量增加。在前2h内,药物有一个小突释,释放量约20%(小于40%,不构成突释现象)[17]。这可能是TSF微球表面及空隙间吸附少量的5-FU解吸附或负载在TSF微球无定型区的5-FU随该区的溶胀快速释放所致。随后5-FU稳定缓慢释放,在120 h 能有效释放90%。可能是5-FU负载的TSF微球具有多分散的粒径及表面和内部连通的孔洞,使得5-FU具有不同的解吸附速率,延长其缓释时间。说明包载5-FU的表面介孔TSF微球释放较为平缓,稳定性好,缓释效果显著。此法能够在非高温、不搅拌、水溶液中的温和条件下制备表面介孔TSF微球,不损伤其生物活性。这说明表面介孔TSF微球是一种有潜力的基因类药物控释材料。
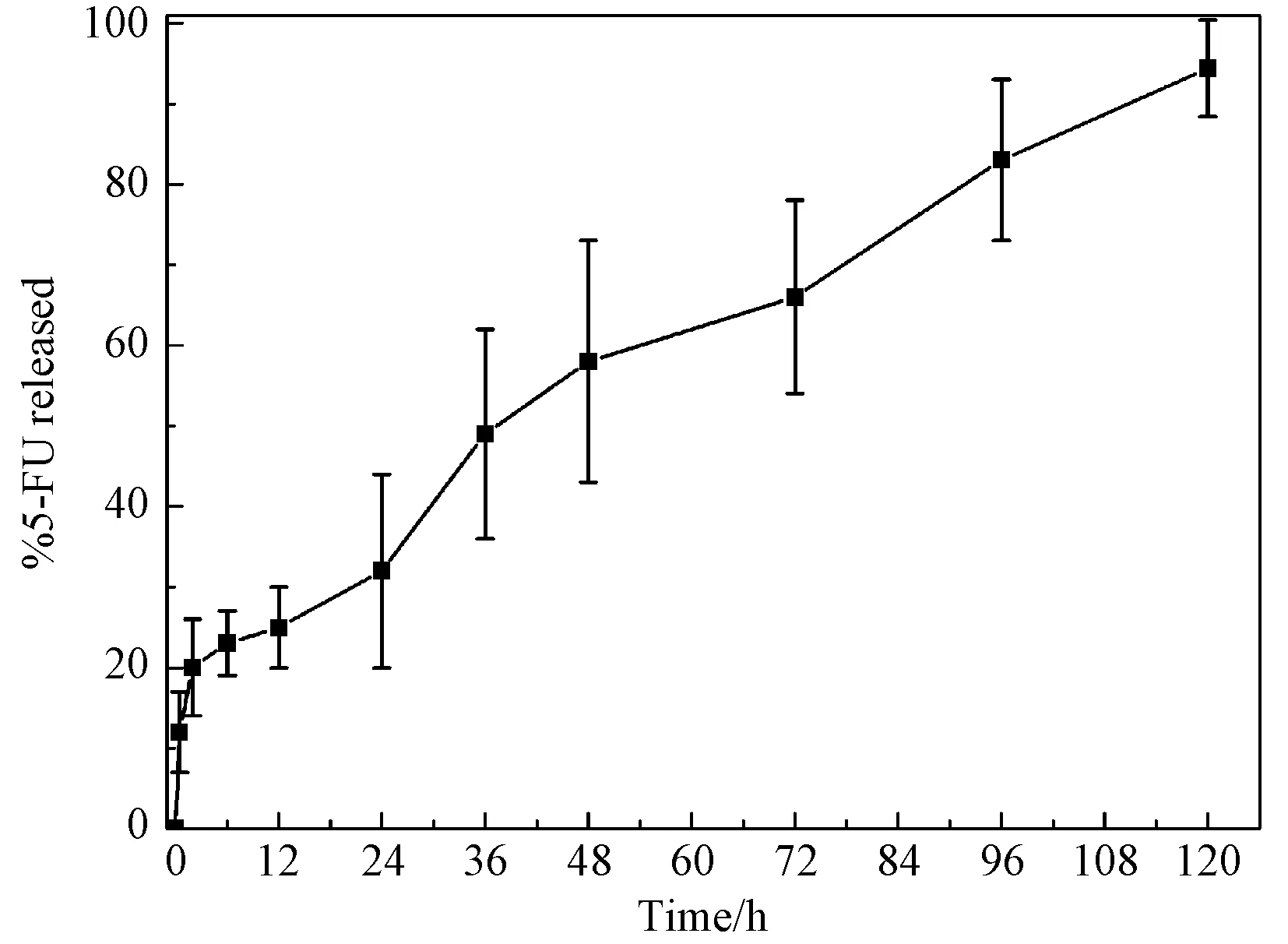
图6 5-FU负载TSF微球的体外释放图谱Fig.6 In vitro 5-FU release profiles of TSF monodisperse microspheres
本研究所制备的表面介孔TSF微球粒径范围为500nm~6μm,表面分布有许多形状规则均匀的多孔结构。构象以β-折叠结构为主,同时存在无规卷曲结构。在前2h内,药物有一个20%小突释,随后5-FU稳定缓慢释放,在120h能有效释放90%,这表明表面介孔TSF微球对5-FU缓释能力显著。较宽的粒径分布、多孔结构及特殊的二级结构可能有助于药物释放速率的控制。表面介孔TSF微球是一种有潜力的基因类药物控释材料。
