盐胁迫下不同地锦属植物的生理响应及耐盐性研究
2019-11-18孙浩冉
孙浩冉,孙 淼
(1.郑州工程技术学院 化工食品学院,河南 郑州 450044;2.南阳农业职业学院 图书馆,河南 南阳 473000)
盐渍化土壤抑制作物生长,影响粮食产量,降低土地利用价值,是环境和农业可持续发展的主要破坏因素之一,也是世界性生态难题[1]。目前全球超过20%的农田和旱地遭受盐渍化的威胁[2]。我国作为世界上土壤盐渍化最严重的国家之一,盐渍化的治理一直是研究的热点和难点之一。盐渍化土壤易滞水,不易疏干,地温低,降低了酶的活性,抑制微生物代谢和有机质转化,导致土壤肥力下降。另一方面,盐离子含量偏高升高了土壤中溶液的渗透压,导致植物出现生理性缺水,生长发育被抑制。目前,盐渍化土壤的治理可通过两种手段来实现:一是利用生化或物理的手段降低盐含量,增加土壤肥力,满足植物生长发育的需要;二是种植耐盐植物来逐渐改善和提高土质。其中,后者是盐渍化治理的一种更为经济有效的手段,受到人们的广泛关注。
地锦为多年生藤本植物,具有喜攀爬、观赏性强等特点,其根茎可入药,具有活血、消肿的功效。作为立体绿化的首选植物,地锦对SO2等污染物具有较强的吸收力,同时在防沙护坡、保持水土等方面显示了独特的生物学特性。目前对地锦的研究多集中在医学和药用价值、城市园林绿化、生态、食品等方面,对其耐盐性研究较少。通过研究170 mmol/L NaCl对6个不同地锦品种种子发芽、幼苗生长及生理生化指标变化的影响,根据耐盐程度进行分类,为选育合适的品种及盐碱地改良提供科学依据。
1 材料与方法
1.1 试验材料与设计
试验地锦共6种:异叶地锦、花叶地锦、三叶地锦、绿叶地锦、五叶地锦和栓翅地锦,分别用符号T1,T2,T3,T4,T5和T6表示。试验前用95%乙醇将种子消毒,蒸馏水冲洗,温水浸泡48 h后置于培养皿中(每皿25粒),设置2个处理:0(CK),170 mmol/L,每个处理重复3次。每天定时观察记录,15 d后测量苗长、胚根长、茎叶干鲜重,计算发芽率、发芽指数、活力指数。
分别将各品种种子播种于128孔育苗盘中,于一叶一心时选取长势健壮的幼苗移植于40cm×30cm的塑料盆中,每盆1株,待长至三叶一心时进行盐胁迫处理,每个处理重复3次。有关计算式如下:

(1)

(2)

(3)

(4)

(5)

(6)

(7)
受害等级划分如下:0级为正常生长;1级为少量叶片枯黄;2级为50%叶片枯黄;3级为80%叶片枯黄,50%茎干干枯;4级为完全死亡。
1.2 生理指标测定和数据处理
于盐胁迫处理15d后,剪取新鲜叶片分别测定叶片的相对电导率(RC)[3]、丙二醛(MDA)[4]、超氧化物歧化酶(SOD)[4]、过氧化物酶(POD)、过氧化氢酶(CAT)、脯氨酸(Pro)、可溶性糖(SS)[4]和可溶性蛋白(SP)含量。使用SPSS 18.0和Excel 2010软件对取得的数据进行差异性分析和绘图。
2 结果与分析
2.1 盐胁迫对种子萌发的影响
表1中,在对照浓度下,各种子发芽率和发芽势无显著性差异。在受到盐胁迫时,种子发芽率和发芽势显著降低,其中T1,T2发芽率极显著低于CK,T4,T5显著低于CK;T3,T6显著高于T5,极显著高于T1,T2和T4。T3,T6发芽势较对照差异不显著,但显著高于T4和T5,极显著高于T1和T2。上述结果表明:盐胁迫抑制了种子萌发和胚根生长。其中,T3胚根长度显著高于其他基因型,其耐盐指数也最高,表明其耐盐性较强,其余种子的耐盐能力从高到低依次为T6,T5,T4,T2,T1。

表1 不同基因地锦种子萌发情况
注:同列相邻和相间不同小写字母分别表示同一品种较对照CK差异显著(P<0.05)和极显著(P<0.01);同列相邻和相间不同大写字母分别表示不同品种差异显著(P<0.05)和极显著(P<0.01);下同。
2.2 盐胁迫对幼苗生长的影响
2.2.1 干物重和组织含水量
干物重和组织含水量分别反映植物体内有机物多寡和水分含量,两者对植物生长发育、叶表气孔开合、光合作用,乃至果实品质产生重要影响。由表2可知,各样品干物重和组织含水量较对照无显著差异。在盐胁迫下,不同品种地上部分和地下部分干重均较对照明显下降,但降幅不同。地上部分干重,T2,T4较对照分别降低21%和24%,达显著差异水平(P<0.05);T1,T5分别降低28%和25%,达极显著差异水平(P<0.01)。地下部分干重,T1,T5较对照均显著降低 (P<0.05),其他均较对照无显著差异。同时,不同幼苗的组织含水量也明显下降,其中T2,T3,T6较对照分别降低1.26%,2.09%和1.78%,差异不显著,而T1,T4,T5较对照分别下降5.03%,4.44%和4.54%,处于显著差异水平。这说明T1,T4,T5干物重和组织含水量受盐胁迫影响最大,其余受影响由大到小依次为T2,T6,T3。
2.2.2 幼苗存活率和盐害指数
在盐胁迫下,不同品种幼苗存活率均不同程度下降。其中,T2,T3的幼苗存活率分别为46.23%和51.74%,显著高于T6(P<0.05),极显著高于T1,T4和T5(P<0.01),而T1,T4,T5幼苗存活率分别仅为29.45%,26.67%和25.78%。结果显示幼苗存活率与盐害指数呈反比,幼苗存活率越低其盐害指数越高,盐害指数由高到低依次为T1,T5,T4,T6,T2,T3。
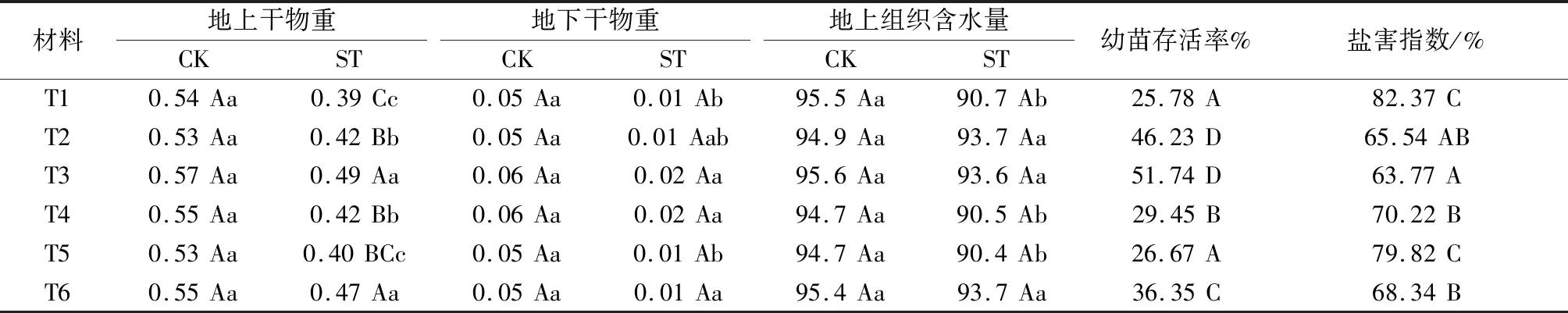
表2 不同基因地锦幼苗生长情况
2.3 盐胁迫对幼苗相对电导率(RC)和丙二醛(MDA)的影响
由图1a可知,在盐胁迫下与各样品的RC与对照相比分别增加813.95%,623.99%,502.99%,809.94%,744.95%和565.91%,均达到极显著差异水平(P<0.01)。同时,6种样品叶片的RC也存在明显差异,T3极显著低于T1,T2,T4和T5(P<0.01),显著低于T6(P<0.05),说明NaCl胁迫会改变植物细胞膜结构,引起相对电导率升高,膜透性增大,从而降低了自身的稳定性,但这种变化也因品种而有差异,各品种RC数值由高到低依次为T1,T4,T5,T2,T6,T3。
细胞膜脂过氧化生成MDA,继而与蛋白质、氨基酸生成不溶物,干扰细胞的正常生理活动,因此,MDA含量也可反映细胞膜透性变化情况。由图1b可知,在NaCl胁迫下,各样品的MDA较对照显著增大,T1~T6分别增加128.99%,100%,61.98%,118.95%,121.96%和85.96%,均达到极显著差异水平(P<0.01)。同时,6个品种叶片的MDA含量彼此也存在显著差异,T3的MDA含量显著低于T2(P<0.05),极显著低于T1,T4和T5(P<0.01),说明盐胁迫会极显著地提高植物叶片中MDA含量,导致细胞膜透性增大。在相同浓度盐胁迫下不同品种的MDA含量有明显差异,由高到低依次为T1,T5,T4,T2,T6,T3。

图1 盐胁迫对RC/MDA的影响
2.4 盐胁迫对叶片保护酶活性的影响
作为一种重要的抗氧化酶,SOD肩负着清除生物体新陈代谢生成的自由基,保护自身免受伤害的重任,其水平高低间接反映机体所受伤害程度。由图2a可见,在同浓度盐胁迫下,不同品种的SOD活性变化趋势不同,其中T1,T2,T4,T5均较对照明显降低,而T3,T6则显著高于对照(P<0.05)。同浓度盐胁迫下,T3和T6的SOD含量高于T1,T2,T4,T5,表明在盐胁迫下,爬山虎能通过调整自身的SOD活性水平,从而减轻盐胁迫的伤害。T3,T6的SOD活性水平最高,代表其对盐分的适应性更强,T1最低,代表其对盐分的耐受性最差。
POD和CAT则是生物体内清除自由基的另两种保护酶,其活性高低可以判断机体受活性氧自由基伤害的程度。由图2b和2c可见,较对照T1,T2,T4,T5均下降,T6升高,T3显著升高。同样胁迫下,POD和CAT活性水平由高到低依次为T3,T6,T5,T2,T4,T1。
上述结果说明,在盐胁迫下,不同品种叶片保护酶活性水平存在显著差异,其在保护酶活性方面由强到弱依次为T3,T6,T5,T2,T4,T1。
2.5 盐胁迫对叶片渗透调节物质的影响
脯氨酸可以调节细胞质渗透平衡,在有机体抗击渗透胁迫中起到保护作用。图3a中T1~T6脯氨酸含量较对照极显著升高 (P<0.01)。在相同浓度盐胁迫下T3叶片的脯氨酸含量显著高于T2(P<0.05),极显著高于T1和T4(P<0.01)。可溶性糖含量增加是植物抵抗盐胁迫的一种自我保护机制。图3c中T1~T6叶片的可溶性糖含量存在明显差异,较对照分别增加25.57%,54.93%,73.64%,26.15%,171.57%和70.44%,其中T2,T3,T5,T6达到显著差异水平(P<0.05)。在盐胁迫下,T3显著高于T2,T6(P<0.05),极显著高于T1,T4,T5 (P<0.01)。图3c中6种样品SP含量均较对照显著升高,盐胁迫下T3显著高于T2,T4,T5,极显著高于T1。这说明,盐胁迫会显著提高叶片的SP含量,不同爬山虎叶片的渗透调节物质含量存在显著差异,其中,T3爬山虎含量最高,其次为T6,而T4含量最低。

图2 盐胁迫对叶片保护酶活性的影响
3 讨论
3.1 对种子萌发和幼苗生长的影响
一般认为,盐分对植物的胁迫最初表现为种子萌发受到影响。这种影响往往会产生3种效应:完全抑制效应、增效效应和负效效应[5]。盐分通过渗透胁迫和离子毒害两种手段达到这种抑制,但不同植物作用机制不同,低浓度下以离子毒害为主,高浓度下以渗透胁迫为主。实验发现,NaCl胁迫下,各种子的萌发率显著下降,发芽时间明显延后。
生物量下降和个体矮小则是盐胁迫对植物生长发育影响的另外两种表现,其机理一是盐胁迫制造出低水势环境从而引发叶片水势降低,导致气孔导度下降;二是盐胁迫环境降低了光合作用的生产效率,减少物质和能量的产出;三是抑制特定酶和代谢进程。在盐胁迫下,植物地上部分和地下部分生物量都受到不同程度影响,这与STROGONOV[6]的研究结果一致。这可能与幼苗叶绿素受到破坏,削弱了光合作用,致使生物量下降有关。研究还发现,盐胁迫下,地锦幼苗组织含水量降幅越小,幼苗存活率越高,耐盐性越好,与樊秀彩[7]等人研究结果一致,即耐盐性与幼苗组织含水量降幅呈负相关。

图3 盐胁迫对叶片渗透调节物质的影响
3.2 对幼苗生理生化指标的影响
渗透调节是植物抵抗盐胁迫的基本手段之一。盐胁迫下,植物体内的活性氧含量大幅提高,引起MDA随之升高,细胞膜脂出现过氧化和脱脂化,细胞结构被破坏。本研究发现,盐胁迫下叶片细胞膜透性和MDA含量较对照显著增加,表明细胞膜受损害程度加重,这可能是盐胁迫破坏了植物体内活性氧生成与清除的动态平衡所致。不同品种损害程度不同,其中,T1最重,依次为T4,T5,T2,T6和T3。
SOD,POD,CAT是生物体内重要的抗氧化酶,三者协同作用共同抵御自由基的侵害。植物在逆境环境中,会诱发3种保护酶活性升高,从而增强自身机体对胁迫的抵抗能力[8],这与本实验结果有一定出入,可能是盐胁迫浓度已超过T1,T2,T4和T5最大胁迫浓度,保护酶活性已开始逐渐降低,而T3和T6还未达到其最大值。试验样品中保护酶活性高低也与品种有关,T3显著高于其他品种,依次是T6,T5,T2,T4和T1。植物通过有机和无机渗透调节自身水势从而维持正常生理代谢,通过合成脯氨酸等小分子有机物有助降低细胞水势,进而达到提高自身吸水能力的目的。文献发现抗渗透胁迫能力与体内脯氨酸含量存在显著的正相关关系,即耐盐能力越强,对应的脯氨酸含量越高,本实验发现在盐胁迫下各样品脯氨酸均显著升高,但不同品种间也有显著差异,T3最高,依次为T6,T2,T4,T5和T1。
植物耐盐性机理十分复杂,通常认为耐盐性的大小由其遗传性决定。因此,对植物进行耐盐性评价时,应选择同一植物的不同品种从多种指标多角度进行综合分析。本实验从种子萌发、幼苗生长发育、叶片相对电导率、叶片保护酶活性、渗透调节物质等指标研究出发,发现盐胁迫不同品种的影响存在明显差异,其中三叶地锦等在盐胁迫下种子发芽、幼苗渗透调节和抗氧化酶生成能力较强,耐盐能力强。异叶地锦受盐胁迫影响较大,为盐敏感型,绿叶地锦等表现介于两者之间,为中等耐盐性型,实验结果对耐盐性品种的筛选具有一定的参考意义。
