肌球蛋白-琼脂混合凝胶的特性
2019-11-16李珊珊杨玉玲周磊魏苏萌
李珊珊 杨玉玲 周磊 魏苏萌

摘 要:比较肌球蛋白、琼脂、肌球蛋白-琼脂3 种凝胶样品的质构特性、流变特性和超微结构,并研究不同pH值(pH 5、6、7)和不同离子强度(0.2、0.4、0.6)条件下肌球蛋白-琼脂混合凝胶的特性变化。结果表明:肌球蛋白-琼脂混合凝胶的硬度和弹性明显大于纯肌球蛋白凝胶或纯琼脂凝胶(P<0.05),且均在pH 6时获得最大值;肌球蛋白-琼脂混合凝胶的硬度和弹性随离子强度的增加而增加,在离子强度为0.6时出现最大值;在肌球蛋白溶液中加入琼脂,无论在加热过程还是降温过程中,混合凝胶的储能模量(G)和损耗模量(G)均显著高于相同温度条件下的纯肌球蛋白凝胶或纯琼脂凝胶(P<0.05);在冷却过程中,琼脂对G和G的贡献超过肌球蛋白;用扫描电子显微镜观察肌球蛋白-琼脂混合凝胶(肌球蛋白、琼脂质量浓度分别为10、4 mg/mL)的超微结构时发现,混合凝胶为相分离型凝胶,琼脂为连续相,肌球蛋白为分散相。
关键词:琼脂;肌球蛋白;凝胶;质构;流变性;微观结构
Abstract: In this study, the texture characteristics, rheological properties and microstructure of myosin, agar and their blends were compared. The characteristics of mixed gels were studied under different pH value (5, 6, 7) and ionic strength (0.2, 0.4, 0.6) conditions. The results showed that the gel hardness and springiness of myosin-agar blend were greater than those of pure myosin or agar (P < 0.05). The hardness and springiness of mixed gels reached the maximum at pH 6. In addition, they increased with the increase of ionic strength reaching the maximum when the ionic strength was 0.6. The G and G values of mixed samples were significantly higher than those of pure myosin or agar at the same temperature during both heating and cooling (P < 0.05). In the cooling process, agar contributed more to G and G than myosin. Scanning electron microscopy was used to observe the ultrastructure of the mixed gel of 10 mg/mL myosin and 4 mg/mL agar. It was found that the mixed gel was a phase separated gel; agar was in the continuous phase while myosin was in the dispersed phase.
Keywords: agar; myosin; gel; texture; rheology; microstructure
DOI:10.7506/rlyj1001-8123-20190617-135
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2019)09-0008-05
引文格式:
李珊珊, 杨玉玲, 周磊, 等. 肌球蛋白-琼脂混合凝胶的特性[J]. 肉类研究, 2019, 33(9): 8-12. DOI:10.7506/rlyj1001-8123-20190617-135. http://www.rlyj.net.cn
LI Shanshan, YANG Yuling, ZHOU Lei, et al. Gel properties of myosin and agar blends[J]. Meat Research, 2019, 33(9): 8-12. DOI:10.7506/rlyj1001-8123-20190617-135. http://www.rlyj.net.cn
火腿肠、香肠等糜类和重组肉类的品质主要依赖于肌原纤维蛋白的凝胶性和乳化性。肌原纤维蛋白是肌肉组织基本单位肌原纤维的主要成分,包括肌球蛋白、肌动蛋白、肌动球蛋白、原肌球蛋白和肌钙蛋白等[1]。其中肌球蛋白是起凝胶作用的最主要蛋白质,占肌肉组织总蛋白的30%左右。很多学者对肌球蛋白的分子结构及功能特性等进行研究。Gao Ruichang等[2]发现,L-精氨酸和L-组氨酸均能够提高肌球蛋白溶液的pH值,在加热过程中其疏水作用力增加。徐幸莲等[3]研究发现,随着蛋白质含量、离子强度的增加,兔骨骼肌肌球蛋白凝胶的保水性和硬度也随之增加,并且在pH值为6时,兔腰大肌肌球蛋白凝胶的硬度和保水性最大。
Wang Xixi等[4]将玉米抗性淀粉添加至鸡胸肉肌球蛋白中制备凝胶,发现混合凝胶的保水性和质构特性随着玉米抗性淀粉含量的增加逐渐增加。Cao Hongwei等[5]研究微波辐射引发的肌球蛋白构象改变过程中聚集行为的变化,二硫键、表面疏水作用在微波辐射加热过程中均发生显著变化,温度在60~90 ℃范围内变化时,其二级结构α-螺旋含量减小。琼脂、黄原胶、卡拉胶和明胶等食品胶是肉糜类制品的主要添加剂,能提高肉糜类制品的品质。杨玉玲[6]、董秋颖[7]等研究添加卡拉胶和明胶对肌球蛋白凝胶特性的影响,结果表明,混合凝胶的质构特性显著提高;Chen Xing等[8]发现,经超高压(0~400 MPa)预处理后,热诱导形成的鸡胸肉肌球蛋白与κ-卡拉胶混合凝胶的保水性增加,凝胶强度却减小。但目前关于肌球蛋白与琼脂混合凝胶特性的研究报道较少。
琼脂是目前世界上用途最广泛的三大海藻胶之一,被广泛应用于酸乳、果冻、糕点、罐头、午餐肉、香肠及羹类食品等各类食品加工中[9-10]。琼脂不仅在食品工业中可以作为胶凝剂、增稠剂、乳化剂、保鲜剂和稳定剂使用,其本身在人体中也具有生理功能[11-12]。琼脂中含有人体必需的碘、钙、铁、钠、镁等元素,有助于人体微量元素的摄入;琼脂与膳食纤维一样,可以促进肠道蠕动,具有润肠功效[13];琼脂还具有开胃健脾、促进人体新陈代谢、辅助治疗高血压和肝炎等作用[14-15]。
尽管琼脂在肉制品中被广泛应用,但这种应用主要基于经验进行,缺乏深入的理论研究[16-18],因此本研究对肌球蛋白-琼脂混合凝胶的质构特性、流变性和微观结构进行研究,以期为工业化生产应用提供参考。
1 材料与方法
1.1 材料与试剂
40 日龄的活AA鸡30 只,购于南京青龙养鸡场,就地屠宰后取鸡胸肉,加冰运输,贮存于-18 ℃条件下并在1 个月内使用。琼脂(生化试剂) 国药集团化学试剂(上海)有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
Allegra 64R高速冷冻离心机 美国Beckman Coulter有限公司;SIM-F124三洋制冰机 日本三洋公司;DS-1高速组织捣碎机 上海标本模型厂;TA.XT. Plus质构仪 英国Stable Micro System公司;AR1000流变仪 英国TA Instruments公司;TM3000扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 鸡胸肉中肌球蛋白的提取
取健康肉鸡(1.5~2.0 kg),宰前充分休息过夜以减少应激,宰杀后迅速剥皮取胸肉,冲去血污,剔除结缔组织和脂肪。鸡胸肉中肌球蛋白的提取参照Nauss[19]、Hermansson[20]等的方法,并略作修改,提取后的肌球蛋白周围加冰后保存在冰箱中,使其温度保持在-1~0 ℃,3 d内用完。蛋白质质量浓度的测定采用双缩脲试剂法,以牛血清蛋白作为标准蛋白。
1.3.2 肌球蛋白、琼脂及二者混合溶液的配制
按照表1设计的单因素试验及水平,用缓冲液(pH 6.0,含0.6 mol/L KCl、10 mmol/L Na2HPO4)配制肌球蛋白、琼脂及二者混合样品溶液。
1.3.3 凝胶的制备
取1.3.2节配制的各系列样品溶液2 mL,置于5 mL塑料离心管中,水浴加热,从30 ℃升温到90 ℃,加热速率1 ℃/min,保温5 min,冷卻至室温,放入4 ℃冰箱过夜,备用。
1.3.4 凝胶质构特性测定
使用质构仪测定凝胶的硬度和弹性。取高度2 cm左右的圆柱体凝胶样品用于质构测定,测定条件:选用P/5探头,温度25 ℃,测前速率5 mm/s,测试速率1 mm/s,测后速率5 mm/s,探头深入距离10 mm,触发力5 g。每个处理样品重复测定3 次。
1.3.5 凝胶流变学测定
参照王培森[21]的方法,使用流变仪测定储能模量(G)、损耗模量(G)。流变仪设定条件:平行板直径40 mm,狭缝0.5 mm,应变2%,频率0.1 Hz。测定分为升温和降温2 个过程,升温速率1 ℃/min,升温范围25~90 ℃;降温速率2 ℃/min,降温范围90~20 ℃。
1.3.6 凝胶微观结构观察
将制备的凝胶切成2 mm左右见方的立方体,用体积分数为2.5%的戊二醛固定24 h后,使用乙醇(体积分数50%、70%、90%、100%)进行梯度脱水。将凝胶颗粒在-70 ℃条件下冷冻干燥72 h,而后使用扫描电子显微镜在加速电压15 kV、放大倍数1 500条件下观察其微观结构。
1.4 数据处理
采用SPSS 17.0软件对数据进行方差及显著性分析;采用Origin 8.0软件进行数据分析和绘图。
2 结果与分析
2.1 肌球蛋白-琼脂混合凝胶的质构特性
2.1.1 肌球蛋白、琼脂质量浓度对混合凝胶质构特性的影响
凝胶硬度和弹性是衡量肉制品口感的重要指标之一。凝胶硬度是指质构仪的探头在第1次下压凝胶时,压力的最大值。凝胶弹性是指凝胶本身在探头第1次下压过程中变形后的回弹程度[22]。
由表2可知:当混合凝胶中肌球蛋白质量浓度为10 mg/mL、琼脂质量浓度为4 mg/mL时,其硬度和弹性均显著大于纯肌球蛋白或纯琼脂凝胶(P<0.05);对比纯肌球蛋白和纯琼脂凝胶的质构特性,质量浓度4 mg/mL琼脂凝胶的硬度显著大于质量浓度10 mg/mL的肌球蛋白凝胶(P<0.05),而二者的弹性没有显著差异(P>0.05)。叶丽红等[23]的研究表明,添加κ-卡拉胶可以明显提高鱼丸的硬度和弹性,这与琼脂对肌球蛋白-琼脂混合凝胶的作用相一致。
2.1.2 pH值对混合凝胶质构特性的影响
由表3可知:pH值对肌球蛋白-琼脂混合凝胶的硬度具有显著影响,当pH值为6时,硬度达到最大值7.70 g;pH值为5和6时,肌球蛋白-琼脂混合凝胶的弹性没有显著差异(P>0.05),但当pH值增加到7时,弹性显著降低(P<0.05)。徐幸莲等[3]在研究兔骨骼肌肌球蛋白凝胶特性时发现,在pH值为6时,肌球蛋白凝胶的硬度达到最大值。马云等[24]发现,pH值为6时琼脂凝胶的硬度和弹性达到最大值,并认为pH值通过改变琼脂分子之间的氢键作用力进而影响琼脂凝胶的质构特性。这些研究与本研究所得的结论一致,对于肌球蛋白-琼脂混合凝胶,pH值通过影响琼脂及肌球蛋白凝胶的形成,进而影响混合凝胶的质构特性。
2.1.3 离子强度对混合凝胶质构特性的影响
一般情况下,肌球蛋白凝胶强度随离子强度的增加而降低[25]。马云等[24]认为,添加盐类也可以使琼脂的凝胶强度增加。由表4可知,肌球蛋白-琼脂混合凝胶的硬度随离子强度的增加而增加,离子强度0.4和0.6时的弹性大于离子强度0.2时的弹性。当离子强度为0.6时,可以提供肌球蛋白-琼脂混合凝胶适宜的质构特性,这与彭晓蓓等[26]研究离子强度对肌原纤维蛋白-脂肪替代物混合凝胶的影响时得到的结论一致,即随着离子强度从0.2增加至0.6,混合凝胶的G也逐渐增加,混合凝胶的特性得到改善。
2.2 肌球蛋白-琼脂混合凝胶的流变性
2.2.1 升温过程
由图1~2可知:琼脂凝胶的G和G在升温过程中几乎无变化,G均为(0.0±0.3) Pa,而G为(0.0±0.2) Pa,与其他2 个样品相比可以忽略;在50 ℃前,肌球蛋白凝胶和肌球蛋白-琼脂混合凝胶的G和G变化并不明显,但在60 ℃后,二者的G和G随着温度升高而增大,说明由于肌球蛋白变性,凝胶的黏弹性增大;在60~90 ℃之间的相同温度条件下,肌球蛋白-琼脂混合凝胶的G和G明显大于肌球蛋白。这说明琼脂在加热过程中并没有形成凝胶,但琼脂和肌球蛋白之间存在着一定的作用,添加琼脂导致混合样品的黏弹性急剧增大。董秋颖等[7]在研究肌原纤维蛋白-明胶混合凝胶时也发现,添加明胶可以显著提高混合凝胶的G,而肌球蛋白是肌原纤维蛋白中最重要的成胶物质。
Sano[27]、Visesanguan[28]等在研究不同动物肌球蛋白时均发现,加热过程中G的变化趋势为:在42~50 ℃增加,50~55 ℃突然降低,55 ℃以后又逐渐上升,这种趋势与本研究结果不一致的原因可能是添加琼脂引起的,也可能是由于所选的实验材料和实验条件不同引起的。
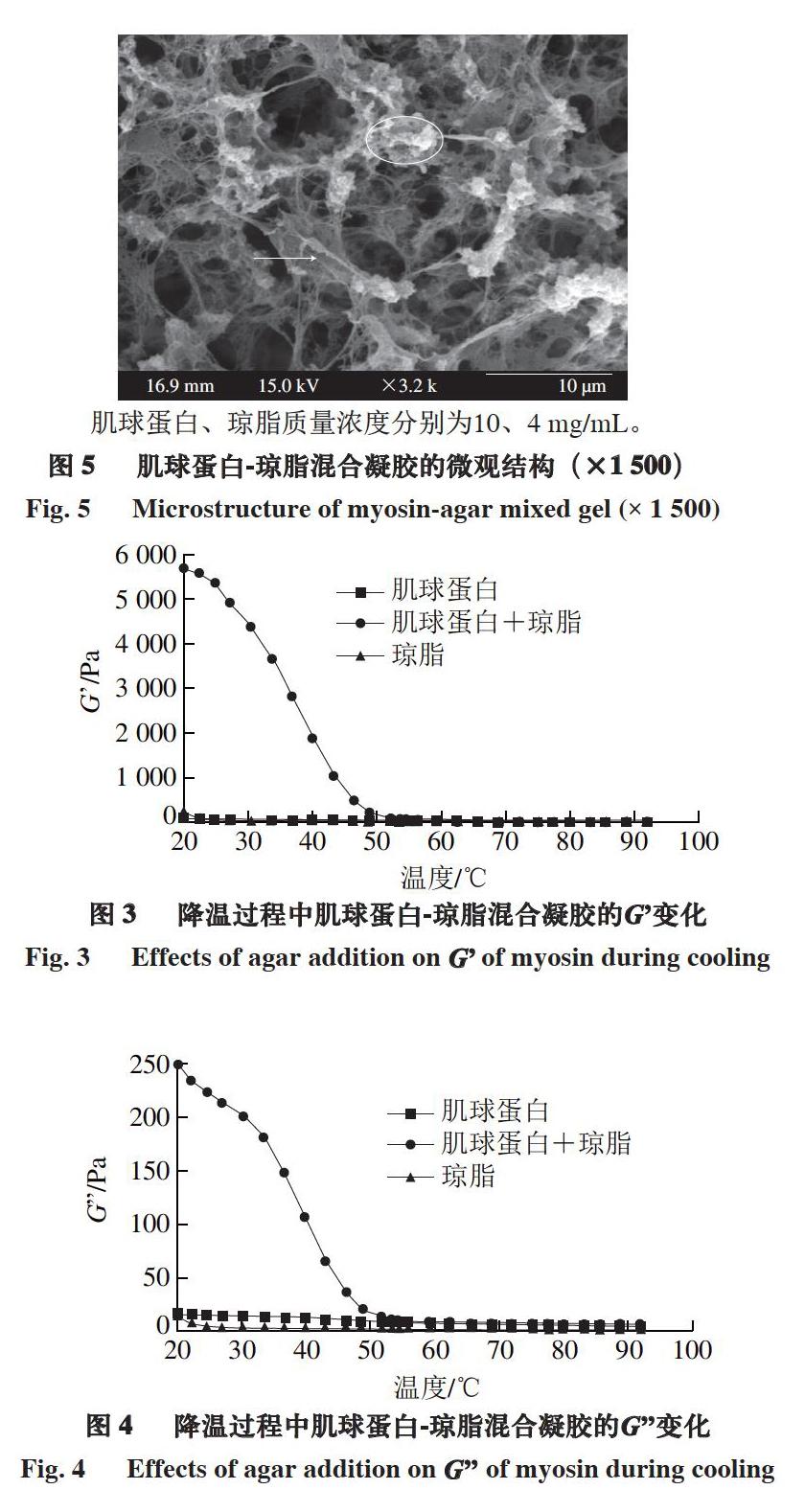
2.2.2 降温过程
由图3~4可知:在降温过程中,琼脂凝胶的G和G在从90 ℃降温至30 ℃期间几乎没有变化,但在30 ℃以下迅速升高,其变化趋势与Norziah等[29]报道的趋势一致;肌球蛋白凝胶的G和G在降温过程中增加,没有出现明显的拐点;肌球蛋白-琼脂混合凝胶的G和G在温度降至54 ℃之前变化不大,而后急剧增大,说明琼脂在冷却成胶时对G和G的贡献远超过加热过程中肌球蛋白的贡献。从中还可以推断混合凝胶的形成过程为:在加热过程中肌球蛋白首先形成热诱导凝胶,琼脂的添加强化了肌球蛋白凝胶的成胶能力;而后在冷却过程中,凝胶化的肌球蛋白极大地提高了琼脂的成胶能力,在二者协同作用下,形成了高黏弹性的混合凝胶。
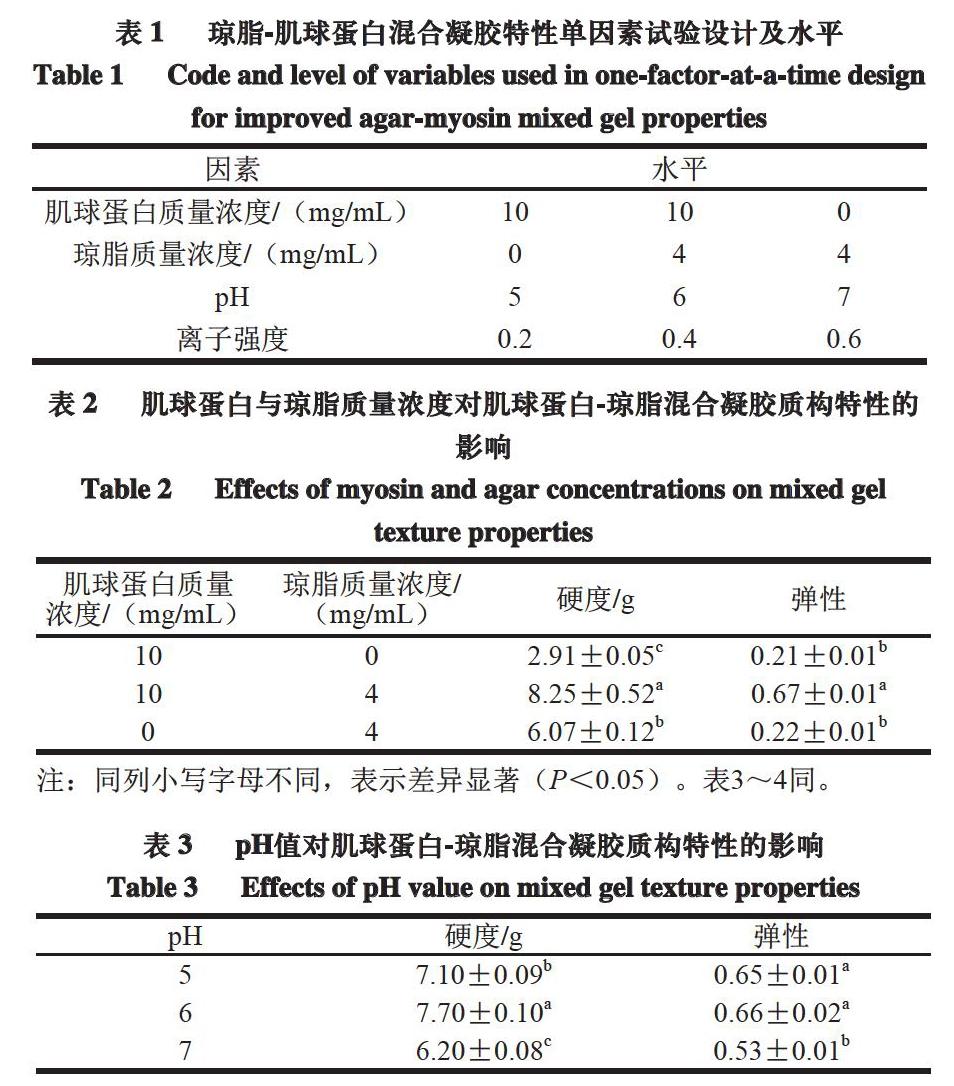
2.3 肌球蛋白-瓊脂混合凝胶的超微结构
由图5可知:肌球蛋白和琼脂形成相分离型凝胶,其中肌球蛋白颗粒形成的凝胶骨架比较粗糙,为大的网状结构,并且在凝胶中以分散相存在(如图中圆圈所示);而由琼脂形成的凝胶网络比较平坦,并构成了混合凝胶的连续相(如图中箭头所示)。已有研究表明,在κ-卡拉胶与肌球蛋白的混合凝胶体系中,肌球蛋白为凝胶网络结构的主体[30-31]。这与本研究结果不同,其原因可能是相同浓度下,卡拉胶的成胶能力比琼脂弱,同时与和肌球蛋白的混合比例有关。Norziah等[29]在研究琼脂和卡拉胶混合凝胶时认为,二者形成相分离型凝胶。
3 结 论
肌球蛋白-琼脂混合凝胶的硬度和弹性明显大于纯肌球蛋白凝胶或纯琼脂凝胶;肌球蛋白-琼脂混合凝胶的硬度和弹性在pH 6和离子强度为0.6时出现最大值。在肌球蛋白溶液中加入琼脂,无论加热过程还是降温过程均能使样品的G和G显著增大。肌球蛋白-琼脂混合凝胶的形成过程为:在加热过程中,肌球蛋白首先形成热诱导凝胶,琼脂的添加强化了肌球蛋白形成热诱导凝胶的能力;随后在冷却过程中,肌球蛋白的存在极大提高了琼脂的冷诱导成胶能力,在二者协同作用下,形成高黏弹性的混合凝胶。肌球蛋白和琼脂形成相分离型凝胶,琼脂为连续相,肌球蛋白为分散相。
参考文献:
[1] 周光宏. 肉品加工学[M]. 北京: 中国农业出版社, 2009: 31-33.
[2] GAO Ruichang, SHI Tong, SUN Quancai, et al. Effects of L-arginine and L-histidine on heat-induced aggregation of fish myosin: bighead carp (Aristichthys nobilis)[J]. Food Chemistry, 2019, 295: 320-326. DOI:10.1016/j.foodchem.2019.05.095.
[3] 徐幸莲, 周光宏, 黄鸿兵, 等. 蛋白质浓度、pH值、离子强度对兔骨骼肌肌球蛋白热凝胶特性的影响[J]. 江苏农业学报, 2004(3):159-163. DOI:10.3969/j.issn.1000-4440.2004.03.007.
[4] WANG Xixi, LI Yueshuang, ZHOU Ying, et al. Effect of resistant corn starch on the thermal gelling properties of chicken breast myosin[J]. Food Hydrocolloids, 2019, 96: 681-687. DOI:10.1016/j.foodhyd.2019.06.013.
[5] CAO Hongwei, JIAO Xidong, FAN Daming, et al. Microwave irradiation promotes aggregation behavior of myosin through conformation changes[J]. Food Hydrocolloids, 2019, 96: 11-19. DOI:10.1016/j.foodhyd.2019.05.002.
[6] 杨玉玲, 周光宏, 姜攀, 等. 卡拉胶凝胶质构特性的研究[J].食品工业科技, 2008(10): 220-223. DOI:10.13386/j.issn1002-0306.2008.10.054.
[7] 董秋颖, 杨玉玲, 董哲, 等. 明胶和肌原纤维蛋白混合凝胶特性的研究[J]. 食品与发酵工业, 2010, 36(2): 71-75. DOI:10.13995/j.cnki.11-1802/ts.2010.02.014.
[8] CHEN Xing, CHEN Conggui, ZHOU Yanzi, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40: 262-272. DOI:10.1016/j.foodhyd.2014.03.018.
[9] 田芬, 歐凯, 高兴华, 等. 琼脂的流变特性对饮用型酸奶稳定性的影响[J]. 食品工业科技, 2016, 37(6): 160-163; 169. DOI:10.13386/j.issn1002-0306.2016.06.024.
[10] 胡国华. 功能性食品胶[M]. 北京: 化学工业出版社, 2004: 286-293.
[11] 李琴梅, 戚勃. 琼脂的物化特性及其在食品工业中的应用[J].中国食品添加剂, 2009(6): 170-174. DOI:10.3969/j.issn.1006-2513.2009.06.033.
[12] 宋雪健, 王洪江, 张东杰. 琼脂在食品中的应用研究进展[J]. 现代农业科技, 2017(12): 267-268; 272.
[13] 《明胶科学与技术》编辑部信息组. 琼脂[J]. 明胶科学与技术, 2005(3): 123-130.
[14] RAM?REZ J A, URESTI R M, VELAZQUEZ G, et al. Food hydrocolloids as additives to improve the mechanical and functional properties of fish products: a review[J]. Food Hydrocolloids, 2011, 25(8): 1842-1852. DOI:10.1016/j.foodhyd.2011.05.009.
[15] 米红波, 苏情, 王聪, 等. 亲水胶体在鱼糜制品中的应用研究进展[J]. 食品工业科技, 2018, 39(19): 334-338. DOI:10.13386/j.issn1002-0306.2018.19.057.
[16] JIAN Wenjie, WU Huayi, WU Lanlan, et al. Effect of molecular characteristics of konjac glucomannan on gelling and rheological properties of tilapia myofibrillar protein[J]. Carbohydrate Polymers, 2016, 150: 21-31. DOI:10.1016/j.carbpol.2016.05.001.
[17] 兰冬梅. 食品胶-鱼肉蛋白复合热凝胶体系的形成及机理研究[D]. 湛江: 广东海洋大学, 2016: 13-20.
[18] 谢婷婷, 姚静, 李月双, 等. MgCl2对低钠盐κ-卡拉胶-肌球蛋白凝胶特性的影响[J]. 食品科学, 2017, 38(1): 35-40. DOI:10.7506/spkx1002-6630-201701006.
[19] NAUSS K M, KITAGAWA S, GERGELY J. Pyrophosphate binding to and adenosine triphosphatase activity of myosin and its proteolytic fragments: implications for the substructure of myosin[J]. Journal of Biological Chemistry, 1969, 244(4): 755-765.
[20] HERMANSSON A M, HARBITS O, LANGTON M. Formation of two types of gels from bovine myosin[J]. Journal of the Science of Food and Agriculture, 1986, 37: 69-84. DOI:10.1002/jsfa.2740370111.
[21] 王培森. 肌球蛋白-亲水性胶体混合体系凝胶特性的研究[D]. 福州: 福建农林大学, 2017: 12-14.
[22] 李明清, 孔保华, 王宇. 菊粉对鲤鱼肌原纤维蛋白凝胶特性的影响[J]. 食品工业科技, 2010, 31(10): 105-108. DOI:10.13386/j.issn1002-0306.2010.10.033.
[23] 叶丽红, 许艳顺, 夏文水, 等. κ-卡拉胶、复合磷酸盐和蛋清粉对高水分鱼丸水分和质构特性的影响[J]. 食品科技, 2019, 44(4):291-297. DOI:10.13684/j.cnki.spkj.2019.04.052.
[24] 马云, 杨玉玲, 杨震, 等. 琼脂凝胶质构特性的研究[J]. 食品与发酵工业, 2007(9): 24-27. DOI:10.13995/j.cnki.11-1802/ts.2007.09.016.
[25] 徐幸蓮. 兔骨骼肌肌球蛋白热凝胶特性及成胶机制的研究[D]. 南京: 南京农业大学, 2003: 65-73.
[26] 彭晓蓓, 游远, 杨玉玲, 等. 肌原纤维蛋白与脂肪替代品混合样品流变特性研究[J]. 肉类研究, 2012, 26(6): 9-13.
[27] SANO T, NOGUCHI S F, TSUCHIYA T, et al. Dynamic viscoelastic behavior of natural actomyosin and myosin during thermal gelation[J]. Journal of Food Science, 1988, 53(3): 924-928. DOI:10.1111/j.1365-2621.1988.tb08987.x.
[28] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1016-1023. DOI:10.1021/jf9900332.
[29] NORZIAH M H, FOO S L, KARIM A A. Rheological studies on mixtures of agar (Gracilaria changii) and κ-carrageenan[J]. Food Hydrocolloids, 2006, 20(2/3): 204-217. DOI:10.1016/j.foodhyd.2005.03.020.
[30] VERBEKEN D, NEIRINCK N, VAN DER MEEREN P, et al. Influence of κ-carrageenan on the thermal gelation of salt-soluble meat proteins[J]. Meat Science, 2005, 70(1): 161-166. DOI:10.1016/j.meatsci.2004.12.007.
[31] 潘腾, 宋君红, 吴建平, 等. 钾离子对肌球蛋白-κ-卡拉胶凝胶特性的影响[J]. 中国食品学报, 2017, 17(11): 44-52. DOI:10.16429/j.1009-7848.2017.11.006.
