34例非阑尾来源腹膜假黏液瘤诊治分析
2019-11-16史冠军夏奥马瑞卿王冰翟喜超安鲁彪许洪斌
史冠军 夏奥 马瑞卿 王冰 翟喜超 安鲁彪 许洪斌
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是具有分泌黏液蛋白功能的肿瘤细胞在腹腔内广泛种植并产生大量胶冻样黏液腹水所引起的临床症候群,临床主要表现为腹围增大、腹胀、纳差、消化道梗阻等。PMP临床罕见,每年发病率约(1~3)/100万[1],最常起源于阑尾,而非阑尾来源PMP仅占6%~12.8%,后者国内外文献均罕有报道[2]。在疾病早期,PMP患者多无特异性临床表现或体征,术前诊断困难。目前国际公认的PMP首选治疗方案为细胞减灭术(cytoreduction surgery,CRS)和腹腔热灌注化疗(hyperthermic intraperitoneal che⁃motherapy,HIPEC)[3-4]。既往已有大样本量的阑尾来源PMP回顾性研究报道,结果证实了CRS+HIPEC在治疗阑尾来源PMP中的疗效。而对于非阑尾来源PMP相关文献较少,CRS+HIPEC在该部分患者中的临床应用价值尚不明确。为进一步探讨非阑尾来源PMP的临床病理特征及诊断、治疗、预后,本研究对非阑尾来源PMP患者的临床资料进行回顾性分析,总结其临床特征并对CRS+HIPEC在该部分患者中的治疗安全性及疗效进行评价。
1 材料与方法
1.1 病例资料
从2011年10月至2019年2月于航天中心医院接受手术治疗的PMP患者数据库中筛选出经病理证实为非阑尾来源PMP的患者34例。统计资料包括临床病理特征、治疗数据及术后随访信息等。其中PMP的病理分类目前参照2016年国际腹膜表面肿瘤协作小组(PSOGI)基于柏林腹膜肿瘤世界大会所讨论得出的专家共识[5],将PMP 分为无细胞性黏液、腹膜低级别黏液癌、腹膜高级别黏液癌和腹膜高级别黏液癌伴印戒细胞四类,但该共识并未对非阑尾来源PMP 进行详细的描述及介绍。世界卫生组织(WHO)2010年版的PMP 分类标准指出非阑尾来源PMP病理分级与阑尾来源PMP判断标准一致[6]。
1.2 方法
1.2.1 术前检查 所有患者入院后均需完善血、尿、便常规,肝、肾功能,肿瘤标志物(CEA、CA125、CA199)等检测。完善腹盆腔增强CT及胃、肠镜等影像学检查,CT检查时需同时口服胃肠显影剂。
1.2.2 手术及辅助治疗 本组所有患者均行手术治疗,开腹探查后,首先评估腹膜癌指数(peritoneal cancer index,PCI),然后根据探查情况行CRS手术,术中尽可能清除所有肿瘤组织。CRS 包括脏器切除和腹膜切除,必须切除部分:双侧腹壁腹膜、盆腔腹膜、大网膜、小网膜、双侧卵巢(女性)及阑尾。双侧膈肌腹膜视受累情况选择性切除。酌情切除受累的组织器官,如右半结肠、脾脏、子宫、乙状结肠及部分直肠、胆囊等。CRS完成后行封闭式HIPEC,常用药物为顺铂、丝裂霉素、5-氟尿嘧啶等,溶剂为0.9%氯化钠注射液。灌注速度控制在600~800 mL/min,温度控制在(43±0.5)℃,持续时间60~90 min。应用顺铂灌注前给予充分补液水化,必要时给予利尿剂,保证尿量>100 mL/h。灌注结束后重新进腹,吸净残余灌注液,彻底止血并冲洗腹腔,重建消化道或肠造瘘。最后评估细胞减灭程度(completeness of cancer cytoreduction,CC),评分标准:CC-0:无肉眼可见残余肿瘤;CC-1:残留肿瘤直径<2.5 mm;CC-2:2.5 mm≤残余肿瘤直径≤2.5 cm;CC-3:残余肿瘤直径>2.5 cm,其中CC-0~1被定义为完全性CRS。术后根据患者情况辅助行1~6次腹腔热灌注化疗。所有患者术前及术后均不常规采用静脉化疗[7]。
1.2.3 随访 患者术后每6个月复查腹盆腔增强CT及肿瘤标记物(CEA、CA199、CA125)。定期通过电话进行随访,主要内容包括一般情况和生存状态。随访起点为出院日期,终点为死亡日期或最后随访时间。随访时间截止至2019年5月1日。
1.3 统计学分析
采用Excel 2016、SPSS 25.0 软件进行统计学分析。计量资料采t检验或秩和检验;计数资料采用χ²检验。Kaplan-Meier方法计算总生存,生存比较采用Log rank检验。P<0.05为差异具有统计学意义。
2 结果
2.1 主要临床病理特征
34 例患者中,男性16 例,女性18 例,平均年龄51.7(14~77)岁。首次就诊表现为:腹胀19 例,腹部包块6例,体检发现肿瘤标志物增高、腹水、腹部占位4 例,便血2 例,消瘦、乏力2 例,术中意外发现1 例。腹部体征:腹部膨隆20例,可触及腹部肿物18例,腹水征阳性20例,伴腹股沟疝2例。实验室检查:血肿瘤标志物正常3 例,CEA 增高19 例,CA125 增高27例,CA199 增高21 例。所有患者影像学检查均提示腹腔内囊实性占位、不同程度腹膜增厚或腹腔积液。10例行PET-CT检查均未发现肝、肺等远处脏器转移;7 例行腹水脱落细胞学检查,仅1 例查见癌细胞;5 例行腹腔肿物穿刺活检,病理提示考虑恶性肿瘤,但无法判断肿瘤来源(表1)。
2.2 手术相关参数
34 例患者全部接受手术治疗,其中26 例接受HIPEC 治疗。所有患者均接受阑尾切除并且病理证实为阴性。平均手术时间497.5(160~740)min,中位PCI 26(6~39)分,PCI>20 分27 例(79.4%);减瘤程度达到CC-0~1 为11 例(32.4%);联合脏器切除≤2个21 例(61.8%),脏器切除>2 个13 例(38.2%);行结肠或回肠造瘘6 例(17.6%);3~4 级并发症发生5 例(14.7%)(Clavien-Dindo classification 分级法),其中肠瘘3 例,腹腔出血1 例,消化道出血1 例,所有患者均在进一步积极治疗后恢复正常生活状态。围手术期死亡3例,其中2例与手术并发症有关,1例为意外事件死亡。平均住院时间32.5(20~81)天,术后平均住院时间23.6(11~68)天。
2.3 生存情况分析
中位随访时间12(1~46)个月。随访期间因肿瘤复发并再次接受手术4例,死亡9例,主要死亡原因为肠梗阻、肠瘘等。本组1、3年生存率分别为69.6%、53.5%(图1)。生存单因素分析显示影响预后的主要危险因素为:PCI(P=0.014),CC(P=0.006),术中灌注化疗(P=0.016),术后灌注化疗(P=0.007)。组织级别(P=0.192),病理来源(P=0.691)未体现出显著相关性,考虑与样本量较少有关。性别、年龄、肿瘤标志物、既往是否手术及化疗、是否有淋巴结或脉管转移无显著性差异(表2)。
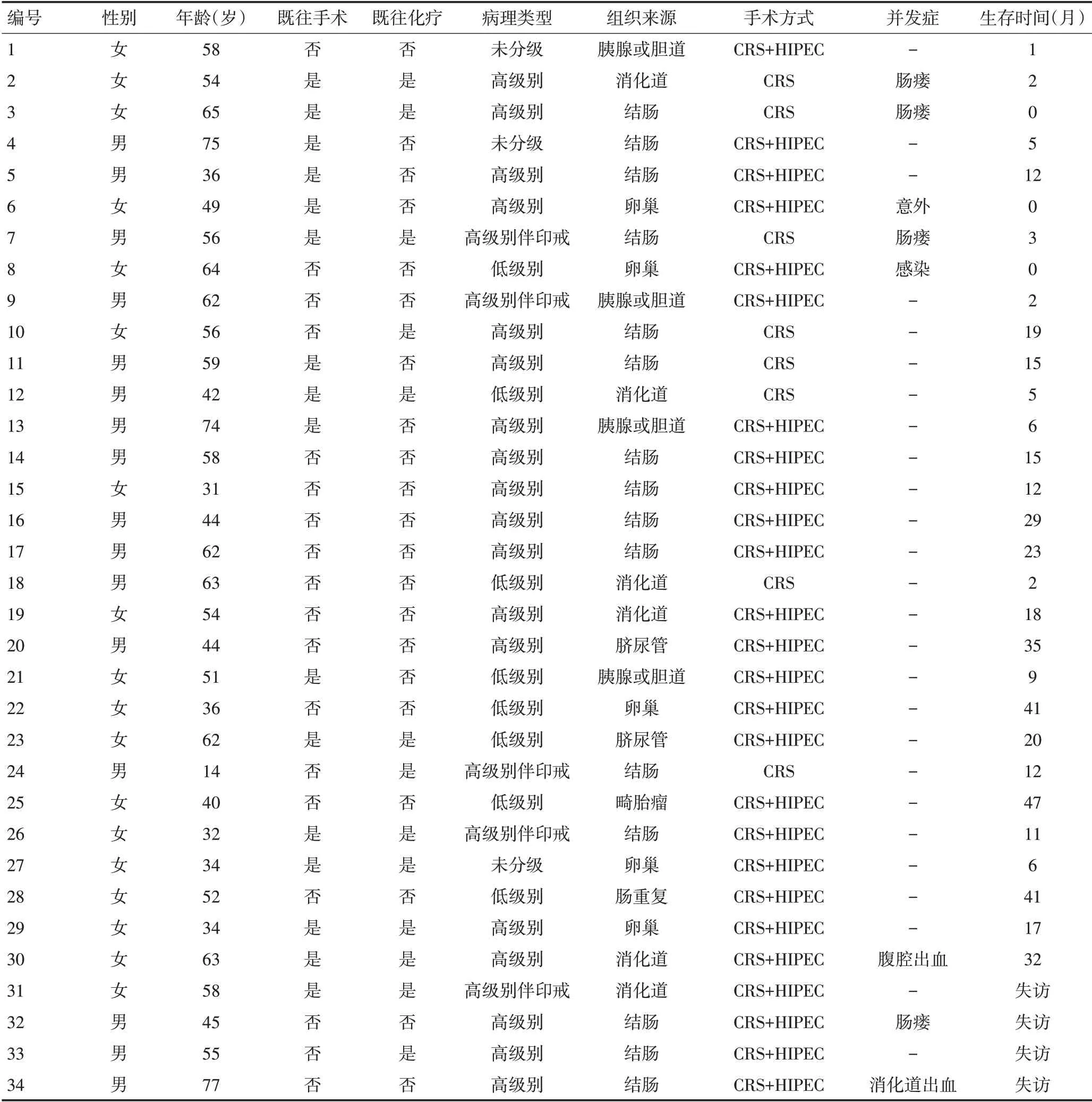
表1 34例患者一般临床病理特征
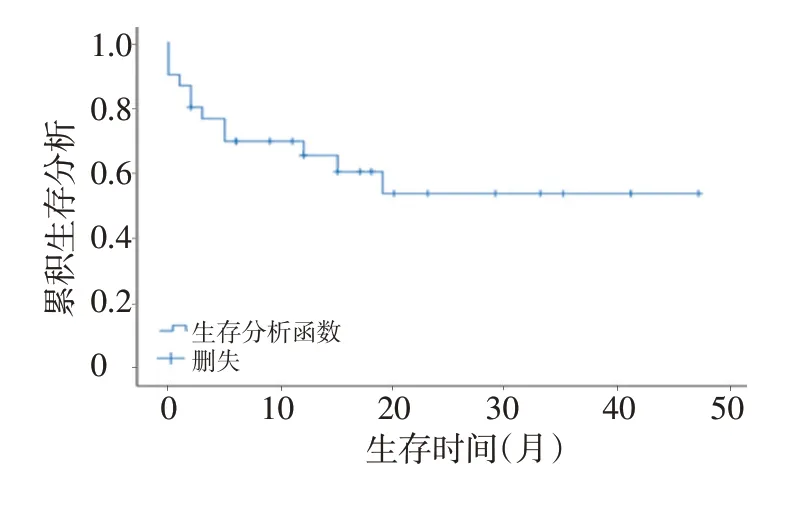
▶图1 34例患者生存曲线
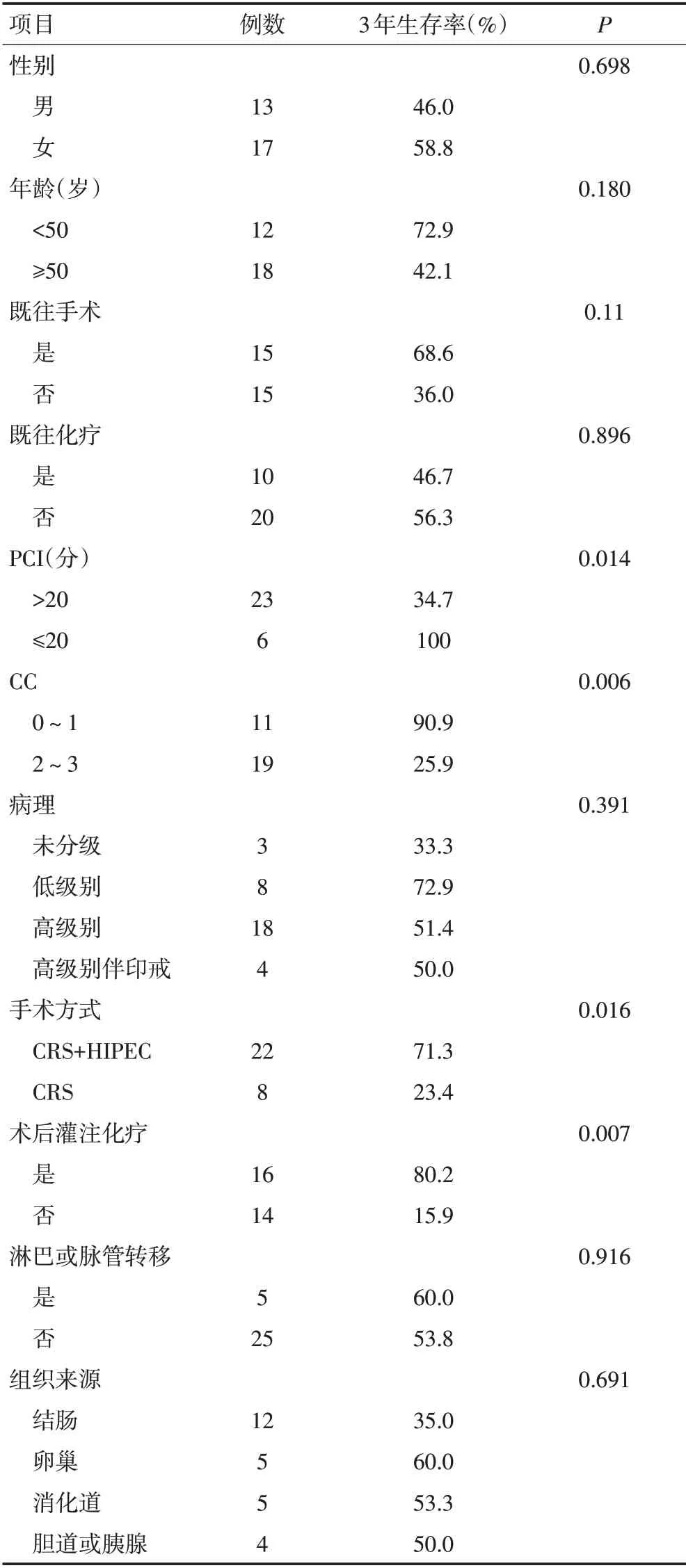
表2 34例患者生存单因素分析
3 讨论
PMP 主要来源于阑尾黏液性肿瘤,发生机制:黏液性肿瘤破裂后,游离飘浮的黏液肿瘤上皮细胞在腹腔内液体的流动和重力作用下,在腹腔内积聚、种植和播散,临床称其为“再分布现像”[8]。PMP通常表现惰性生长,虽较少发生远处转移,但在腹腔内具有广泛种植、无限生长的恶性生物学行为。在缺乏积极治疗的情况下,黏液堆积对腹腔脏器产生压迫,尤其是消化道,从而导致营养不良、肠瘘。非阑尾来源PMP 较少见,常见的非阑尾来源包括结肠、卵巢、脐尿管、胰腺、胆管、畸胎瘤等[9-11]。
因PMP 主要临床特征为腹腔内黏液性腹水蓄积,故临床表现通常无明显特异性,常见表现:腹胀、腹痛、腹围增大、腹部包块、腹水征等,随着病情发展,可逐渐出现消耗性营养不良症状。对于阑尾来源的PMP 患者而言,首发表现可为类阑尾炎症状(58%),其次为腹围增大(49%)、盆腔或上腹部包块(44%)及腹壁疝(30%)[12]。本研究中34 例非阑尾来源PMP 患者主要症状为腹胀、腹围增大20 例(58.8%)、腹盆腔部包块18例(52.9%),与阑尾来源病例表现基本相当。
术前检查判断PMP来源存在较大局限性。血清CEA、CA125及CA199为PMP患者最常用的肿瘤标记物,但并未体现出来源相关性。本研究中33 例(91%)存在1~3 项肿瘤标记物异常,与来源无显著相关性,对术前明确诊断无特异性,但值得一提的是在术后对预测复发及评估治疗效果中有一定的指导意义[13-15]。影像学检查为PMP 术前诊断的另一重要手段,PMP 的超声检查表现为腹腔大量移动性差伴有不均质点状等回声,而CT 主要表现腹腔弥漫性积液,肝脾周围有“锯齿或扇贝样”压迹、网膜饼及腹盆腔包块[16-17]。本组患者影像学检查均提示腹腔内囊实性包块及腹腔不等量积液,无法明确诊断或判断来源。PET-CT对PMP诊断价值有限,但可以明确有无腹腔外转移[18]。腹水穿刺脱落细胞学检查阴性率较高,然而抽出“胶冻样”黏液对PMP 的诊断有重要价值。本研究有31例术前检查肿瘤标志物增高;7例行腹水脱落细胞学检查,仅1例查见癌细胞;5例行腹腔肿物穿刺活检,病理提示考虑恶性肿瘤,但无法明确判断肿瘤来源。
对于PMP来源判断的金标准为病理对原发病灶的评估以及相关的免疫组织化学指标。Baratti 等[2]认为,非阑尾来源PMP 的免疫组织化学指标多表现为CDX-2、CK-20 以及MUC-2 阳性,CK-7 及MUC-5AC可能阳性,与阑尾来源PMP基本类似,尤其是小肠型的卵巢黏液肿瘤或成熟畸胎瘤,免疫组化类型可能与阑尾来源完全一致[19-22]。因此,对于无法取到原发病灶的病例,单凭免疫组织化学判断肿瘤来源仍有较大局限性,本研究中有6 例(17.6%)患者免疫组织化学提示消化道来源,但并未找到确切原发病灶,结合患者既往阑尾切除病理,最终诊断为非阑尾来源PMP。总体而言,PMP 是一系列不同来源肿瘤的统一临床表现综合征,原发病灶切除及病理检查是确诊肿瘤来源的唯一手段。
CRS+HIPEC作为目前国际公认的PMP标准治疗方案,一系列大样本量回顾性研究已经证实其在阑尾来源PMP 中的临床治疗价值。而非阑尾来源PMP,目前尚未见较大样本量研究报道。在既往文献中,非阑尾来源PMP报道最大样本量为27例,但该研究未对其生存结局进行报道[23]。
有阑尾来源PMP行CRS+HIPEC治疗的研究结果指出,接受根治性手术(CC-0~1)治疗后的患者10年生存率高达54%~70%,而接受非根治切除(CC-2~3)的患者5年生存率仅为20%~39%[24-27]。本研究中11例患者达到CC-0~1,1例患者随访期间死亡,3年总生存率高达90.9%,而非根治切除的患者中,3年总生存率为25.9%,与阑尾来源PMP生存结局基本类似。既往研究中Baratti等[2]对19例非阑尾来源的PMP与207例阑尾来源PMP的生存率进行对比,10年总生存率分别为62%、63.4%(HR=1.51;P=0.278),两者之间差异无统计学意义。从上述结论看,PMP生存似乎与来源无明显相关,无论何种组织来源,对治疗决策并无决定性影响,CRS+HIPEC仍是首选治疗方案,对于可达到临床根治的患者,非阑尾来源的PMP患者同样可以获得良好的生存结果。
本研究结果表明,与阑尾来源PMP不同的是,非阑尾来源PMP 患者病理以高级别肿瘤为主,而据既往文献阑尾来源PMP 多为低级别,约占整体的70%左右。本研究结果中,除外3 例病理级别不详的患者,高级别或伴印戒细胞的病例数占77%,尤其是结肠来源的15例患者,除1例未知病理级别外,均为高级别PMP,此点是与阑尾来源PMP 的主要差别之一。预后相关危险因素分析表明,非根治性手术、术后未行腹腔热灌注化疗以及PCI>20分是预后不良的主要危险因素,与既往阑尾来源PMP 相关研究基本一致[25-27]。虽然高级别与低级别未体现出显著性差异,但可以看出低级别PMP 患者有着更优的预后趋势,显著水平未达到预定值考虑与样本量过少存在一定的因果关系。而不同组织来源之间无显著存差异。
本研究存在部分局限性,首先为回顾性研究,样本量较少,事件发生率低。其次,因为PMP病程进展缓慢,随访时间较短,可能对研究结果产生一定影响,本研究结论有待远期进一步研究评价进行证实。
综上所述,PMP 是一种临床少见的低度恶性肿瘤,不同组织来源的PMP并无特异性临床表现,不影响治疗决策的选择。本研究结果表明,CRS+HIPEC治疗非阑尾来源PMP,效果良好,手术并发症发生率可以接受。
