竹荪多糖与多西紫杉醇联用抗肺癌效应及机制研究
2019-11-16王小红江洪丁艺晖罗聪
王小红 江洪 丁艺晖 罗聪
肺癌在我国居民恶性肿瘤发病率中居于首位[1],研究抗肺癌的新疗法具有重要意义。多西紫杉醇(docetaxel,DOC)具有较好的抗肺癌效果,常作为二线化疗药物用于非小细胞肺癌(NSCLC)的单药[2]和联合治疗[3-4],其抗癌机制主要是阻滞细胞周期,从而诱导癌细胞发生细胞凋亡。但是单一药物化疗会产生耐药性,即使初期癌细胞迅速被杀灭,肿瘤体积明显缩小,多次反复使用后癌细胞由于基因突变而产生化疗抵抗(耐药性),是肿瘤复发和预后不佳的主要原因。化疗药物的靶点是肿瘤细胞,但肿瘤细胞周围的微环境也参与化疗抵抗的形成,特别是髓源抑制性细胞(MDSC)参与肿瘤微环境中免疫负调控的形成[5]。肿瘤细胞还会分泌CXCL-5主动招募MDSC进入肿瘤微环境,MDSC会分泌IL-23参与化疗抵抗[6],基于这一机制,靶向MDSC的临床应用正成为恶性肿瘤治疗的新策略[7-8]。竹荪多糖具有诱导肺癌细胞[9]和骨肉瘤细胞[10]发生凋亡的效应,竹荪多糖组分也有调节肿瘤微环境的效应[11]。本研究联合应用竹荪多糖组分ZSP1与DOC以期降低化疗抵抗,提高肺癌的治疗效果,现将结果报道如下。
1 材料和方法
1.1 化学试剂和仪器 竹荪粗多糖购自杭州众芝康菇公司,ZSP1由本实验室自行制备;DOC(批号:180406AF,规格:每支20mg/0.5ml)购自江苏恒瑞医药股份有限公司;流式抗体(FITC-CD11b、APC-Gr1)均购自美国 BD公司;Western blot抗体(Anti-IL12、Anti-茁-actin)均购自美国Cell Signaling Technology公司;合成引物购自北京中美泰和公司;TRIzol购自美国Invitrogen公司,PrimeScript RT Master Mix购自日本 TaKaRa公司;SYBR Green域Mix购自美国Thermo Fisher公司。流式细胞仪(FACSCalibur)购自美国BD公司;Western blot检测显色成像仪购自美国Bio-Rad公司。检测步骤严格参照说明书进行。
1.2 实验动物与分组、建模和治疗 C57小鼠40只,鼠龄6~8周,体重18~22g;均购自北京维通利华公司。按照随机数字表法分为对照组(应用0.9%氯化钠注射液)、ZSP1组、DOC组和ZSP1+DOC(联用组),每组10只,皮下注射路易斯肺癌(LLC)肿瘤细胞悬液100滋l(含肿瘤细胞5伊105个),当天即开始药物干预,ZSP1组小鼠腹腔注射ZSP1 10mg/kg,DOC组小鼠腹腔注射DOC2mg/kg,联用组腹腔注射相同剂量竹荪多糖组分ZSP1和DOC,上述药物均溶于100滋l的0.9%氯化钠注射液,对照组注射100滋l的0.9%氯化钠注射液,均隔日1次,开始治疗第10、12、15天记录肿瘤体积。另再选取Toll样受体4(TLR4)基因敲除的C57小鼠(TLR4KO组)和野生型C57小鼠(WT组)各10只,鼠龄6~8周,体重18~22g;均购自北京维通利华公司进行抗肿瘤体内实验。该两组小鼠均用竹荪多糖组分ZSP1和DOC混合液灌胃(剂量和配置方法同上述联用组),1次/d,自第1天至第15天,并于第10、12、15天记录肿瘤体积。
1.3 MDSC占外周血单核细胞比例的检测 采用流式细胞术。实验第10、12和15天鼠尾静脉采血,肝素抗凝,用红细胞裂解液裂解红细胞后进行FITC-CD11b和APC-Gr1流式抗体染色,然后上流式细胞仪检测。
1.4 MDSC 中 IFN-酌、IL-12、CXCL-9和 CXCL-2 mR原NA测定 采用实时荧光定量PCR法。动物实验于第15天结束后麻醉处死小鼠,取出脾脏,将脾脏置于两片灭菌玻片毛面间轻轻摩擦,制成细胞悬液,经流式细胞仪分选其中的MDSC,加入适量的Trizol液,提取RNA,采用PrimeScript RT Master Mix合成cDNA。采用SYBR Green域Mix试剂盒进行定量PCR分析,反应体系为15滋l,包括:cDNA 1滋g,上下游引物各 0.5滋l,SYBR Green域Mix 7.5滋l,水补足,检测细胞因子 IFN-酌、IL-12、CX原CL-9和CXCL-2 mRNA水平变化。扩增条件:95益预变性1min,按以下条件扩增 40个循环:95益 15s,57益1min。引物序列见表1。

表1 IFN-γ、IL-12、CXCL-9和CXCL-2的引物序列
1.5 MDSC中IL-12蛋白表达水平测定 采用Western blot法。收集脾脏MDSC细胞,加入适量的组织裂解液,冰上裂解30min,4益,14 800r/min离心30min,取上清液,经蛋白定量后,取30滋g总蛋白于10%聚丙烯酰胺凝胶中,电泳分离;经电转膜后,用3%牛血清白蛋白室温封闭90min,加入一抗,4益孵育过夜;PBST缓冲液洗涤,每次5min,共5次,加入辣根过氧化物酶标记的二抗,室温孵育1h,PBST缓冲液洗膜,每次5min,共5次,用增强化学发光试剂显影,以茁-actin为内参。上述实验重复3次。
1.6 统计学处理 采用SPSS 16.0统计软件。计量资料以表示,两组间比较采用t检验,多组间比较采用单因素方差分析,多重比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 药物联用与单独应用4组小鼠肿瘤体积的比较ZSP1组、DOC组和联用组小鼠的肿瘤体积在第10、12、15天比对照组明显缩小,差异均有统计学意义(均P<0.01),见表 2。

表2 药物联用与单独应用4组小鼠肿瘤体积的比较(mm3)
2.2 TLR4KO组与WT组小鼠肿瘤体积的比较 TLR4KO组小鼠的肿瘤体积在第10、12天较WT组明显缩小(均P<0.01),而在第15天,两组间比较差异无统计学意义(P>0.05),见表 3。

表3 TLR4KO组与WT组小鼠肿瘤体积的比较(mm3)
2.3 药物联用与单独应用4组小鼠MDSC占外周血单核细胞比例的比较 流式细胞术检测结果显示,第12、15天联用组小鼠的MDSC比例均明显低于对照组、ZSP1组和DOC组,差异均有统计学意义(均P<0.01),见图1和表4。

图1 药物联用与单独应用4组小鼠不同时间流式细胞术检测结果
2.4 TLR4KO 组与 WT 组小鼠 IFN-酌、IL-12、CXCL-9、CXCL-2 mRNA表达水平和IL-12蛋白表达水平比较与WT组相比,TLR4KO组IFN-酌、IL-12和CXCL9mRNA表达水平均明显增加(均P<0.01),而CXCL-2mRNA表达水平未见差异(P>0.05),见表5。IL-12蛋白表达水平有所增加,见图2。
3 讨论
以往的研究发现竹荪多糖可以降低荷瘤小鼠脾脏中MDSC占脾脏细胞的比例,而MDSC是肿瘤微环境中主要的免疫负调控细胞之一,MDSC减少有助于解除对T细胞的免疫抑制效应,从而发挥机体自身的抗肿瘤免疫作用,促进肿瘤体积变小。

表4 药物联用与单独应用4组小鼠MDSC占外周血单核细胞比例的比较(%)

表5 TLR4KO组与WT组小鼠IFN-γ、IL-12、CXCL-9和CXCL-2 mRNA表达水平比较
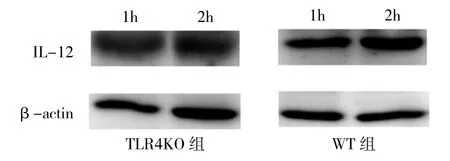
图2 TLR4KO组与WT组小鼠IL-12蛋白表达的电泳图
DOC作为肺癌临床治疗的二线药物,常用于一线化疗药抵抗时的候选用药。有研究表明,化疗起效与免疫系统密切相关,化疗是通过免疫系统中的CD4+和CD8+T细胞来发挥抗肿瘤疗效,且其与非肿瘤细胞表达IFN-酌受体有关[12]。T细胞分泌IFN-酌,作用于肿瘤相关成纤维细胞(CAF)表面的IFN-酌受体后,CAF分泌的血管内皮生长因子减少,导致血管新生减少[13-14],引起肿瘤缺血性坏死。也有学者认为是由于IFN-酌直接作用于血管内皮细胞[15],导致其凋亡,从而阻断肿瘤内的血管新生。
化疗可诱导肿瘤细胞发生免疫原性细胞死亡(im原munogenic cell death,ICD)[16]。某些化疗药(蒽环类及铂类)诱导ICD后,引起机体产生肿瘤特异性免疫反应,从而导致肿瘤体积缩小,该效应与TLR4受体有关。有研究采用光治疗与免疫佐剂糖化壳聚糖联用,利用光治疗产生的ICD效应,通过免疫佐剂的刺激效应,进一步激活机体的肿瘤特异性免疫反应,在胰腺癌治疗中取得了一定的效果[17]。
本研究将化疗药物与免疫调节剂竹荪多糖联用,一方面发挥了化疗药物的强力杀伤效应,另一方面竹荪多糖对肿瘤微环境起改善作用,结果显示两者联用后,荷瘤小鼠的肿瘤生长减慢,体内的MDSC比例下调。这一结果提示临床上可以将调节肿瘤微环境的竹荪多糖组分ZSP1与DOC联合应用于肺癌的治疗,化疗药物与肿瘤免疫的关系研究可为临床肺癌治疗方案的制定提供新的思路。
