精神分裂症易感基因GNA13功能的初步分析☆
2019-11-15罗艺苹刘可智喻明兰梁雪梅张涛向波
罗艺苹 刘可智 喻明兰 梁雪梅 张涛 向波
精神分裂症是高遗传度的多基因神经精神疾病[1-2]。多项全基因组关联研究(genome-wide association study,GWAS)发现 G蛋白 α亚基 13(GNA13)基因与精神分裂症存在关联[3-4]。分析精神分裂症患者前额皮质的DNA甲基化数据,发现DNA甲基化发生改变区域与精神分裂症遗传风险区域相重叠[5];构建精神分裂症特异性甲基化网络(schizophrenic differential methylation network,SDMN)发现GNA13基因是精神分裂症特异性甲基化基因中主要的高甲基化基因[6]。另有研究发现精神分裂症患者大脑前额皮质中的GNA13基因表达减少,同时GNA13-ERK1-eIF4G2-CYFIP1信号传导网络出现下调[7],而该信号传导网络则主要参与神经元的突触发育和功能形成,以及大脑功能连接,可能与精神分裂症认知功能障碍相关[8-10]。因此,GNA13基因既是影响精神分裂症发生发展中多基因联合效应的易感基因[11],也是精神分裂症患者脑组织中发生特异性高甲基化的主要基因。基于此,推测GNA13基因异常可能影响神经细胞形态和突触可塑性,从而导致精神分裂症的发生。本研究采用动物细胞体外实验,以慢病毒转染的方式敲低原代神经元细胞的Gna13基因,通过基因表达差异性分析,初步探索其功能。
1 材料与方法
1.1 实验对象由北京华阜康生物科技股份有限公司提供C57BL6N野生型怀孕小鼠10只,经过适应性饲养1周后,将出生后24 h内的幼鼠处死,取其大脑皮层组织进行原代神经元培养。本研究动物的使用等所有操作已通过西南医科大学动物伦理委员会批准。
1.2 研究方法
1.2.1 原代神经元培养与慢病毒感染 参考并在BEAUDOIN等[12]的培养方案上,改用木瓜蛋白酶代替胰蛋白酶将出生24 h之内幼鼠的大脑皮层组织制备成单细胞悬液,接种在24孔板上,进行原代神经元细胞培养。在离体的第3天,用干扰Gna13基因的重组慢病毒载体Y1645(和元生物技术股份有限公司,上海)感染实验组细胞,空载的慢病毒载体Y007(和元生物技术股份有限公司,上海)感染空载对照组细胞,对照组细胞不做任何干预。将上述细胞在同等实验条件下继续培养,病毒的感染复数为10。在感染72 h后,将所有细胞分成3份分别做蛋白表达分析、mRNA表达分析、高通量测序。
1.2.2Gna13基因的mRNA表达水平分析 使用TRIzol Reagent(Thermo Fisher Scientific,美国)提取所有细胞中的RNA。用HifairTMIII 1stStrand cDNA合成试剂盒 (翊圣生物科技有限公司,上海)逆转录得到总计2 μg的RNA。使用10 ng RNA的HieffTMqPCRSYBR®Green Master Mix(Low Rox Plus)(翊圣生物科技有限公司,上海)在25 μL反应混合物中进行实时定量PCR(quantitative real-time PCR,qRT-PCR)检测。反应条件:95℃预变性5 min;95℃变性 10 s,58℃退火 20 s,72℃退火20 s,40个循环。产物使用荧光信号检测。
1.2.3Gna13基因蛋白表达水平分析 用RIPA裂解缓冲液(碧云天生物技术有限公司,上海)裂解细胞后,获取蛋白质,用BCA蛋白质分析试剂盒(Thermo Fisher Scientific,美国)检测其浓度。通过分离、转膜,将蛋白质在5%脱脂乳的TBS-Tween(TBS-T,50 mmol/L Tris (pH 7.6),150 mmol/L NaCl,0.1%Tween-20)中封膜。然后将膜与一抗兔抗 GNA13 抗体(Rb anti-GNA13 antibody)(目录号OM161046;稀释度 1:500;Omni.Abs,美国)孵育,4℃过夜。用TBST洗涤3次,与氧化物酶标记的生物素二抗 (biotinylated secondary antibodies)(目录号711-005-152;稀释度1:4000;目录号 715-005-150; 稀释度 1:6000;Jackson Immuno Research,美国)和鼠抗β-肌动蛋白抗体(Ms anti-β-actin antibody)(目录号 ab8226; 稀释度 1:10000;Abcam,美国)在室温下孵育1 h。使用β-肌动蛋白作为内源性对照,将GNA13蛋白的光密度条带用Image J 软 件 (Image J National Institutes of Health,Bethesda,美国)进行分析。
1.2.4 构建文库和RNA测序 使用分光光度计2000(Nanodrop Technologies,美国)和 Agilent 2100(Agilen Technologies,美国)测定RNA的浓度和完整系数(integrity number,IN)。通过琼脂糖凝胶电泳测定RNA完整性,用高质量RNA样品(OD 260/280=1.8~2.0)构建测序文库。然后使用Illumina(美国)的TruSeqTMRNA样品制备试剂盒,取5 μg RNA制备RNA-seq转录组文库。首先,用polyA-oligo dT分离mRNA,然后通过碎片缓冲液将mRNA片段化,通过随机合成六聚体制备cDNA。Illumina(美国)文库构建用于处理合成的cDNA,在2%低含量琼脂糖上用200~300 bp的目标cDNA片段选择文库大小,然后使用Phusion DNA聚合酶进行PCR扩增15个循环。通过TBS380定量后,用高通量测序技术4000(Illumina HiSeq 4000,美国,2×150 bp 读取长度)对配对端的RNA-seq测序文库进行测序。
1.2.5 测序短序列匹配原始配对端读数由含有默认参数的SeqPrep和Sickle进行修剪和质量控制。然后使用TopHat软件[13]将读数分别与定向模式的参考基因组比对。Bowtie映射标准如下:测序读数与基因组一对一匹配,最多允许2个错配,无插入或缺失等错误。然后根据基因位点的深度扩展基因区域获得操纵子。此外,整个基因组被分成多个可共享5 kbp的15 kbp视窗。新的转录区域定义为含有2个以上连续视窗,而且没有基因区域的重叠,其中每个视窗可以读取2个相同方向的映射。
1.2.6 基因表达分析 用R软件edgeR[14]对实验组、空载对照组和对照组进行基因表达的差异性分析(differential expression genes,DEG),使用每千碱基外显子的片段对应每百万映射读数(fragments per kilobase of exon per million mapped reads,FRKM)方法计算每个转录物表达水平,用LI等[15]研究中RNA测序期望值最大化方法定义基因丰度。
1.2.7 基因的 Phenotype 表型、Gene ontology(GO)以及Kyotoencyclopediaofgeneandgenomes(KEGG)分析 对差异基因用WebGestalt软件[16]进行Phenotype表型、GO以及KEGG富集分析,应用超几何检验,经多重校正 (false discovery rate,FDR)后P<0.05的相关表型、生物学通路以及KEGG pathway为具有统计学意义。
1.3 统计学方法使用 SPSS 19.0版(Chicago,IL,美国)进行统计学分析。实验组、空载对照组和对照组mRNA和蛋白表达水平组间比较采用单因素方差分析,进一步两两比较采用最小显著差异法(least-significant difference,LSD), 检验水准 α=0.05。
2 结果
2.1 Gna13基因的mRNA和蛋白表达水平3组间Gna13基因的 mRNA(F=11.02,P=0.01)和蛋白(F=504.95,P<0.01)表达水平差异有统计学意义,两两比较,实验组mRNA和蛋白表达水平均低于空载对照组和对照组(P<0.05),空载对照组与对照组之间表达差异无统计学意义 (P>0.05)(表1与图 1)。
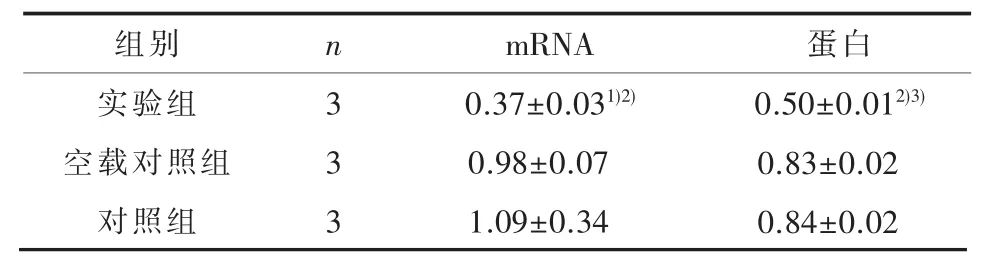
表1 小鼠大脑皮层神经元感染重组病毒后Gna13基因mRNA和蛋白表达水平
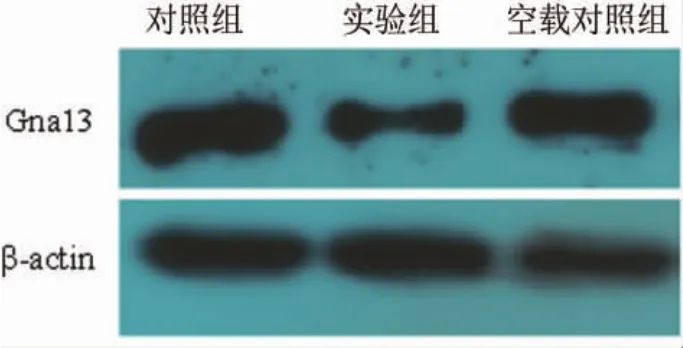
图1 小鼠大脑皮层神经元感染重组病毒后Gna13蛋白表达水平电泳图。对照组为未经处理的正常神经元,实验组为转染Gna13基因重组慢病毒(Y1645)的神经元,空载对照组为转染空载慢病毒载体(Y007)的神经元
2.2 基因功能分析
2.2.1 基因表达差异分析 实验组与对照组相比,表达有差异的基因共211个(P<0.05,FDR校正),其中表达上调基因共141个,表达下调基因共70个(图 2)。
2.2.2 表型富集分析表型富集分析表明,表达上调基因主要与生存异常、老化异常、肾小管形态异常等表型相关(P<0.05,FDR校正),表达下调基因主要与异常有丝分裂、脑形态异常、产前发育迟缓等表型相关(P<0.05,FDR 校正)(表 2)。
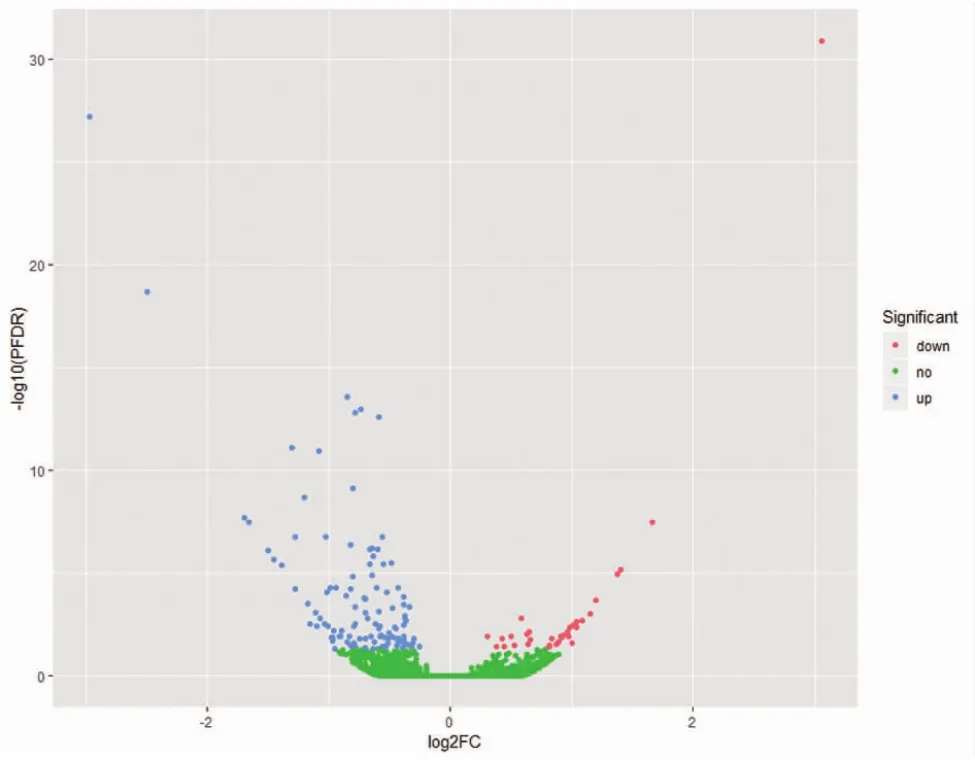
图2 神经元转染重组病毒后基因差异表达火山图。红色点代表实验组相较对照组表达下调的基因,蓝色点代表实验组相较对照组表达上调的基因,绿色点代表差异无统计学意义的基因
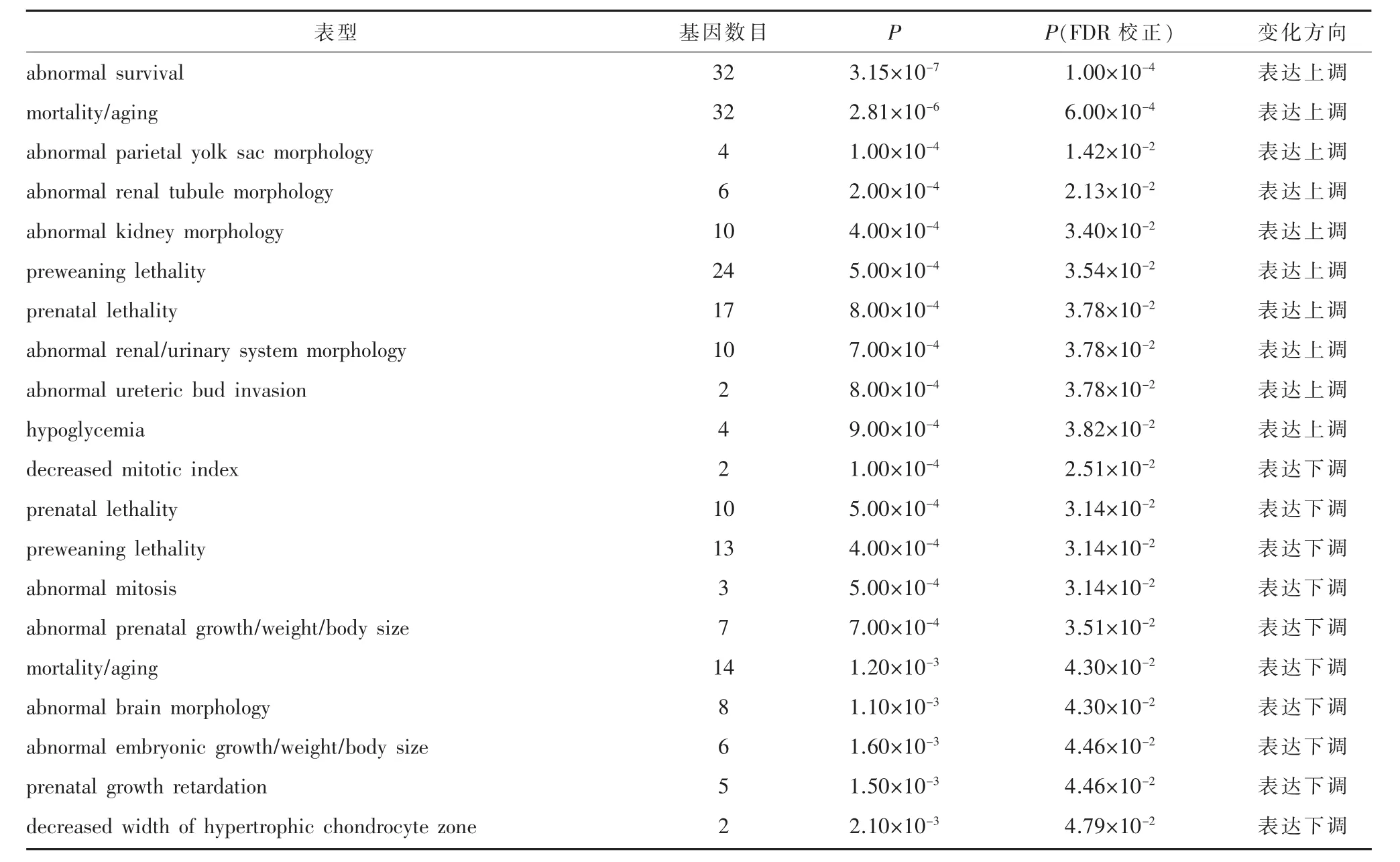
表2 Gna13基因差异表达表型富集分析结果
2.2.3 GO功能富集 GO富集分析表明,表达上调基因主要与蛋白质定位、细胞代谢过程、细胞内转运等生物过程相关(P<0.05,FDR校正),表达下调基因主要与细胞周期的催化代谢、细胞周期蛋白依赖性蛋白激酶活性的正调节、细胞的高分子代谢等生物过程相关(P<0.05,FDR 校正)(表 3)。
2.2.4 Pathway富集分析 Pathway富集分析显示,表达上调基因主要参与神经营养因子信号通路、轴突导向、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路和有丝分裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)信号通路(P<0.05,FDR 校正),表达下调基因主要参与 p53(protein 53,p53)信号通路、调节肌动蛋白细胞骨架和粘着力 (P<0.05,FDR校正)(表 4)。
3 讨论
多种基因相互作用以及基因和环境间相互影响共同导致精神分裂症发生[17]。一方面有研究利用新一代的测序技术(next-generation sequencing,NGS)和GWAS,发现精神分裂症的相关基因位点,通过多基因综合分析为精神分裂症遗传学研究提供基础[18];另一方面精神分裂症的表观遗传学研究则提供了基因和环境间相互影响的重要信息[19]。

表3 Gna13基因差异表达GO功能富集分析结果

表4 KEGG通路分析结果
本研究通过重组病毒感染小鼠实验组大脑皮层神经元细胞,并进行mRNA及蛋白表达水平分析发现,空载对照组与对照组之间的表达差异无统计学意义(P>0.05,FDR 校正),表明空载病毒(Y007)本身对神经元细胞表达Gna13基因的mRNA及蛋白无明显影响;而实验组与空载对照组和对照组之间表达差异有统计学意义(P<0.05,FDR校正),表明重组病毒(Y6145)成功感染,并敲低Gna13基因,导致其mRNA和蛋白表达水平降低。在此基础进行基因表达的差异性分析,检测到相对于对照组,Gna13基因敲低后细胞表达有差异的基因共211个 (P<0.05,FDR校正),对这211个基因进一步进行分析。
在Phenotype表型分析中,本研究发现表达下调基因参与脑形态异常的表型。目前已有影像学研究发现,与健康对照组相比,首发精神分裂症患者的海马体、丘脑、纹状体、左侧颞中回和小脑灰质体积减小,脑干、前额以及胼胝体白质减小,第三脑室及侧脑室扩大[20-21]。本研究结果支持GNA13基因异常可能引起脑形态异常,从而参与精神分裂症发生发展,但目前证据并不充分,其关联性及具体机制仍需进一步探索。
在GO富集分析中,表达下调的基因与细胞周期、细胞周期的催化调节、细胞周期蛋白依赖性蛋白激酶活性的正调节等生物学过程相关;而在pathway的富集分析中,表达下调的基因同样与异常有丝分裂、细胞周期、p53信号等通路相关。而目前已有研究证实精神分裂的发生发展与神经细胞周期调节异常密切相关[22]。同时在GO富集分析中,表达下调的基因与细胞代谢、细胞的大分子代谢过程相关,pathway富集分析中也发现表达下调的基因与代谢途径相关。而既往研究表明精神分裂症患者常常伴有代谢综合征和氧化应激[23]。因此,本研究提示GNA13基因异常可能导致细胞周期调节异常及代谢异常,这与精神分裂症病理变化具有一致性,但其关联性及具体机制仍需进一步探索。
在pathway分析中发现表达下调基因参与肌动蛋白细胞骨架调节和粘附力等相关通路。而MOERS等[24]研究发现G蛋白α亚基13与肌动蛋白细胞骨架调节和以肌动蛋白为基础的细胞收缩性有关,敲除编码G蛋白α亚基I2和G蛋白α亚基13中α亚基的基因后,小鼠皮质神经元和小脑浦肯野细胞过度迁移,导致大脑和小脑皮质的神经元异位,提示GNA13可能通过参与肌动蛋白细胞骨架调节和粘附力而影响神经元功能。同时,HIRAYAMA-KUROGI等[7]研究发现精神分裂症患者的大脑前额皮质中GNA13基因表达减少,GNA13-ERK1-eIF4G2信号传导网络出现下调,进一步导致下游eIF4A1/2和CYFIP1表达减少。同时已有研究证明,在精神分裂症的动物实验中,CYFIP1表达缺陷将导致大脑功能连接性缺陷以及神经突触前功能改变,从而引起精神分裂症感知觉异常的相关症状[8-10]。因此本研究提示GNA13基因可能通过影响肌动蛋白细胞骨架调节和突触形成,进而参与神经细胞形态的形成、神经细胞突触可塑性以及大脑形态形成,从而影响精神分裂症发生发展,但其关联性及具体机制仍需深入探索。
本研究仍然存在明显不足之处:首先实验仅使用敲低实验组Gna13基因,进行基因表达分析的方法,没有进行Gna13基因过表达的相关实验,难以明确基因的基本功能;其次,本研究仅为体外培养动物细胞研究,在细胞水平对该基因可能的功能进行初步探索,没有相关的形态学、功能学实验以及动物行为学实验,无法对GNA13基因功能在精神分裂症发生发展中的作用提供直接证据。未来研究可以结合动物实验及临床数据,对GNA13基因和精神分裂症的关联做进一步研究。
