幽门螺杆菌感染与慢性牙周炎相关性的Meta分析▲
2019-11-14高碧云
高碧云
(广西医科大学口腔医学院,附属口腔医院儿童牙病科,南宁市 530021,电子邮箱:joely918@163.com)
慢性牙周炎是导致成年人失牙的主要原因[1]。牙周炎发病机制复杂,牙菌斑生物膜及细菌代谢产物是其始动因子[2]。幽门螺杆菌(Helicobacterpylori,Hp)是一种微需氧的革兰阴性螺旋菌,是慢性胃炎、胃溃疡以及胃癌的危险因素之一[2-3]。除胃部外,Hp也可能存在于人体内的其他部位,如口腔中。约30年前,已有学者从胃炎患者的牙菌斑[4]、唾液[5]中分离出具有生存能力的Hp,此后越来越多的研究开始关注口腔疾病与Hp感染/再感染之间直接或间接的关系,并证实口腔Hp与胃Hp相互传播的可能性较大[6]。近年来,有关Hp感染与慢性牙周炎之间关系的研究结果不一,Hp感染是否为慢性牙周炎发生的危险因素尚存在争议[7]。由于Hp对不同人种的感染能力存在差别,且亚洲国家的饮食方式(如共用餐盘等)更利于Hp的经口传播[8],因此本研究纳入以中国人群作为研究对象的中文文献,系统评价Hp感染与慢性牙周炎的关系,以期为中国人群慢性牙周炎的防治提供参考依据。
1 资料与方法
1.1 检索策略 以“牙周病”“牙周炎”“慢性牙周炎”“幽门螺杆菌”“幽门螺旋杆菌”为检索词,在中国期刊全文数据库(中国知网)、万方数据库、维普中文科技期刊数据库(含全文版)中进行检索。检索时间自1997年1月1日至2017年12月31日。
1.2 纳入标准 (1)以>18岁的中国人群为研究对象的临床研究,包括病例对照研究、横断面研究以及队列研究;(2)Hp检测部位为胃或口腔,有明确的Hp感染诊断方法及标准,包括呼气试验、PCR、尿素酶检测等;(3)有明确的牙周炎诊断标准,包括附着丧失、牙槽骨吸收程度、松动程度等;(4)分析指标为慢性牙周炎患者与非患者之间Hp的检出率;(5)数据呈现形式包括可直接获取的比值比(odds ratio,OR)及其95%CI,或可转换为OR及95%CI的数据;(6)中文文献。
1.3 排除标准 (1)病例报告、综述、述评或基础研究;(2)非慢性牙周炎的口腔其他疾病;(3)无健康对照。
1.4 文献筛选及数据提取 由两位研究人员分别根据纳入和排除标准进行文献筛选,如有争议则通过讨论协商,或增加第3位研究人员进行协商判定。提取资料包括第一作者姓名、发表年份、研究类型、Hp感染部位、样本量、Hp检测方法等,提取后进行交叉核对。
1.5 文献质量评估 采用Newcastle-Ottawa量表来评价纳入研究的方法学质量。评价内容包括对象选择(病例定义是否充分、病例代表性、对照选择、对照定义)、可比性和暴露因素(确认暴露、确认病例和对照的方式一致、无应答率)。纳入评分≥5分的研究进行分析。
1.6 统计学分析 采用Stata 12.1软件进行统计分析。参考相关文献[9],将原文的数据转换为OR值及95%CI(效应指标)。采用χ2检验判断各研究间是否存在异质性,若P≥0.10和(或)I2≤50%时,认为各研究间异质性差异无统计学意义,采用固定效应模型进行分析,反之则认为异质性差异有统计学意义,采用随机效应模型进行分析。采用Begg检验分析潜在的发表偏倚。采用Stata软件的metainf 指令进行敏感性分析[10]。Meta分析以P<0.05为差异有统计学意义。
2 结 果
2.1 文献检索结果及纳入研究的基本特征 初检得到文献255篇,经过剔除重复文献、阅读题目、摘要、全文等步骤,最终纳入18篇文献[11-28]共21项研究(若文献中同时检测胃部和口腔Hp的感染情况则计为2项研究)。其中有2篇文献仅检测胃部Hp感染情况,有13篇文献仅检测口腔Hp感染情况,有3篇文献同时检测了胃部和口腔Hp感染情况[9]。纳入研究的基本特征见表1。

表1 纳入研究的基本特征
注:#采用校正OR值;*在计算OR值时四格表内一项为0,对每项值加0.5后计算OR值。
2.2 Meta分析结果
2.2.1 Hp感染与慢性牙周炎的关系:18篇文献[11-28]共21项研究均分析了Hp感染与慢性牙周炎的关系。各研究间异质性差异有统计学意义(I2=87.0%,P<0.001),采用随机效应模型进行合并。结果显示,Hp感染与慢性牙周炎之间存在相关性(OR=4.19,95%CI:2.79~6.28;P<0.001)。见图1。
2.2.2 Hp感染与慢性牙周炎关系的亚组分析:以检测部位(胃或口腔)、研究类型(横断面研究或病例对照研究)和样本量(≤200例或>200例)为分层因素进行亚组分析。结果显示,在不同检测部位、研究类型和样本量的研究中,Hp感染与慢性牙周炎存在相关性(均P<0.05)。见表2、图2。

图1 Hp感染与慢性牙周炎关系的森林图

表2 亚组分析结果


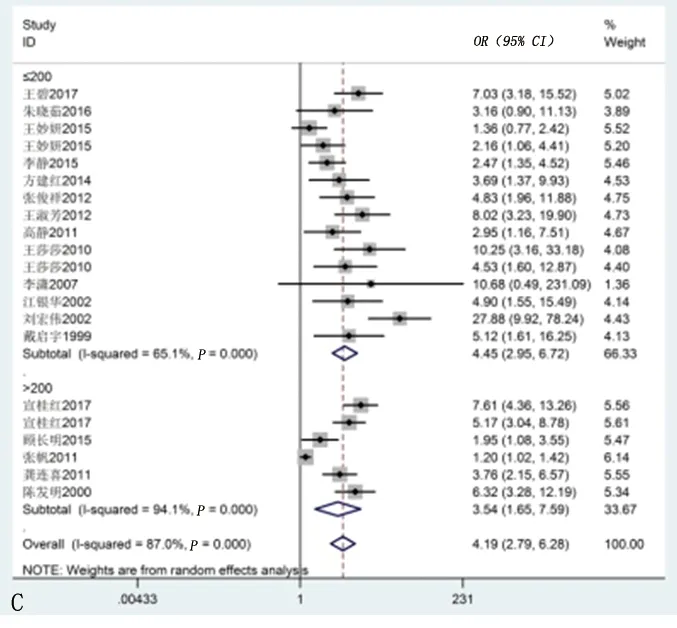
图2 亚组分析森林图
注:图A为以不同检测部位为分层因素的亚组分析森林图;图B为以不同研究为分层因素的亚组分析森林图;图C为以不同样本量为分层因素的亚组分析森林图。
2.3 敏感性分析及发表偏倚 将所有纳入的研究按照年份排列,依次剔除每项研究,并对剩下的所有研究分别进行Meta分析,剔除研究后合并效应量OR值及95%CI与未排除前Meta分析结果比较均无明显改变,提示本研究结果较为稳定,见图3。Begg检验(偏性系数为0.875,P=0.881)提示本研究无明显发表偏倚。
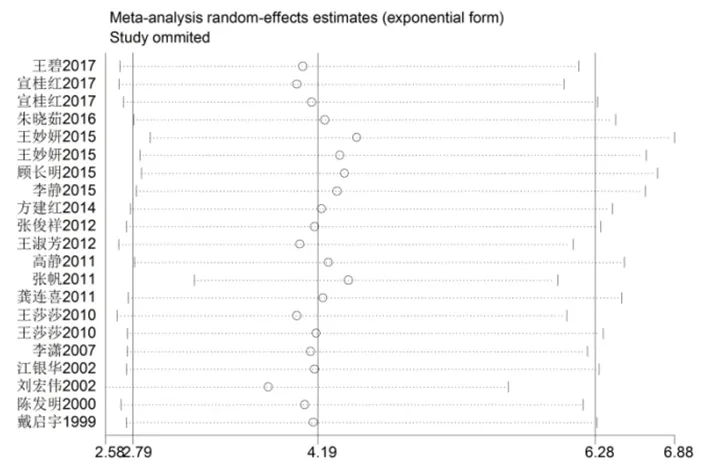
图3 敏感性分析
3 讨 论
口腔作为上消化道的上端,是Hp感染胃部的必经之路,且口腔黏膜与胃黏膜同属消化系统,均来源于外胚层,其结构、功能、生理、病理有许多相似之处,可能有着共同的免疫发病机制。牙周袋可满足Hp定植所需的温度和微需氧环境,局部的低氧化还原电势和龈沟液内丰富的蛋白酶都为Hp的生存提供了必要的支持[7,29]。因此,牙周袋可能是人体内Hp的第二大储存库,这可在一定条件下导致胃部和口腔疾病的发生[29]。本研究结果显示,Hp感染可增加慢性牙周炎的发生风险(P<0.05);而亚组分析结果也显示,在不同检测部位、研究类型和样本量的研究中,Hp感染亦可增加慢性牙周炎的发生风险(均P<0.05)。牙周炎是一种多因素所致疾病,其与Hp感染的具体作用机制目前仍未明确,但目前认为其机制可能为:(1)Hp可进入牙周组织利用尿素酶分解尿素后促进牙周组织破坏。尿素酶是Hp重要的致病因子之一,尿素酶可分解尿素生成氨和二氧化碳,氨可对周围细胞产生细胞毒性作用,改变黏膜表面的电荷梯度并增加通透性,而牙周袋中的牙菌斑微生物膜及其代谢产物也可侵入牙周组织引发牙周炎症[30]。(2)Hp的主要抗原成分CagA和UreC可以引起机体发生强烈的免疫反应[29],从而产生和释放大量细胞因子,其中白细胞介素1、白细胞介素6、白细胞介素8和肿瘤坏死因子α等细胞因子在牙周炎的发展进程中起着重要的作用,可促使牙龈成纤维细胞凋亡、结缔组织降解和骨组织吸收;同时,当机体处于高炎症反应状态时,宿主对牙周致病菌及其毒性产物的免疫应答也可能发生改变,从而使牙周袋内的炎性介质增加,加重牙周的病变程度[29]。(3)Hp可导致中性粒细胞呼吸爆发,生成大量过氧化氢从而诱发局部氧化应激、产生大量活性氧族物质,进而引起牙周组织的直接损伤;另外,其也可能通过改变细胞信号通路途径造成牙周组织对微生物免疫反应的级联放大效应从而导致牙周组织破坏[31]。
综上所述,Hp感染可能是慢性牙周炎发生的危险因素之一。本研究仍存在一定局限性:(1)纳入的研究平均质量评分仅为6.5分。(2)纳入的研究多为病例对照研究,存在的选择偏倚等可能会降低结果的精确性和检验效能,可能对结果的可信度造成一定影响。(3)亚组分析中各研究异质性较大,所得结论的普适性有限。纳入的研究中采用了不同方法检测Hp感染,如PCR、呼气试验、快速尿素酶检测试纸以及甲苯胺蓝等;另外,在牙周炎的诊断中,部分研究凭借牙周临床指标诊断,部分研究借助拍摄X线片等辅助检查进行诊断。Hp感染检测方式不同,牙周炎诊断指标的不完全统一,都可能是导致本研究数据合并时异质性较大的原因。但本研究进行的亚组分析及敏感性分析结果均与总体一致,说明研究间的异质性并不影响证据质量,结论外推性较好。
