亚甲基四氢叶酸还原酶基因多态性荧光PCR检测方法的建立与应用
2019-11-14刘秀卿李延武李卓成
刘秀卿,李延武,李卓成
(深圳市第二人民医院检验科,广东深圳 518035)
亚甲基四氢叶酸还原酶(MTHFR)多态性,特别是677位点与多种临床疾病相关[1-2];有研究认为MTHFR基因C677T多态性和血浆同型半胱氨酸水平、H型高血压合并冠心病发病有一定相关性[3];677位点基因突变可导致酶活性下降,造成叶酸代谢障碍,引发多种新生儿出生缺陷及妊娠期疾病。所以对该基因的基因型检测在临床上具有重要意义。临床上单核苷酸基因多态性的检测方法较多,包括TaqMan荧光PCR法、荧光PCR溶解探针法、焦磷酸测序法、基因芯片检测方法、磁珠微粒法以及高通量测序法等[4-9]。溶解曲线探针法容易受到反应实际组分差异的影响,如离子浓度差异导致溶解曲线的轻微变性导致结果判断受干扰;焦磷酸测序、基因芯片检测操作复杂,流程较长,不适合临床广泛使用;高通量测序方法的检测通量大,但同样操作复杂,而且后续的数据分析复杂,需要专业的生物信息学分析人员分析结果。TaqMan荧光PCR检测方法操作简单、检测速度快、检测通量适中、检测结果易于判断、临床应用广泛,是一种适合单核苷酸多态性检测的方法。本文基于TaqMan探针检测方法,期望建立一种适合于临床推广应用的MTHFR基因667位点快速检测方法。
1 资料与方法
1.1一般资料 收集2017年7-12月于深圳市第二人民医院就诊患者的已检测标本。女193例,男107例,年龄18~86岁,中位数43岁,其中120例来至妇产科,为平滑肌瘤、卵巢囊肿及接受人工流产的妇科患者;120例来至心内科,为胸闷、高血压、心肌梗死和冠状动脉性心脏病患者;另外60例来至体检科,为体检健康人员。真空采血管采肘前静脉血2~3 mL,EDTA-K2抗凝,每个样本均分为2管,保存于-70 ℃超低温冰柜,冻融次数不超过3次。
1.2试剂与仪器 10×Taq buffer(Mg2+plus)、dNTP(含dUTP) 、HS-Taq和UNG酶购自日本Takara公司;25 mmol/L MgCl2购自中国北京普洛麦格公司;甘油购自美国Sigma-Aldrich公司;血液基因组DNA提取试剂盒购自中国北京天根生化科技有限公司,货号DP348;核酸扩增仪购自中国珠海黑马医学仪器有限公司,型号HeMa9600;荧光PCR检测系统购自美国ABI公司,型号7500;离心机购自德国艾本德公司,型号5417C/R;超微量分光光度计购自德国Implen公司,型号P-330-31。
1.3方法
1.3.1引物探针设计 从美国NCBI基因库下载人MTHFR基因的参考基因序列(NG_013351.1),选定第4外显子上的rs1801133多态性位点(c.C677>T)前后各800个核苷酸,用Primer Premier 5.0及Primer Express 3.0软件针对MTHFR677位点序列设计测序引物和荧光PCR引物及TaqMan-MGB探针。引物、探针由大连宝生物公司合成,见表1。

表1 测序PCR引物和荧光PCR引物探针
注:1*表示羧基荧光素;2*表示六氯荧光素;3*表示小沟结合物
将设计的荧光检测引物在美国国立生物技术信息中心网站比对,共比对到25条MTHFR基因序列,其中有1条序列(EF.026975.1)在677F2有1碱基突变,突变后的序列为:CCG AAG CAG GGA TCT TTG。该引物组和序列AL031594.9有部分序列错配,其中677R2在该序列97375-97358位置有错误匹配,匹配序列为TGC ATG CCT TCA CAA,错配部分的DNA的熔解温度(Tm值)为46.1 ℃;677R2在该序列95681-95698位置有错误匹配,匹配序列为CAT GCC TTC ACA A,错配部分的Tm值为34.0 ℃。由于错配引物的Tm值和完全匹配的引物Tm差异较大,可以通过提升荧光检测PCR的退火温度避免引物错配。
1.3.2普通PCR及测序反应 在核酸扩增仪上进行。MTHFR 667位点的PCR总反应体系为40 μL,包括10×Taq buffer(Mg2+plus)4 μL,2 U HS-Taq Ex 0.4 μL,25 mmol/L dNTP 0.32 μL,上游引物(667F1)终浓度0.2 μmol/L,下游引物(667R1)终浓度0.2 μmol/L;模版DNA 20 ng,反应40 μL。PCR条件:95 ℃ 5 min;95 ℃ 15 s,56 ℃ 40 s,72 ℃ 1 min,循环数 40;72 ℃ 5 min。用正反引物对PCR扩增产物进行双向测序。
1.3.3荧光定量PCR反应建立 在荧光PCR检测系统上进行。荧光PCR检测体系参考HS-Taq Ex酶说明书的组分浓度,在0.2~0.4 μmol/L范围内优化引物探针浓度,0.2~0.5 mmol/L范围内优化Mg2+浓度,0%~5%浓度范围内优化甘油浓度。最总选定PCR反应总体积为40 μL,包括终浓度1×PCR Buffer,0.05 U/μL 的HS-Taq Ex,UNG酶 0.2 μL,25 mmol/L dNTP(含dUTP)0.4 μL,4.5 mmol/L Mg2+,3%甘油,上、下游引物(667F2/667R2)各0.20 μmol/L,667T探针、667C探针各0.25 μmol/L;模版DNA 20 ng,ddH2O补足至40 μL。最佳反应条件的优化,主要在55~62 ℃优化退火温度。随着退火温度的提高(至62 ℃),荧光PCR体系可更好检测位点的野生型和突变型。随着退火温度进一步升高,荧光PCR检测信号降低。选定荧光PCR的退火温度为62 ℃。对比三步PCR方法(95 ℃ 5 min;95 ℃ 15 s,62 ℃ 40 s,72 ℃ 30 s,共40个循环)和两步PCR方法(95 ℃ 5 min;95 ℃ 15 s,62 ℃ 40 s,共40个循环),对相同样本检测的循环阈值(Ct值)差值(△Ct)在1以内。最终选定循环参数:95 ℃ 5 min;95 ℃ 15 s,62 ℃ 40 s,共40个循环,荧光PCR检测系统在62 ℃时收集荧光信号。
结果判读:将每个检测通道的Ct值记录为FAM通道和VIC通道。通过计算CtF与CtV差值的绝对值(△Ct=|CtF-CtV|)来判断基因型,△Ct=3.0为突变型和野生型的临界值。如杂合突变型时则△Ct<3.0;当△Ct>3.0时会出现两种情况:如纯合野生型则CtF 最低检测限确定:用Sanger测序法确定MTHFR 667位点野生型、纯合突变型和杂合型临床样本基因组DNA。依据高浓度梯度差距大,低浓度梯度逐步降低的原则选定测试浓度,稀释梯度分别为10、5、2.5和2倍,用缓冲液分别稀释至50.0、5.0、1.0、0.4和0.2 ng/μL作为验证灵敏度样本,重复检测每个浓度10次。 精密度确定:用Sanger测序法确定选定MTHFR 667位点野生型、纯合突变型和杂合型临床样本基因组DNA,用缓冲液稀释至5 ng/μL和1 ng/μL 2个浓度,用TaqMan荧光PCR试剂对上述样本进行检测,每个样本分别检测20次。以FAM通道和VIC通道Ct的变异系数小于5%为合格条件,统计2个通道的△Ct的结果。 临床验证:根据试验目的,选定300例临床样本用于验证本文建立的检测方法。验证流程包括:用外周血基因组DNA提取试剂盒提取纯化临床样本,基因组DNA浓度和纯度检测(P-330-31型微超微量分光光度计测定)。用TaqMan荧光PCR试剂检测样本基因组DNA。用Sanger测序法作为对照方法验证开发的TaqMan荧光PCR的检测准确度。 2.1最低检测限分析 根据实验结果初步选定本检测试剂的灵敏度是2 ng/反应的人基因组DNA。对野生型、纯合突变型和杂合突变型三种型别的样本,均稀释至该浓度(0.4 ng/μL)样本,分别重复检测20次,确定试剂盒的最低检测限是2 ng/反应。 见图1。 2.2精密度分析 FAM通道和VIC通道2个通道Ct值的变异系数均小于5%;纯合野生型和纯合突变型的△Ct变异系数较小(<12.00%);杂合突变型的变异系数较大(9.57%~54.55%)。原因是因为两种纯合型的2个通道△Ct较大而杂合突变型的2个通道△Ct较小。在检测结果的标准偏差相似的情况下,杂合突变型的△Ct变异系数远远大于纯合型。见表2。 2.3准确度分析 用荧光PCR方法检测300例临床样本的核苷酸类型,以测序结果为金标准,进行比对。荧光PCR检测结果如下:MTHFR 677 CC型155例,MTHFR 677 CT型96例,MTHFR 677 TT型49例。与核酸序列测定结果相比较,结果一致性为100%。见图2。 注:A表示MTHFR 667位点野生型样本检测结果;B表示MTHFR 667位点纯合突变型样本检测结果;C表示MTHFR 667位点杂合突变型样本检测结果 表2 MTHFR 667位点精密度检测结果 注:A表示MTHFR 667位点野生型样本检测结果;B表示MTHFR 667位点纯合突变型样本检测结果;C表示MTHFR 667位点杂合突变型样本检测结果 建立一种快速检测MTHFR 677位点的TaqMan荧光PCR方法。通过设计1对针对MTHFR 677位点多态性的两种TaqMan-MGB探针,用两种荧光染料分别标记两种检测探针,在1个PCR反应管中同时检测两种基因型。在PCR检测结束后,通过计算每个样本两种荧光探针对应的检测通道的△Ct的绝对值,并比较两个检测通道Ct值的大小,判定该位点的基因型[6]。由于检测位点只有1个碱基差异,碱基序列差异小,使用TaqMan-MGB探针可选择更短的探针,以便1个碱基的差异的Tm值差异更大,有利于提高检测的特异性。同样是由于两种探针对同1种检测靶序列只有1个碱基差异,实际上无法做到探针完全无交叉检测,所以本研究采用两种探针对应的检测通道的△Ct的绝对值来判断检测位点的基因型。因为非匹配靶标的探针即使能非特异结合待检测模版,但其匹配效率会远远低于和靶标完全匹配的探针的匹配效率,这就是采用△Ct判断基因型的理论依据。这种方法在肿瘤突变检测也是证实可行的[7]。 用建立的MTHFR 677位点检测方法,对300例临床样本进行检测,CT型(96例,占比32%)、TT型(49例,占比16.33%)和CC型(155例,占比51.67%),与报道不一致[8],这可能与选取样本的随机性有关。以Sanger测序方法为标准方法,用建立的TaqMan-MGB荧光PCR方法对该300例的检测结果和标准方法的结果完全一致。证实了本方法的准确度。 MTHFR多态性与众多临床疾病有相关性。MTHFR作为5,10-亚甲基四氢叶酸的代谢关键酶,与妊娠有着重要的相关性。有研究报道MTHFR与自然流产有关,C677T变突的MTHFR将使酶活性明显下降,降低MTHFR活力,叶酸代谢发生障碍,导致合成的5-甲基四氢叶酸减少,阻碍DNA甲基化传递,最终由于蛋白质及DNA甲基化不能满足胚胎的发育需求而引发流产[9]。MTHFR C677T突变与非综合性唇腭裂也有相关性[10]。张俊等[11]研究表明MTHFR C677T多态性与冠心病合并高血压患者有关联性[11]。T基因突变与冠脉病变程度具有相关性,携带T突变基因患者同型半胱氨酸水平和冠状动脉病变评分显著高于CC基因型的患者。由于MTHFR C677T多态性在临床上的应用广泛,众多的检测方法随之出现。TaqMan-MGB荧光探针法可以在1个反应管中检测两种基因型,具有操作简单,检测成本低,准确度高的优点。该检测方法的研究重点在于对两种基因型设计有足够大的退火温度的荧光标记探针,以便检测两种基因型模版的荧光信号有足够大的差异。同时,本研究使探针的浓度比例得到优化,使纯合型样本FAM通道和VIC通道的检测△Ct尽可能大,杂合型样本FAM通道和VIC通道的检测△Ct尽可能小。仍然存在不如人意的地方是2个检测通道△Ct的变异系数比较大,还需进一步改进。 建立的MTHFR基因多态荧光PCR检测方法具有很好的准确度和精密度,适用于临床精准预测脑卒中发生风险和预后及指导孕妇个体化补充叶酸。2 结 果
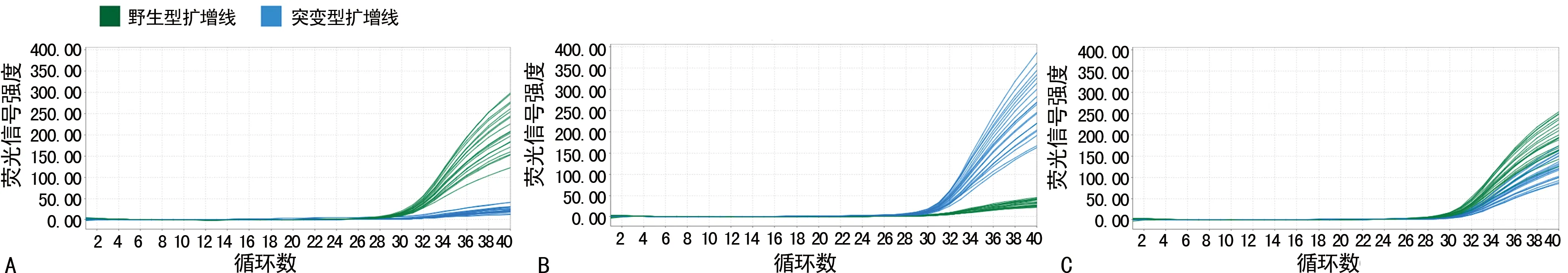
图1最低检测限浓度样本的检测结果
图2 MTHFR 677位点测序结果3 讨 论
4 结 论
