驻西非3例华人特殊疟疾病例诊疗体会
2019-11-14左曙青赵光宇郑俊杰陈威巍
涂 波,储 芳,许 彪,田 园,左曙青,赵光宇,郑俊杰,陈威巍
1 病例报告
1.1 病例1 患者,男性,50岁,因“发热、腹部不适5 d,腹泻1 d”于2019年8月2日来我国援塞拉利昂军事医学专家组就诊。患者2019年6月第二次来塞拉利昂经商,于7月28日出现发热,体温最高达38 ℃,无畏寒、寒战、大汗等,伴上腹部不适、食欲差,自行服用“感冒药”,效果不佳。发病前进食可疑不洁饮食。8月1日出现腹泻,为黄色稀水样便,无脓血便,自行服用2次泰诺,大汗明显,尿少,尿色深,未服用抗生素。
8月2日上午11:30就诊于我专家组,体温37.5 ℃,考虑“急性肠炎”,给予左氧氟沙星注射液静脉滴注及补液等治疗,患者自述不适症状好转,随后排尿200 ml。当日下午3:00检验结果回报:疟疾快速检测(rapid diagnostic test, RDT)阳性(恶性疟),血涂片镜检查见大量恶性疟原虫(原虫密度171 100/μl),见图1。血常规:白细胞计数5.9×109/L、中性粒细胞百分比80%、嗜酸细胞百分比0.70%、血红蛋白158 g/L、血小板计数12×109/L,肌酐223 μmol/L,丙氨酸氨基转移酶/天冬氨酸转氨酶 155/75 U/L,肥达试验O 1∶80/H 1∶160,考虑“疟疾合并肾功能不全、肝损害、血小板减少症,急性肠炎”,急诊收入院。入院查体:体温38℃,血压91/51 mmHg(1 mmHg=0.133 kPa),心率105次/min,呼吸22次/min,血氧饱和度(peripheral oxygen saturation, SpO2)95%(未吸氧),精神欠佳,神志清楚,应答切题,肠鸣音活跃(6次/min),腹软,无压痛、反跳痛,余未见明显阳性体征。入院诊断:①重症疟疾并急性肾功能不全、休克、肝损害、血小板减少症;②伤寒?入院后给予:左氧氟沙星抗细菌感染;青蒿琥酯抗疟疾(120 mg/次,分别于0 h、12 h、24 h、48 h、72 h注射,共5次);随后口服双氢青蒿素哌喹片(首剂2片,分别于8 h、24 h、32 h口服2片,共8片);异甘草酸镁和还原型谷胱甘肽保肝;同时积极补液、扩容、纠酸及能量支持治疗(给予生理盐水、乳酸钠林格液和羟乙基淀粉扩容,补液速度3~5 ml/(kg·h),先快后慢,根据患者尿量、血压、心率等指标酌情调整补液速度)。第2 d,复查血涂片找疟原虫(原虫密度135/μl),体温恢复并维持正常,血压90~105/48~72 mmHg,心率85~108次/min,SpO2(未吸氧)维持在95%以上,呼吸平稳。第3 d复查,肌酐441 μmol/L、尿酸619 μmol/L、尿素氮19.1 mmol/L、白蛋白26.4 g/L、丙氨酸氨基转移酶/天冬氨酸转氨酶89/48 U/L,血常规:白细胞计数6.4×109/L、中性粒细胞百分比81%、嗜酸细胞百分比0.91%、血红蛋白151 g/L、血小板计数43×109/L;涂片未查见疟原虫。随后,患者病情维持稳定,大多异常指标逐渐恢复正常;肌酐恢复较慢,在入院第6 d达到最高峰489 μmol/L后才逐渐恢复正常。入院第10 d,患者痊愈出院。出院诊断:①重症疟疾并急性肾功能不全、休克、肝损害、血小板减少症;②急性肠炎。
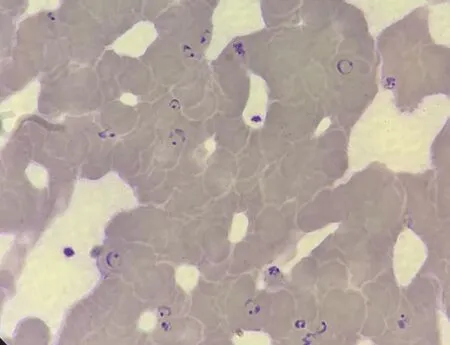
图1 病例1患者外周血涂片镜检(瑞-姬氏染色,×1000)Figure 1 Peripheral blood smear microscopy of case 1(Wright-Giemsa staining, ×1000)
1.2 病例2 患者,男性,26岁,因“发热、头痛1 d”于2019年9月3日来我专家组就诊。患者1年前来塞拉利昂做安保工作,于9月2日夜间出现发热,体温最高40.3 ℃,伴头痛,偶有干咳,无恶心、呕吐、畏寒、寒战、大汗、关节疼痛等不适。9月3日晨起体温正常,排黄稀便2次,无里急后重。测疟疾RDT [胶体金法,特异性恶性疟原虫乳酸脱氢酶(Plasmodium falciparum lactate dehydrogenase, pfLDH)/疟原虫乳酸脱氢酶(plasmodium pan-lactate dehydrogenase, panLDH),广州万孚生物技术有限公司]阴性,涂片未查见疟原虫。考虑为“感染性腹泻”,给予口服左氧氟沙星。当日夜间体温再次升至39.8 ℃,伴头痛明显,无恶心、呕吐等,自服退热药。9月4日再次就诊我专家组,查体未见异常,再次测疟疾RDT阴性,涂片未查见疟原虫。血常规:白细胞计数 3.2×109/L、中性粒细胞百分比58%、淋巴细胞百分比32.5%、嗜酸细胞百分比0.41%、血红蛋白 159 g/L,血小板计数 70×109/L、CD4细胞计数 179/μl,胸片未见异常,肥达试验O 1∶20/H 1∶40,不除外“伤寒”,继续给予左氧氟沙星治疗。此后3 d,患者仍每日夜间发热,体温最高达39.5 ℃,伴头痛、干咳;9月7日,再次复查疟疾RDT阴性,肝功能轻度异常,临床表现不除外疟疾,建议患者口服抗疟药,将左氧氟沙星换为头孢曲松,但患者未遵医嘱。9月8日自行就诊当地某医院,反复涂片镜检,查见疟原虫。我们再用疟疾RDT试剂复查,panLDH弱阳性,pfLDH阴性。随后用厚血膜涂片染色镜检查见少量疟原虫,再用薄血膜染色镜检,根据疟原虫不同发育阶段的形态特征判断为卵形疟原虫,见图2。参考文献[1]合成引物,并经巢式PCR得到验证,见图3。明确诊断“卵形疟”,口服双氢青蒿素哌喹片(首剂2片,8 h、24 h、32 h各口服2片,共8片);随后口服磷酸伯氨喹(1次/d,3片/次,连服8 d,共24片),痊愈。
1.3 病例3 患者,女性,40岁,因“反复发热、头痛12 d”于2019年9月16日来我专家组就诊。患者1年前来塞拉利昂从事美容行业,于9月4日出现发热,体温最高达39.8 ℃,伴头痛,发热以夜间为著,热退时出汗明显,自行就诊某诊所,疟疾RDT阳性(恶性疟),接受青蒿素及头孢类抗生素治疗8 d,体温逐渐恢复正常,头痛缓解;并于9月12日—14日期间口服青蒿素为基础的联合疗法(artemisinin-based combination therapies,ACTs)药物(商品名LONART,复方蒿甲醚-苯芴醇)。患者体温维持正常,因仍自觉乏力、食欲不佳就诊我专家组。查:疟疾RDT强阳性(panLDH阴性,pfLDH阳性),涂片可见疟原虫(1600/μl),遂建议再次服用ACTs抗疟治疗。患者自行服用2个疗程的ACTs,在服药期间曾一过性发热、头痛。9月23日再次就诊我专家组。查:疟疾RDT强阳性(恶性疟),涂片可见疟原虫(1200/μl),血常规及肝肾功能正常,给予静脉推注青蒿琥酯(120 mg/次,0 h、12 h、24 h,此后1次/d,直至血涂片找不到疟原虫)。此后患者体温再次恢复并维持正常,症状缓解,血红蛋白从110 g/L降至81 g/L,其余生化等指标正常。我们隔日复查1次涂片找疟原虫,直至10月7日(注射青蒿琥酯第14 d)涂片才首次未找到疟原虫,此后2 d连续进行血涂片均未找到疟原虫,遂停药青蒿琥酯,继续对患者进行随访。

图2 病例2患者外周血薄血片镜检(瑞-姬氏染色,×1000)A.箭头所示为卵形疟原虫环状体;B.箭头所示为卵形疟原虫大滋养体;C.箭头所示为卵形疟原虫裂殖体Figure 2 Peripheral blood smear microscopy of case 2 (Wright-Giemsa staining, ×1000)
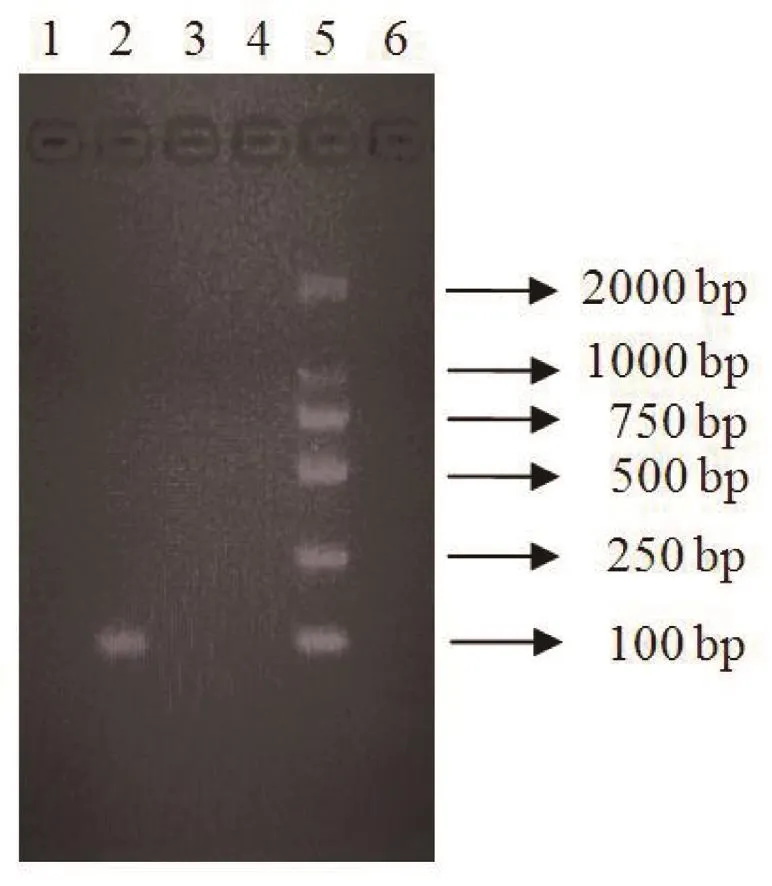
图3 病例2患者外周血卵形疟原虫特异性核酸片段巢式PCR产物电泳结果1.空白对照;2.病例2患者标本;3,4.已知恶性疟病例标本;5.DNA分子量Marker; 6.健康人标本Figure 3 Electrophoresis result of nested PCR products of peripheral blood plasmodium ovale-specific nucleic acid fragments in case 2
2 讨 论
疟疾是对全球健康影响最大的传染病,每年有超过2亿人感染,其中超过40万人因感染疟疾而死亡[2]。西非是疟疾的高流行地区,据地理前哨监测网(www.geosentinel.org)数据报道,塞拉利昂、利比里亚和几内亚3个西非国家的旅行者中,发病首位仍然是疟疾,占40.3%,其中恶性疟占86.0%,非恶性疟占14.0%[3]。近年我国在西非务工人员众多,很多人停留时间超过1年,疟疾也成为了威胁其健康的主要疾病。由于疟疾在当地非常普遍,加上医疗条件有限、经济非常落后,大多数当地人甚至部分外来务工者不会首选就医,而是选择自行随意口服抗疟药治疗。这种误打误撞的治疗会让部分人逐渐康复,比如对抗疟药敏感的疟疾患者和患普通感冒等自限性疾病者等。此外,来西非务工的人员多为青壮年,没有慢性基础疾病,对“感冒发烧”等普通疾病不重视,因而部分患者未能及时就诊,导致病情延误,甚至出现并发症,严重者死亡。另一方面,在疟疾治疗中不规范用药导致原虫清除延迟,甚至耐药变异,使治疗更加困难。我国消除疟疾进程顺利,绝大部分地区已无本地感染病例,虽然近年输入性病例增多,但我国医生对疟疾病例接触有限,临床诊治经验不足,容易漏诊误诊。这一点我们在对上述3例驻西非华人疟疾患者的诊治过程中体会颇深。
病例1患者近期出差至非洲,对疟疾的警惕性不够,在发病初期,发热伴消化道症状较明显,自行当作“感冒、肠炎”治疗。对疟疾的诊断和治疗的延误导致患者就诊时疟原虫密度已经高达171 100/μl并出现明显血压降低和急性肾功能不全等重症表现。按照《疟疾的诊断—中华人民共和国卫生行业标准WS 259-2015》[4],疟疾患者出现:昏迷、重度贫血(血红蛋白<5 g/dl,红细胞压积<15%)、急性肾功能衰竭(血清肌酐>265 μmol/L)、肺水肿或急性呼吸窘迫综合征、低血糖症(血糖<2.2 mmol/L或<40 mg/dl)、循环衰竭或休克(成人收缩压<70 mmHg,儿童收缩压<50 mmHg)、代谢性酸中毒(血浆碳酸氢盐<15 mmol/L)等一项或多项表现即为重症。该患者血清肌酐>265 μmol/L,明确诊断为重症疟疾。我们按照WHO对于重症疟疾的抗疟推荐进行治疗:静脉注射青蒿琥酯治疗成人疟疾患者至少24 h,直到他们可以耐受口服药物(ACTs治疗3 d)为止[5]。该患者对青蒿琥酯敏感性良好,治疗后疟原虫密度迅速下降,阻止了病情进一步恶化。对于重症疟疾,除了有效的抗疟治疗,恰当的支持治疗对患者预后至关重要。该患者由于进食差、腹泻、出汗等因素,体液丢失明显,并出现休克表现,此时合适的液体疗法是抗休克治疗的关键措施,但此疗法目前还缺乏业界广泛认可的共识。Nguyen等[6]对重症疟疾成人患者进行的一项回顾性研究表明,液体负荷对酸碱状态或肾功能衰竭无益。2015年,Aung等[7]在缅甸进行的一项观察性研究,报告了保守的液体治疗对重症恶性疟和间日疟相对更安全。因此,我们在积极进行抗休克治疗的同时,注意患者液体的管理,避免大量补液带来的不良后果。近期发表的一篇文章也支持了我们的做法。Ishioka等[8]通过一项前瞻性研究得出如下结论:在重症恶性疟疾成年患者的治疗中,限制性液体管理并没有使肾脏功能和组织灌注恶化;建议在第一个24 h内给予患者2~3 ml/(kg·h)的晶体液,除非患者血压低。此外,病例1患者合并急性腹泻也加重了其内环境的紊乱。由于患者处于伤寒流行地区、肥达试验阳性,且文献报道,疟疾和伤寒共感染的发病率为6.3%~36.2%[9-10],故我们在患者入院时初诊为“伤寒”。根据患者病情的演变,我们没有得到更多的支持伤寒诊断的依据,最终临床诊断为急性肠炎。值得一提的是,该患者血小板明显降低。血小板减少是疟疾患者的一个常见表现[11],间日疟患者中血小板减少者约占93.33%,恶性疟患者中血小板减少者约占71.87%。目前,疟疾患者血小板减少的机制尚未完全阐明。疟疾引起的炎症可能是导致血小板破坏或清除增多的原因[12],其中包括氧化应激反应、巨噬细胞集落刺激因子增加、IgG与血小板-疟疾抗原复合物的结合和脾功能亢进引起的血小板破坏等。最近的研究表明,血小板可以通过分泌血小板因子 4与被感染的红细胞接触而杀死疟原虫,其可能控制了循环系统中5%~60%的疟原虫的生长。存在于血小板-红细胞复合物上的血小板可能占了患者血小板总数的大部分,因此在很大程度上导致了患者血小板计数的减少[13]。这就解释了虽然血小板减少在疟疾患者中很常见,甚至血小板重度降低也并未造成该类患者严重出血的现象[14]。
病例2患者驻西非超过1年,由于疟疾和伤寒常常处于同一流行区,2者可出现类似的临床表现,结合其发热、腹泻、头痛,伴白细胞计数降低,且多次疟原虫检查阴性,我们在临床拟诊时首先考虑“伤寒”。但在左氧氟沙星、头孢曲松治疗效果不佳的情况下,须要考虑耐药伤寒和诊断错误等问题。所幸最终从患者血涂片找到疟原虫得以确诊,且同时疟疾RDT检测显示为除恶性疟之外的其他疟原虫阳性。由于非洲地区99.7%的疟原虫为恶性疟原虫[2],我们推测,如果患者为疟疾,在没有得到有效抗疟治疗的情况下,血中疟原虫密度会越来越高,反复检测疟原虫总会有所发现。在前期诊治中,我们对原虫密度低导致的检验结果假阴性及其他几种少见疟原虫认识不足,且患者未遵医嘱进行诊断性治疗,导致我们的拟诊方向偏离,以至于诊断延误5 d。临床表现不典型是导致早期误诊的常见原因,邹洋等[15]报道150例疟疾患者中,早期误诊22例(14.67%)。所幸卵形疟发病温和,患者病情进展缓慢。卵形疟原虫主要分布于西非、东南亚等国家的热带地区,是5种主要感染人体疟原虫中较为少见的疟原虫种[16-17]。卵形疟因其发病率低、临床症状相对较轻,容易被忽视。这也解释了患者虽然发病1周,在未进行抗疟治疗的情况下一般情况没有恶化。文献报道,疟疾RDT阴性的患者中涂片镜检阳性率为19.9%(95%CI:19.0%~20.9%);已知的出现假阴性RDT结果的原因还包括:操作错误、标本存储不当、疟原虫的pfhrp2/3基因缺失、RDT试剂性能不佳以及低疟原虫密度等[18]。根据本专家组检测使用的万孚公司RDT试剂说明书,该试剂检测灵敏度为97.44%,其中非恶性疟检测灵敏度为96.84%,疟原虫最低检出限100个/μl。而临床研究表明,该试剂的阳性预测值为98.18%,与镜检符合率为99.42%[19]。而对于卵形疟,该试剂盒的总体检出率仅为70.0%,特别是当疟原虫密度≤500个/μl时,检出率仅为27.3%[20]。虽然该试剂盒对卵形疟原虫的检测效果优于大部分同类产品,但试剂盒设计原理是检测疟原虫的panLDH浓度,当疟原虫密度低,panLDH相应浓度也低时,RDT试剂往往出现假阴性结果。镜检是疟原虫诊断金标准,但镜检效率受疟原虫密度和检验人员经验影响很大,当疟原虫密度<50个/μl时无法经过人工镜检发现,容易漏诊[21]。随着病程推移,血中疟原虫密度逐渐升高,最终被检测出来。另外,一旦确诊为卵形疟,就可能存在迟发型子孢子,因此根治治疗是必要的。但因为葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PD)缺乏者服用伯氨喹可发生急性溶血反应,根治治疗时须仔细询问有无蚕豆病及其他溶血性贫血的病史及家族史、有无G6PD缺乏及烟酰胺腺嘌呤二核苷酸还原酶缺乏等病史。一旦发生溶血应停药,并作适当的对症治疗。我们在给予该患者磷酸伯氨喹治疗之前,确认该患者并无蚕豆病及服用磺胺类药物后发生溶血等现象。
病例3患者涉及到青蒿素类抗疟药的疗效问题。该患者外周血查见恶性疟原虫,多次查血常规未提示合并细菌感染,且经抗疟疾治疗后病情得到控制,故恶性疟诊断明确。在前期治疗过程中,经过标准抗疟疾治疗,患者症状一度得到控制,但血涂片仍可见疟原虫。王冶等[22]曾报道,西非维和人员93例疟疾患者中,恶性疟占77.4%,只有30.0%发病,说明该现象较普遍。从临床角度看,青蒿素耐药性的金标准是在治疗过程中患者疟原虫清除的延迟;同时,这种耐药性预测也会受到宿主免疫反应的影响[23]。即使没有耐药性,由于疟原虫密度高,宿主免疫力低或药物剂量不足,都可能导致疟疾复发[24]。这种现象是由于疟原虫对青蒿素制剂敏感性降低所致,可以通过持续、高剂量的青蒿素制剂抗疟治疗来清除患者体内的疟原虫[25]。在青蒿琥酯控制患者症状后,双氢青蒿素哌喹片这一ACTs制剂可以有效清除大多数无症状患者体内的疟原虫,即使不能彻底清除,也不会诱导产生对双氢青蒿素和磷酸哌喹双重耐药的疟原虫株[26]。高琪[25]指出,临床医生治疗疟疾患者时,在遵循安全、有效、合理、规范原则的基础上,可根据感染的疟原虫种类和对抗疟药的敏感性以及患者的临床症状与体征,合理选择抗疟药物并调整剂量和疗程。因此,在反复应用ACTs制剂不能清除疟原虫的情况下,我们采取维持青蒿琥酯治疗的方法最终达到清除疟原虫的目的。
以上3个病例各有特点,加深了我们对疟疾诊治的认识。随着“一带一路”倡议的推动,我国对外医疗援助也越来越多,而我国医生对于非洲等地的热带传染病认识多有不足,除了应加强理论学习和实践之外,还应经常总结经验,吸取教训,为同行提供借鉴,最大限度地避免误诊漏诊和不规范治疗是我们每一个医务工作者的责任。
