髓源性抑制细胞在长期抗HBV治疗患者中促进HBsAg阴转的作用和机制探讨
2019-11-14田玉球王冰清肖新强蒋永芳
田玉球,王冰清,袁 婷,肖新强,李 伟,蒋永芳
目前治疗慢性乙型肝炎(chronic hepatitis B,CHB)的主要药物为干扰素与核苷酸类似物,但是只有部分患者能获得完全治愈,达到HBsAg清除。很多研究对HBsAg清除机制做了进一步探讨,认为宿主因素和病毒因素是2个重要方面,但并不能完全解释HBsAg清除机制以及清除率低的原因[1]。机体清除HBV主要靠溶细胞或者非溶细胞杀伤病毒感染的靶细胞,慢性HBV感染时,机体T细胞功能耗竭,特异性CTL不能有效清除病毒及HBsAg,而机体T细胞的功能也影响着HBsAg的清除[2]。
髓源性抑制细胞(myeloid-derived suppressor cells, MDSCs)是骨髓来源的一群异质性细胞,包括未成熟单核细胞、粒细胞、树突细胞以及未成熟髓系细胞前体,具有显著抑制免疫细胞应答的能力[3]。MDSCs表型为CD15+CD33+HLADR-MDSC者定义为中性粒髓源性抑制细胞(G-MDSC),表型为CD14+CD33+HLADR-MDSC者定义为单核髓源性抑制细胞(M-MDSC)[4]。MDSCs主要通过产生精氨酸酶1(arginase-1, Arg-1)、活性氧(reactive oxygen species, ROS)和诱导型一氧化氮合酶( inducible nitric oxide synthase, iNOS)3个主要途径发挥免疫抑制功能[5]。而ROS的生成与很多酶的参与有关,其中NADPH氧化酶这个多亚基构成的氧化酶是体内ROS生成的重要来源,其重要的胞质成分P47phox对激活NADPH氧化酶起到关键作用[6]。
有研究表明,MDSCs可以通过抑制患者免疫应答,促进乙型肝炎慢性化进程[7],但其机制尚不完全清楚。一些研究发现,HBV转基因鼠肝脏细胞中的MDSCs能抑制T细胞及HBsAg特异性淋巴细胞,乙型肝炎小鼠模型体内MDSCs水平是正常小鼠的2倍[5]。另有研究发现CHB患者外周血MDSCs水平与健康人不同[8]。此外有研究表明,CHB患者HBsAg水平与M-MDSC频率密切相关,且HBsAg可以通过(ERK)/IL-6信号途径促进M-MDSC的增加而抑制T细胞应答,使HBV感染慢性化[9]。由此可见MDSCs与CHB密切相关。
目前对CHB患者抗病毒治疗后MDSCs的变化的研究甚少。本研究选取抗病毒治疗的CHB患者,随访8年,研究抗病毒治疗后获得HBsAg清除及未清除患者外周血MDSCs、CD4+T细胞及CD8+T细胞等免疫细胞,肝功能,HBV DNA,HBsAg等指标以及外周血P47phox蛋白的变化,探究MDSCs与乙型肝炎慢性化及HBsAg清除的相关性,为乙型肝炎免疫治疗提供新思路。
1 对象与方法
1.1 对象 入选病例为2007年7月—2008年7月在中南大学湘雅二医院感染科收治的需要接受抗病毒治疗的CHB患者共80例,诊断符合《慢性乙型肝炎防治指南》[10]中的诊断标准。纳入标准:①年龄20~60岁;②HBsAg阳性且时间>6个月;③HBV DNA>104copies/ml;④ALT持续升高>2×正常值上限;⑤入组前6个月内未使用任何抗病毒药物或者免疫调节剂。排除标准:①合并其他肝病;②合并HIV、EBV等病毒重叠感染;③合并糖尿病、甲状腺功能亢进或者其他自身免疫性疾病;④合并肝癌或者其他肿瘤。统一予以入选患者口服抗病毒药物恩替卡韦(entecvavir, ETV)[商品名博路定,百时美施贵宝(中国)投资有限公司,批号1310668,规格0.5 mg/片],0.5 mg,1次/d,治疗8年。排除治疗过程中死亡、失访患者,本次试验最终筛选出72例CHB患者进入CHB组。所有病例均为成年患者,入组时年龄20~60岁,平均(35.90±11.82)岁。以健康志愿者14例纳入健康对照组,年龄20~60岁,平均(37.21±4.99)岁。2组年龄、性别差异无统计学意义,见表1。入组患者均在全面了解本研究的基础上签署知情同意书,研究方案经过中南大学湘雅二医院伦理委员会批准。
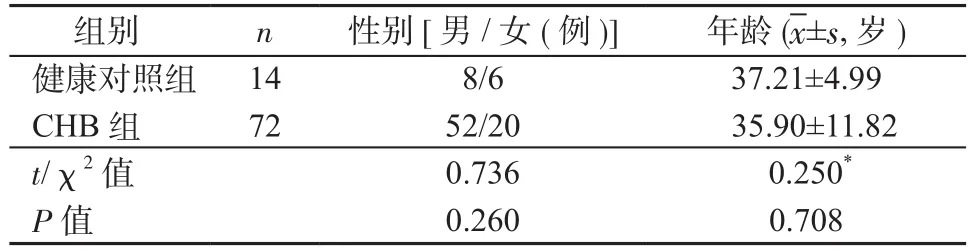
表1 研究对象的基本情况Table 1 Basic information of included subjects
1.2 试剂和仪器 FITC Mouse Anti-Human HLADR,PE Mouse Anti-HumanCDllb/Mac-1,APC Mouse Anti-HumanCD33,FITC Mouse Anti-HumanCD4,PE Mouse Anti-HumanCD8,Anti-HumanIgG1-APC均购自美国eBioscience公司;Ficoll淋巴细胞分离液购自GE HEAL THCARE公司;Passive lysis Buffer购自北京Promega公司;硝酸纤维素转印膜购自北京鼎国昌盛生物;P47phox抗体购自美国CST公司;羊抗兔IgG(H+L)HRP标记购自美国Santa Cruz公司。
流式细胞仪购自美国BD公司;电泳装置购自BIO RAD公司;BDS160电热恒温三用水箱购自北京医疗器械厂;TG-16-WS台式高速离心购自湘仪离心机仪器有限公司;TGL-16M高速台式冷冻离心机购自长沙平凡仪器;HISCL-5000购自希森美康医用电子有限公司。
1.3 方法
1.3.1 流式细胞检测 ①分别抽取健康对照者、治疗前CHB患者、抗病毒治疗8年后CHB患者外周静脉血1~2 ml(肝素抗凝)混匀后短暂保存,于6 h内处理所采集标本。②采用密度梯度法分离外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)。③通过流式细胞术检测MDSCs、CD4+T细胞、CD8+T细胞:取100 μl调整好浓度的细胞悬液至流式检测管中,流式检测管分为A大组与B大组,A组检测MDSCs的各检测管中加入各标记抗体 20 μl(FITC Mouse Anti-Human HLA-DR,PE Mouse Anti-HumanCDllb/Mac-1,APC Mouse Anti-HumanCD33);B组检测CD4+T细胞、CD8+T细胞的检测管中加入以下标记抗体各 20 μl(FITC Mouse Anti-HumanCD4,PE Mouse Anti-HumanCD8,Anti-HumanIgG1-APC)。混匀后避光4 ℃冰箱孵育20~30 min。孵育抗体结束后,每管加入冷的2 ml PBS洗液,在4 ℃下,1000 rpm离心5 min,弃上清。加入250 μl的1%多聚甲醛混匀固定后,避光,行流式细胞检查。
1.3.2 Western blot检测P47phox①选取健康对照者及抗病毒治疗8年后患者,抽取静脉血,分离取得PBMCs及血清标本用于检测。②提取总蛋白。③离心、测定蛋白浓度:离心机调整转速为12 000×g,4 ℃离心5 min,取上清用蛋白定量试剂盒测定总蛋白浓度。④等量蛋白样本电泳结束后转移至硝酸纤维素转印膜。以兔抗人P47phox抗体为一抗,HRP标记的山羊抗兔IgG为二抗,采用Western blot检测目的蛋白杂交条带。β-actin为内参。
1.4 统计学处理 应用SPSS 17.0软件包处理数据,计量资料呈正态分布,以±s表示,2组间比较用成组t检验(组间方差齐)。2组计数资料比较用四格表χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CHB患者抗病毒治疗8年后肝功能情况 抗病毒治疗8年后将CHB患者分为HBsAg阴转组[HBsAg(-)组]、HBsAg(+)DNA(+)组、HBsAg(+)DNA(-)组,3组ALT、ALB、TBIL水平见表2。
表2 抗病毒治疗后CHB患者肝功能情况(±s)Table 2 Liver function of CHB patients after antiviral treatment(±s)

表2 抗病毒治疗后CHB患者肝功能情况(±s)Table 2 Liver function of CHB patients after antiviral treatment(±s)
组别 n ALT(U/L) ALB(g/L)TBIL(μmmol/L)HBsAg(-)组 8 22.08±9.33 37.67±5.89 13.10±5.20 HBsAg(+)DNA(-)组 56 27.48±14.69 34.62±7.02 15.62±6.30 HBsAg(+)DNA(+)组 8 30.94±14.62 33.65±4.50 16.27±6.83
2.2 抗病毒治疗前CHB患者及健康对照者外周血MDSCs、CD4+T细胞、CD8+T细胞的频率 抗病毒治疗前从CHB患者中随机抽取12例患者,取这12例患者与14例健康对照者静脉血,采用流式细胞术检测PBMCs中MDSCs、CD4+T细胞、CD8+T细胞频率。检测结果见表3,治疗前CHB患者PBMCs中MDSCs频率显著高于健康对照者(P<0.05),而PBMCs中CD4+T细胞、CD8+T细胞频率与健康对照者无显著差异(P均>0.05)。
表3 抗病毒治疗前CHB患者及健康对照者外周血MDSCs、CD4+ T细胞、CD8+ T细胞的频率(±s,%)Table 3 Frequency of MDSCs, CD4+ T cells and CD8+ T cells in peripheral blood of CHB patients before treatment and healthy control subjects(±s, %)

表3 抗病毒治疗前CHB患者及健康对照者外周血MDSCs、CD4+ T细胞、CD8+ T细胞的频率(±s,%)Table 3 Frequency of MDSCs, CD4+ T cells and CD8+ T cells in peripheral blood of CHB patients before treatment and healthy control subjects(±s, %)
组别 n MDSCs CD4+ T细胞 CD8+ T细胞治疗前 CHB 组 12 1.73±1.73 27.96±4.50 24.50±6.64健康对照组 14 0.35±0.18 27.60±5.40 25.47±5.90 t值 2.982 0.447 0.364 P值 0.007 0.560 0.720
2.3 抗病毒治疗后不同HBsAg状态CHB患者PBMCs中MDSCs、CD4+T细 胞、CD8+T细 胞频率 抗病毒治疗后CHB患者中HBsAg(-)组MDSCs频率显著低于HBsAg(+)组(P<0.05),HBsAg(-)组PBMCs中CD4+T细胞和CD8+T细胞频率高于HBsAg(+)组(P均<0.05),见表4。
表4 抗病毒治疗后不同HBsAg 状态CHB患者PBMCs中MDSCs、CD4+ T细胞、CD8+ T细胞频率(±s,%)Table 4 Frequency of MDSCs, CD4+ T cells and CD8+ T cells in PBMCs of CHB patients with different HBsAg conditions after antiviral treatment(±s, %)

表4 抗病毒治疗后不同HBsAg 状态CHB患者PBMCs中MDSCs、CD4+ T细胞、CD8+ T细胞频率(±s,%)Table 4 Frequency of MDSCs, CD4+ T cells and CD8+ T cells in PBMCs of CHB patients with different HBsAg conditions after antiviral treatment(±s, %)
组别 n MDSCs CD4+ T细胞 CD8+ T细 胞HBsAg(-)组 8 0.23±0.08 31.24±8.56 26.30±5.90 HBsAg(+)组 64 0.64±0.61 22.63±5.86 19.49±6.58 t值 3.300 2.682 0.787 P值 0.031 0.009 0.007
2.4 抗病毒治疗后DNA(+)组与DNA(-)组MDSCs频率 将抗病毒治疗后HBsAg(+)CHB患者根据HBV DNA状态再分为HBsAg(+)DNA(-)组及 HBsAg(+)DNA(+)组,2组患者PBMCs中MDSCs频率相比,差异无统计学意义(P>0.05),见表5。
表5 抗病毒治疗后DNA(+)组与DNA(-)组MDSCs频率(±s,%)Table 5 Frequency of MDSCs in patients with DNA(+)and DNA(-) after antiviral treatment(±s, %)

表5 抗病毒治疗后DNA(+)组与DNA(-)组MDSCs频率(±s,%)Table 5 Frequency of MDSCs in patients with DNA(+)and DNA(-) after antiviral treatment(±s, %)
组别 n MDSCs HBsAg(+)DNA(-) 56 0.64±0.64 HBsAg(+)DNA(+) 8 0.75±0.35 t值 3.370 P值 0.920
2.5 抗病毒治疗后不同HBsAg状态CHB患者P47phox蛋白相对表达量 抗病毒治疗后CHB患者与同期健康对照者外周血P47phox的Western blot结果:HBsAg(-)组患者与健康对照者相比P47phox蛋白表达量无显著差异(t=2.115,P=0.187),HBsAg(+)组患者与健康对照者相比,P47phox蛋白表达量显著升高(t=5.319,P=0.006),HBsAg(+)组患者较HBsAg(-)组P47phox蛋白表达量显著升高(t=2.847,P=0.029),见图1、图2。

图1 抗病毒治疗后 HBsAg(+)组、HBsAg(-)组P47phox蛋白相对表达量Figure 1 Expression of P47phox protein in HBsAg(+) group and HBsAg(-) group after antiviral treatment
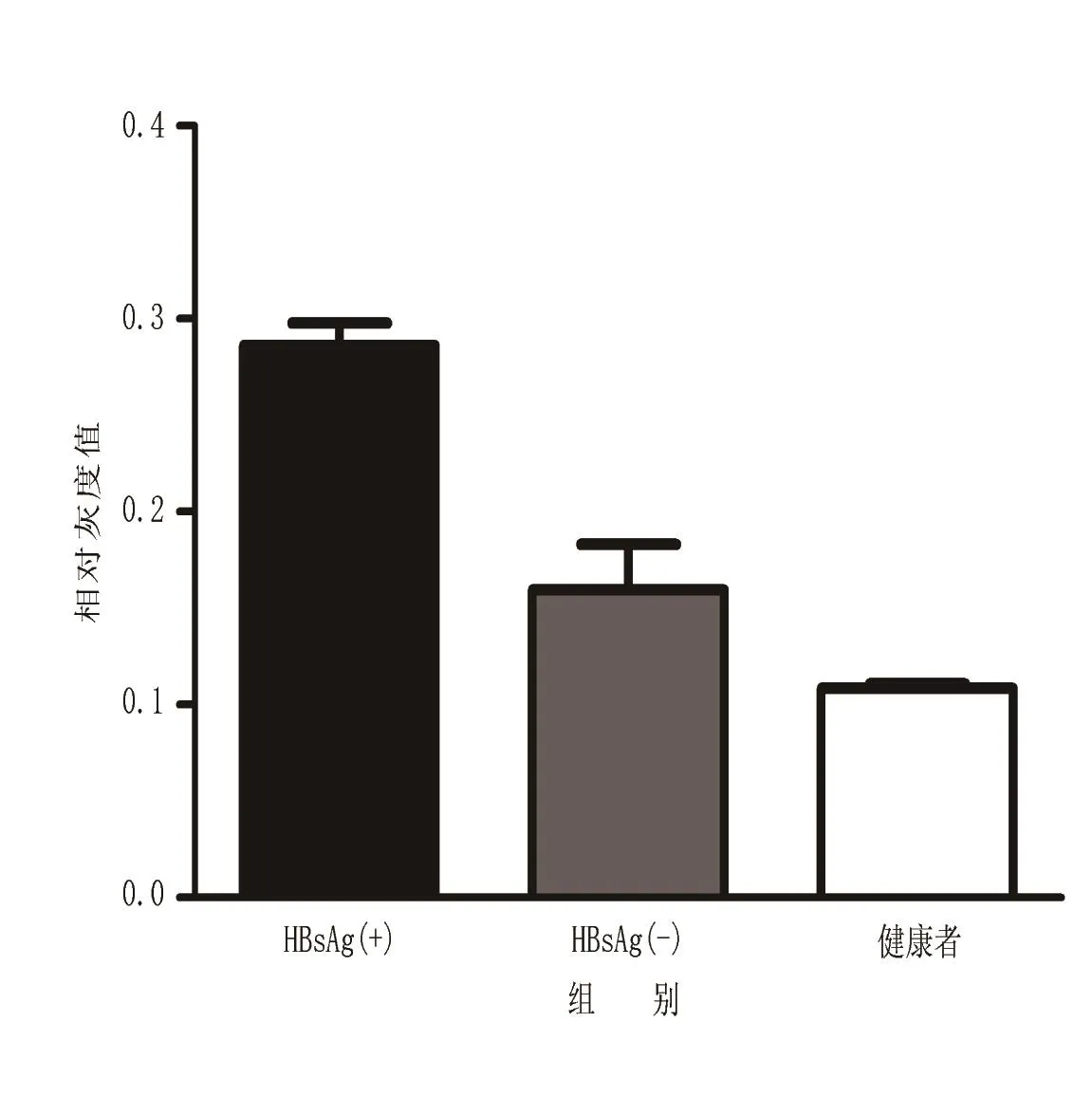
图2 抗病毒治疗后HBsAg(+)组、HBsAg(-)组P47phox蛋白相对表达量Figure 2 Relative expression of P47phox protein in HBsAg(+) group and HBsAg(-) group after antiviral treatment
3 讨 论
1970年代末,人们在肿瘤小鼠的脾脏、骨髓、淋巴组织中发现了MDSCs这群具有在体内及体外抑制T细胞功能的细胞,至今发现其在肿瘤、艾滋病、慢性丙型肝炎等疾病中都起重要作用[11]。机体清除HBV主要靠溶细胞或者非溶细胞杀伤病毒感染的靶细胞作用,慢性HBV感染时,机体T细胞(CD4+T细胞和CD8+T细胞)功能耗竭,特异性CTL不能有效清除病毒,引起肝炎慢性化,外周血T细胞水平发生变化[12],而作为有抑制T细胞功能的MDSCs是否参与这个过程仍未知。
近年来有研究发现,CHB患者4个阶段外周血中MDSCs频率与健康人有显著不同,对比45例CHB患者与15例健康人外周血MDSCs频率,MDSCs在CHB患者外周血中有更高表达[8]。本研究中,抗病毒治疗前患者外周血MDSCs频率较健康对照者高也证实了这一结果,提示CHB患者T细胞功能衰竭可能与MDSCs抑制T细胞相关。本研究结果还显示抗病毒治疗前患者外周血CD4+T细胞、CD8+T细胞频率与健康人无显著差异,这与Choong等[13]的研究结果不同,该研究提示CHB患者外周血T细胞亚群存在频率失衡,CD8+T细胞频率增加,CD4+T细胞频率及CD4/CD8下降。这种差异可能与本研究中抗病毒治疗前患者进行MDSCs检测人数较少有关。
HBsAg作为HBV感染的标志,其滴度水平可以预测临床治疗效果,获得HBsAg阴转是CHB临床治愈的标志。影响HBsAg清除的因素有很多,目前的抗病毒治疗主要为干扰素和核苷酸类似物,其抗病毒治疗过程中HBsAg清除率仅为0%~8%[14],仅少部分患者能获得HBsAg的清除。梁敏锋[15]在比较隐匿性HBV感染和抗病毒治疗HBsAg清除者细胞免疫应答特点中发现,抗病毒治疗后HBsAg清除主要以HBV核心抗原诱导为主,其由特异性分泌IFN-γ的CD4+T细胞、CD8+T细胞参与,可见细胞免疫与HBsAg清除有关。目前关于抗病毒治疗后细胞免疫的研究主要是针对CD4+T细胞、CD8+T细胞,对抗病毒治疗HBsAg阴转后细胞免疫研究仍较少。孟存仁等[16]对拉米夫定抗病毒治疗后乙型肝炎患者T细胞状态进行研究,发现抗病毒治疗6个月后HBV DNA水平较低的患者外周血CD4+T细胞、CD8+T细胞水平高于12个月转归和无转归组,而CD4/CD8则相反。李雪芬等[17]研究表明,在抗病毒治疗后,随时间推移及病毒复制的控制,患者CD4+T细胞水平、CD4/CD8逐渐升高。赵晓春等[18]研究也表明抗病毒治疗后,T细胞亚群的失衡得到显著改善。相关研究最长进程为1年,关于是否随着抗病毒治疗进程的延长T细胞亚群有新的变化的研究很少。本文对抗病毒治疗8年后HBsAg(+)组及HBsAg(-)组外周血CD4+T细胞、CD8+T细胞、MDSCs频率进行测定,发现HBsAg(-)患者外周血CD4+T细胞、CD8+T细胞频率显著高于HBsAg(+)患者,而HBsAg(-)患者外周血MDSCs频率显著低于HBsAg(+)患者,提示HBsAg(-)患者可能通过降低MDSCs减弱对T细胞抑制从而促进HBsAg的清除。
MDSCs主要通过Arg-1、iNOS和ROS途径发挥免疫抑制功能,ROS途径主要是通过NADPH氧化酶激活而抑制T细胞,促进INF-γ的产生,NADPH氧化酶是ROS的激活中关键的酶,而P47phox在NADPH氧化酶的激活中起到关键作用。本研究发现HBsAg(+)组较HBsAg(-)组P47phox表达水平高,说明HBsAg(+)患者体内ROS途径较强,对T细胞的抑制作用相对较强,从而抑制HBsAg的清除,由此表明MDSCs能通过ROS途径抑制T细胞,导致HBsAg不能清除。
本研究仍有一些不足,对于HBsAg清除者的研究仅仅是8年治疗终点的研究,治疗前与抗病毒治疗过程中的相关研究未能完善,对于治疗过程中其免疫应答特点动态分析较少。在以后研究中,对MDSCs、CD4+T细胞、CD8+T细胞与各个时期HBsAg、HBV DNA、HBeAg水平以及肝功能相关性分析,可能能获得更多抗病毒治疗过程中免疫调节途径,从而获取HBsAg清除的更多机制。
