响应面法优化藜麦种子黄酮的超声波辅助提取工艺
2019-11-14吴雅露陈琪陈梦涛应鹏飞蒋玉蓉陆国权
吴雅露,陈琪,陈梦涛,应鹏飞,蒋玉蓉,陆国权
(浙江农林大学农业与食品科学学院,浙江杭州311300)
藜麦(Chenopodium quinoa Wild.),又称南美藜、藜谷等,是一种一年生的藜科草本作物[1]。它是联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)推荐的唯一的单体植物就可以满足人体全部基本物质需求的完美全营养食品[2],其蛋白质含量很高,富含不饱和脂肪酸、类黄酮等多种有益化合物,被誉为“粮食之母”、“未来的超级谷物”、“营养黄金”、“有机谷类之王”等[3-4]。黄酮类化合物是植物中重要的次生代谢产物之一,是一种生理活性活泼的物质,具有抗病毒、抗癌防癌、防治动脉粥硬化、降血压、血脂及胆固醇等药理作用[5-7],其中对糖尿病的治疗效果明显[8]。然而目前有关藜麦种子黄酮类化合物的研究报道尚少。
藜麦种子黄酮具有较强的清除自由基、抗氧化等功效[9],研究与开发前景广阔。目前关于藜麦种子黄酮的提取方法有乙醇回流提取[10-11]、超声辅助提取[12-13]、微波辅助提取[14-16]等。响应面方法是通过部分因子试验找出重要因子,然后应用最陡爬坡路径方法逼近最大响应面区域,最后通过中心组合设计试验找到最优组合[17]。与传统的直线回归分析方法相比,它具有分析多因素的能力;与正交试验设计方法相比,它能找到试验设定值之间的最佳组合[18]。本研究采用响应面分析法[19-21],在提取时间、超声功率、提取温度3 个单因素试验的基础上,以总黄酮得率为评价指标,对超声波辅助提取藜麦种子总黄酮的工艺进行优化,并与乙醇热回流工艺比较,为藜麦黄酮类物质的开发利用提供理论依据。探索最佳提取工艺条件和最佳纯化工艺条件,进而提高黄酮产量,为多种疾病的治疗与预防提供一定的物质保障。
1 材料和方法
1.1 材料和试剂
藜麦Temuco 品种干燥种子:浙江农林大学提供,粉碎机充分粉碎,过0.5 mm 孔筛筛选,装入干燥器皿中备用。
芦丁对照品:国药集团化学试剂有限公司;亚硝酸钠、硝酸铝、氢氧化钠、乙醇:均为国产分析纯,生工生物工程(上海)股份有限公司。
1.2 仪器和设备
TP-214 电子天平:丹佛仪器有限公司;XMTD-6000恒温水浴锅:上海申胜生物技术有限公司;TDL-40B台式离心机:上海安亭科学仪器厂;752PC 紫外可见分光光度计:上海光谱仪器有限公司;JAC-600 超声波中药处理机:山东济宁超声电器有限公司。
1.3 试验方法
1.3.1 黄酮的提取
1.3.1.1 超声波辅助提取
依照超声波辅助提取黄酮的方法[12-13],设计藜麦黄酮提取的工艺流程:称取0.5 g 干燥粉末→超声波辅助乙醇提取→离心分离→过滤→浓缩→定容棕色容量瓶→避光保存备用。
1.3.1.2 热回流提取
依照热回流提取黄酮的方法[10-11],设计藜麦黄酮提取的工艺流程:称取0.5 g 干燥粉末→浸提剂浸泡→热回流提取→冷却→过滤→浓缩→定容棕色容量瓶→避光保存备用。
1.3.2 黄酮量的测定
本研究用比色法测定藜麦总黄酮含量[22]。准确称取芦丁标准试剂5.000 mg,用60%乙醇完全溶解后定容至50 mL,摇匀的浓度为0.1 mg/mL 的芦丁标准溶液。分别吸取芦丁标准溶液 0.0、1.0、2.0、3.0、4.0、5.0 mL 于6只10 mL 刻度试管中,用60%乙醇补至5.0 mL,加入0.3 mL 5%亚硝酸钠溶液,摇匀,放置6 min 后加入0.3 mL10 %硝酸铝溶液,放置6 min,再加入4.0 mL 1 mol/L 氢氧化钠溶液,混匀,再加0.4 mL 60%的乙醇,室温(20 ℃左右)放置 15 min 后于波长 501 nm 处测定其吸光度,以60%乙醇溶液为空白对照,建立测定标准曲线和线性回归方程。芦丁在0~50 μg/mL 浓度范围内,以吸光值(y)为纵坐标,芦丁标准品质量浓度(x)为横坐标,绘制标准曲线,得到回归方程:y=13.771x-0.013 6(R2=0.998 0)。该结果表明芦丁在该浓度范围内吸光值与浓度之间存在良好的线性关系。测定总黄酮含量时,以不同的样品液代替芦丁标准溶液,其他步骤与制作芦丁标准方程相同。计算公式如下:
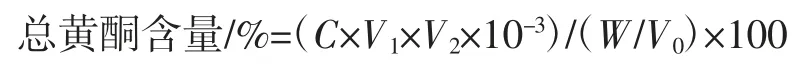
式中:C 为测定样液的浓度,mg/mL;V0为测定吸光度所用样液的体积,mL;V1为测定时稀释体积,mL;V2为样液定容后体积,mL;W 为样品质量,g。
1.3.3 单因素试验
1.3.3.1 提取时间对总黄酮含量提取的影响
在提取温度为60 ℃,超声波功率为60 W 条件下,分别提取 25、35、45、55 min,进行总黄酮含量测定,分析提取时间对提取藜麦种子总黄酮含量的影响。
1.3.3.2 超声波功率对总黄酮含量提取的影响
在提取温度为60 ℃的条件下,超声功率分别为30、40、50、60 W 时,提取 35 min,进行总黄酮含量测定,分析超声功率对提取藜麦种子总黄酮含量的影响。
1.3.3.3 提取温度对总黄酮含量提取的影响
在超声波功率为60 W 的条件下,提取温度分别为 50、60、70、80 ℃时,提取 35 min,进行总黄酮含量测定,提取温度对提取藜麦种子总黄酮含量的影响。
1.3.4 响应面试验
根据单因素试验结果,以提取时间(X1)、超声波功率(X2)、提取温度(X3)3 个因素为自变量,将各自最优条件的范围编码为-1、0、1,并以总黄酮含量为指标设计出17 组响应面试验。通过Design Expert8.0 软件对试验数据进行回归分析,得到藜麦种子总黄酮提取的最优工艺参数。中心组合试验的因子及编码值见表1。

表1 中心组合试验的因子及编码值Table 1 Factors and encoding values of central composite test
1.3.5 数据分析
采用Microsoft Excel 2007 软件分析整理数据,计算标准误差并制图分析;采用Design Expert8.0 软件设计响应面试验方案,建立模型并进行多元回归分析。每个试验均重复3 次。
2 结果与分析
2.1 总黄酮含量的单因素试验
2.1.1 提取时间对总黄酮含量的影响
在温度为60 ℃,超声波功率为60 W 的条件下,考察不同提取时间对总黄酮含量的影响,见图1。

图1 提取时间对总黄酮含量的影响Fig.1 Effect of extraction time on total flavonoids content
结果表明,总黄酮含量随提取时间的增加呈现先上升后下降的趋势,提取时间在35 min 时总黄酮含量达到最大值。推测原因在于随着提取时间的增加,到达35 min 时,藜麦种子内的黄酮已被全部提取出,但随着提取时间的继续延长,黄酮类物质可能发生降解[23],反而导致总黄酮含量下降。故确定提取时间最佳为35 min。
2.1.2 超声波功率对总黄酮含量的影响
在温度为60 ℃,提取时间为35 min 的条件下,考察不同超声波功率对总黄酮含量的影响,见图2。
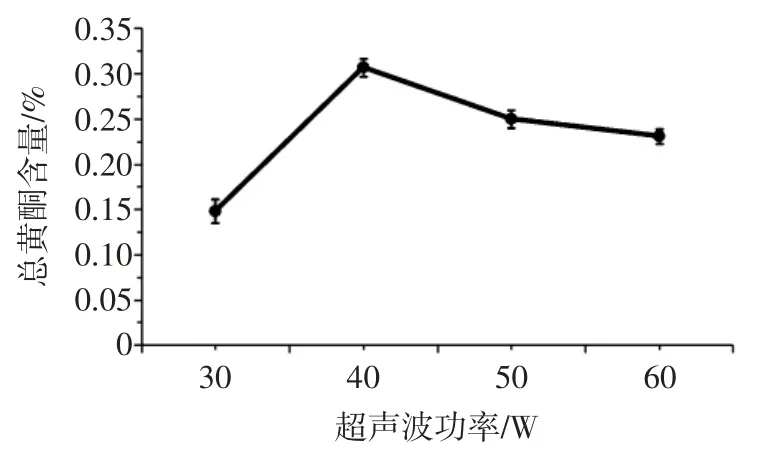
图2 超声波功率对总黄酮含量的影响Fig.2 Effect of ultrasonic power on total flavonoids content
结果表明,总黄酮含量随着功率的提高而逐渐增大,在超声波功率为40 W 时总黄酮含量达到最高值。而随着超声波功率进一步增加,总黄酮含量呈现下降趋势。超声波辅助乙醇提取的方法依赖于液体的空化作用,超声波功率的增加可导致其空化效应的增强[24],加速溶剂进入藜麦种子粉末的内部,促进黄酮物质的浸出。但当超声波功率过大时,超声瞬时热效应明显,过高的温度可能导致黄酮类物质分解或者被氧化,总黄酮含量降低。故确定超声波功率最佳为40 W。
2.1.3 温度对总黄酮含量的影响
在提取时间为35 min,超声波功率为60 W 的条件下,考察不同温度对总黄酮含量的影响,见图3。
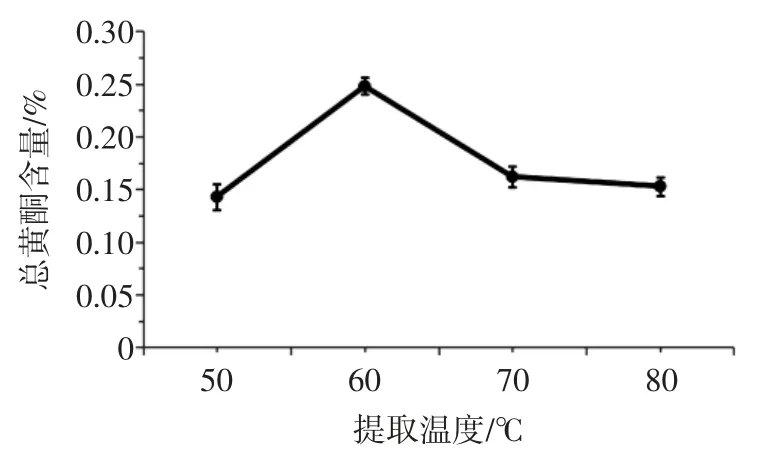
图3 温度对总黄酮含量的影响Fig.3 Effect of temperature on the content of total flavonoids
结果表明,总黄酮含量随温度的增加呈现先上升后下降的趋势,温度在60 ℃时总黄酮含量达到最大值。是因为一定程度的温度增加,可以使物质的溶解度增大,增加黄酮类物质分子和溶剂分子的碰撞机会,提高其溶出率。但是温度过高会导致溶剂汽化,破坏黄酮类物质的结构,反而降低总黄酮含量。故确定最佳提取温度为60 ℃。
2.2 响应面分析法优化提取条件结果分析
2.2.1 工艺参数优化
采用Box-Benhnken 中心组合试验设计,根据单因素结果,以提取时间35 min(X1)、超声波功率40 W(X2)和提取温度 60 ℃(X3)为中心点,用响应面分析方法进行三因素三水平优化试验,中心试验设计及试验结果见表2。
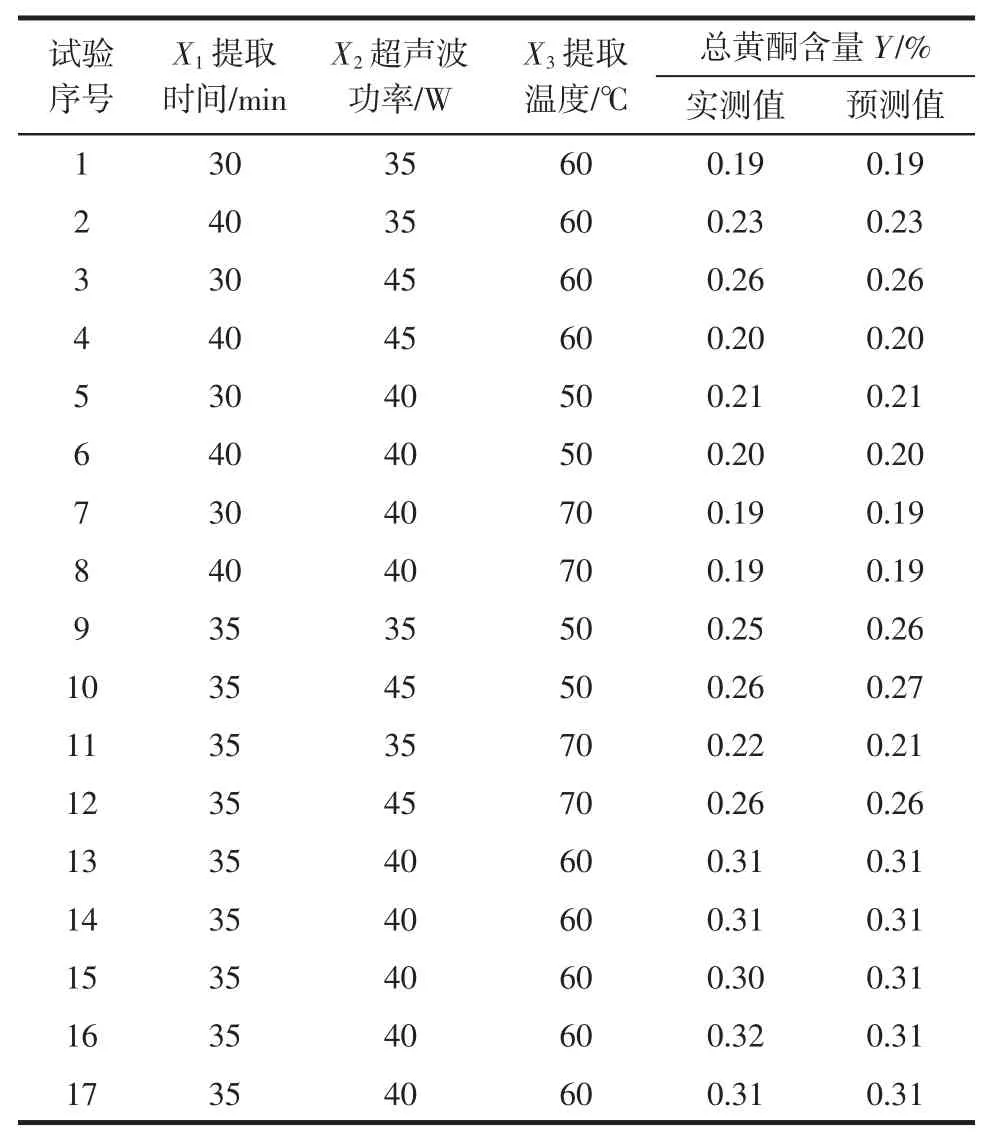
表2 中心试验设计及试验结果Table 2 Center test design and test results
以总黄酮含量Y 为响应值,利用Design Expert 8.0软件进行回归拟合,得到总黄酮含量预测值对编码自变量的回归方程:
总黄酮含量 Y=0.31-3.750×10-3X1+1.125×10-2X2-7.5×10-3X3-2.5×10-2X1X2+7.5×10-3X2X3+2.5×10-3X1X3-7×10-2X12-2×10-2X22-4.25×10-2X32
对该模型进行显著性方差分析,分析结果见表3。

表3 回归模型的方差分析Table 3 Variance Analysis of regression model
从表3 可以看出,该模型决定系数为R2=99.39%,调整后系数R2Adj=98.61%,说明模型能解释98.61%响应值的变化[25],模型的P 值为<0.000 1,说明模型的回归极显著;失拟项的P 值为0.913 6,不显著,说明该模型与实际情况拟合极好,试验误差小。因素一次项X2、X3,交互项 X1X2和二次项 X12、X22、X32对总黄酮含量的影响是极显著(P<0.01)的,交互项X2X3对总黄酮含量有显著影响(0.01<P<0.05),因素一次项X1和交互项X1X3对结果影响不显著(P>0.05)。可以由 F 值推测得出各因素的主效关系:超声波功率(X2)>提取温度(X3)>提取时间(X1)。
2.2.2 响应曲面试验结果分析
为了更直观地表现两因素间的交互作用对总黄酮含量提取的影响,根据提取时间、超声波功率和提取温度影响的藜麦种子总黄酮含量,控制某一因素不变,改变另外两个因素,绘制响应面图和等高线图,见图4~图 6。

图4 超声波功率、提取时间对总黄酮含量的响应面图和等高线图Fig.4 Response surface and contour map of total flavonoids content by ultrasonic power and extraction time
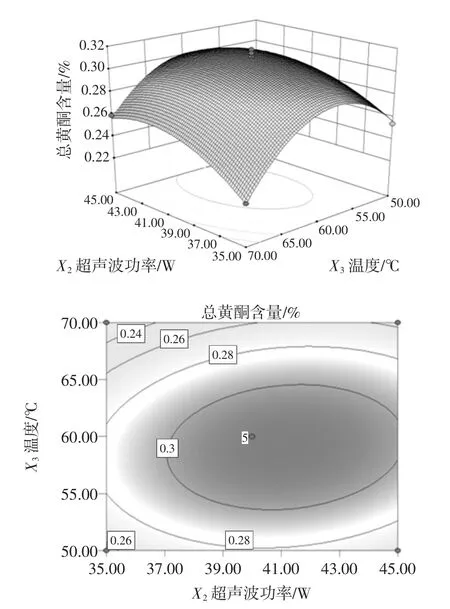
图5 温度、超声波功率对总黄酮含量的响应面图和等高线图Fig.5 Response surface and contour map of total flavonoids content of temperature and ultrasonic power

图6 温度、提取时间对总黄酮含量的响应面图和等高线图Fig.6 Response surface and contour map of total flavonoids content in temperature and extraction time
两两因素间的交互作用对响应值影响水平可由等高线的形状来确定,椭圆形表明两因素交互作用显著,圆形则为交互作用不显著[26]。由图4 和图5 可知,提取时间和超声波功率两因素之间,提取温度和超声波功率之间交互作用显著;由图6 可知,提取温度和提取时间之间交互作用不明显。由图4~图6 可知,响应面开口向下。随着每个因素的增大,响应值增大,当响应值增大到极值后,随着因素的增大,响应值逐渐减小。该模型有稳定点,且稳定点是最大值。等高线图中的曲线都是随着响应面的增加而形成一个顶点,也就是最佳提取量。
为确定最佳提取量,将回归方程求偏导,取值为零,得到如下三元一次方程组:

求解得 X1=-0.086;X2=0.323;X3=-0.062,分析该模型得到总黄酮含量最佳条件为提取时间34.57 min,超声波功率41.62 W 和提取温度59.37 ℃,在此条件下藜麦种子总黄酮含量的理论值可达0.3122%。由于实际操作的局限性,修正理论值为提取时间35 min,超声波功率42 W,提取温度59 ℃。在修正后的条件下进行3次重复的验证试验,结果总黄酮含量为0.31 %,与理论值相近,证明该模型能准确预测藜麦种子总黄酮含量。
2.3 超声波辅助提取黄酮与热回流提取黄酮方法效率比较结果
超声波辅助提取黄酮与热回流提取黄酮方法效率比较结果,见表4。

表4 黄酮总量超声波辅助提取与热回流提取比较Table 4 Ultrasonic assist extraction of total flavonoids and comparison of hot reflux extraction
超声波辅助提取总体水平比热回流法提取效率高。超声波辅助提取法提取最适条件为提声波功率为42 W,提取温度59 ℃,提取时间35 min,此条件下平均提取含量为0.31%;热回流法提取最适条件为提取温度59 ℃,超声波功率0 W,提取时间35 min,此条件下平均提取含量为0.26%。相比较而言,超声波辅助提取法的平均提取量为热回流法的1.19 倍。
用超声波辅助提取法种子中的黄酮类化合物优于用热回流提取法提取黄酮类化合物,分析原因可能是超声波辅助提取法比热回流法更能快速促进藜麦种子细胞中黄酮类成分的溶出。
3 结论
本试验采用响应面分析法优化藜麦种子总黄酮含量的最佳提取工艺,由方差分析得出超声波功率对藜麦种子提取的总黄酮含量的影响最大,提取温度次之,提取时间最小。得出其最佳工艺条件为:提取时间35 min、超声波功率42 W 和提取温度为59 ℃,在此条件下,总黄酮含量可达0.31%。与热回流提取黄酮方法相比较,同等提取温度和提取时间的情况下,超声波提取黄酮法有明显优势,平均提取含量可达热回流法的1.19 倍。表明超声波可以增加溶剂分子与物质分子的接触,促进提取物黄酮的溶出,增加提取藜麦种子的总黄酮含量,提高提取效率。
本试验可以在一定程度上提高藜麦黄酮的提取率,增加其产量,以促进藜麦黄酮类物质的开发利用,为多种黄酮类药物和保健品的生产提供一定的物质保障。
