酱油渣中副干酪乳杆菌的分离鉴定及抗氧化特性研究
2019-11-14唐素婷区锡敏黄桂东程云辉蔡逸夫杨晓萍钟先锋
唐素婷 区锡敏 黄桂东 程云辉 蔡逸夫 杨晓萍 银 波 张 灿 钟先锋
(1. 佛山科学技术学院食品科学与工程学院,广东 佛山 528231;2. 广东省传统发酵食品工程 技术研究中心,广东 佛山 528231;3. 广东省食品流通安全控制工程技术研究中心,广东 佛山 528231;4. 佛山农业生物制造工程技术研究中心,广东 佛山 528231;5. 长沙理工大学 化学与食品工程学院,湖南 长沙 410114;6. 开平市佰益饲料科技发展有限公司,广东 江门 529300)
酱油渣是酱油发酵结束后,经淋油或抽油产生的固体残渣[1]。2017年中国酱油产量接近860万t[2],按照每生产1 kg酱油产出0.67 kg酱油渣比例进行计算,中国酱油渣年产量高达600万t。酱油渣富含粗蛋白[3]、粗脂肪[4]等物质,是理想的非常规蛋白饲料[5]。但酱油渣用作饲料,存在含盐量较高、适口性较差及不易贮存等缺点[6-7],在一定程度上限制了酱油渣的应用。接种特定微生物,再次发酵酱油渣,改善其理化性质及营养品质,可解决上述问题[8-9]。
酱油发酵是一个多种微生物参与的过程,乳酸菌是其发酵过程中的主要细菌。不同发酵阶段酱醪中乳酸菌群的组成不同,主要包括嗜盐四联球菌属[10-11]、乳杆菌属、乳酸乳球菌、片球菌属、魏斯氏菌属等[12-13]。乳杆菌是目前应用最多的益生菌,其中干酪乳杆菌及植物乳杆菌被公认为是最经典的益生菌[14]。近年来,从干酪乳杆菌中划分出来的副干酪乳杆菌受到较多关注。Jahreis等[15]研究发现, LTH2579能显著提高机体粒细胞吞噬率及氧化型低密度脂蛋白抗体水平;田丹[16]研究发现,X12产生的肽聚糖具有诱导肿瘤细胞的免疫原性死亡的功能;Gardiner等[17]研究表明,副干酪乳杆菌发酵干酪,可增加干酪产品中游离氨基酸的数量,提高产品质量。目前对于酱油发酵过程乳酸菌资源的研究中,尚未见酱油渣中副干酪乳杆菌的相关研究报道。
试验拟采用传统微生物培养方法从酱油渣中分离、纯化乳杆菌,利用生理生化特征试验及分子生物学方法进行鉴定,并测定其对模拟人工胃液、肠液的耐受性,疏水性与抗氧化性能,以期筛选得到益生特性良好的副干酪乳杆菌,为其再次应用于酱油渣发酵或饲料生产等方面提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
酱油渣:原料主要为大豆与小麦粉,采用高盐稀态工艺酿造,广东省某调味食品有限公司;
革兰氏染色试剂盒、过氧化氢生化鉴定管、吲哚生化鉴定管、硫化氢生化鉴定管、明胶生化鉴定管、硝酸盐(还原)生化鉴定管、MRS肉汤等:广东环凯微生物科技有限公司。
1.1.2 仪器与设备
全自动灭菌锅:GR60DA型,致微(厦门)仪器有限公司;
显微镜:PH100型,凤凰光学集团有限公司;
电子分析天平:ME104型,梅特勒—托利多精密仪器公司;
防冻霜冰箱:BCD-189WDPV型,海尔股份有限公司;
恒温培养箱:LRH-150型,上海一恒科学仪器有限公司;
超净工作台:SW-CJ-1FD型,苏州安泰空气技术有限公司;
微孔板分光光度计酶标仪:Epoch2型,美国伯腾仪器有限公司。
1.2 试验方法
1.2.1 酱油渣中乳酸菌的分离纯化 根据文献[18-20]修改如下:无菌条件下,称取酱油渣25 g溶解于225 g无菌磷酸盐缓冲溶液中,制成10-1,10-2,…,10-7共7个浓度稀释液。吸取稀释液0.1 mL,涂布于MRS固体培养基,37 ℃倒置培养24~48 h。挑取菌落反复划线至菌落一致。挑取单菌落于MRS肉汤中37 ℃培养12 h,与体积分数50%甘油按1∶1(体积比)混合,-20 ℃保藏备用。划线于MRS固体斜面培养基,37 ℃培养至长出菌落,4 ℃保藏备用。
1.2.2 酱油渣中乳酸菌的鉴定
(1) 形态学观察:根据文献[21]修改如下,菌株划线于固体培养基中,37 ℃培养48 h,观察菌株的菌落形态。进行革兰氏染色试验,显微镜下观察菌株的菌体形态。革兰氏阳性菌株进行过氧化氢酶接触试验,有气泡产生为阳性反应,无气泡产生为阴性。
(2) 生理生化试验:参照《乳酸细菌分类鉴定及实验方法》[22],具体试验操作参考生化鉴定管的说明书。
(3) 分子生物学鉴定:将革兰氏呈阳性、过氧化氢酶接触试验呈阴性菌株送至华大基因进行16S rRNA基因序列测序。
(4) 系统发育树的构建:根据文献[23-24]进行修改,根据菌株的测序序列信息,登陆GenBank中BLAST程序(http://blast.ncbi.nlm.nih.gov)比对,在EzBioCloud数据库查询模式菌株信息,利用Mega 5.0软件,采用邻近算法,bootstrap为1 000构建系统发育树。
1.2.3 副干酪乳杆菌模拟胃液耐受性测定 根据文献[25]修改如下:菌株活化3代,调节菌液OD600 nm=1.00±0.05,吸取3 mL菌液,4 000 r/min离心10 min,去上清液,将菌体悬浮于3 mL灭菌生理盐水制成菌悬浮液。无菌离心管中加入人工胃液9 mL、菌悬浮液1 mL,混合均匀。37 ℃培养,分别在0(稀释度为10-4,10-5,10-6),3 h(稀释度为10-3,10-4,10-5)取样0.1 mL,使用平板计数法计算菌株存活率。设置3个平行,按式(1)计算菌株存活率。
(1)
式中:
S1——菌株存活率,%;
A0——耐受人工胃液0 h的活菌数,CFU/mL;
A1——耐受人工胃液3 h的活菌数,CFU/mL。
1.2.4 副干酪乳杆菌模拟肠液耐受性测定 根据文献[25]修改如下:取人工胃液消化3 h的菌株培养液1 mL,接种于9 mL人工肠液中,37 ℃培养0(稀释度10-3,10-4,10-5),4(稀释度10-2,10-3,10-4),8 h(稀释度10-2,10-3,10-4),使用平板计数法计算菌株存活率。设置3个平行,按式(2)计算菌株存活率。
(2)
式中:
S2——菌株存活率,%;
A0——人工肠液耐受0 h的活菌数,CFU/mL;
As——人工肠液耐受4,8 h的活菌数,CFU/mL。
1.2.5 副干酪乳杆菌表面疏水性测定 根据文献[25]修改如下:菌株活化3代,调节菌液OD600 nm=1.00±0.05,接种量为2%(体积分数),37 ℃培养12 h。菌液5 000 r/min 离心5 min,磷酸盐溶液洗涤2~3次,重悬。测定菌株OD600 nm。吸取上述菌悬浮液3 mL,加入二甲苯1 mL,室温培养15 min,震荡使其混合,室温静置1 h,吸取下层水相,以磷酸盐缓冲液为空白对照,测定OD600 nm,按式(3)计算菌株疏水率。
(3)
式中:
S3——菌株疏水率,%;
A0——菌液与二甲苯混匀前菌液的OD600 nm值;
A——菌液与二甲苯混匀后菌液的OD600 nm值。
1.2.6 副干酪乳杆菌抗氧化能力测定
(1) 副干酪乳杆菌培养及无细胞提取物的制备:根据文献[26-27]修改如下,挑取人工胃肠液耐受性及疏水性良好的菌株进行抗氧化试验。菌株活化3代,接种量2%(体积分数),37 ℃培养1 d。4 ℃下4 000 r/min离心20 min,去上清收菌体。用磷酸盐缓冲液洗涤菌体3次,重悬,调整OD600 nm=1.00±0.05。菌悬液分为制备乳酸菌无细胞提取物(CFE)和菌体细胞(IC)两组。菌悬液冰浴下超声破碎12 min,每工作9 s,停歇12 s,4 ℃下9 500 r/min 离心15 min,上清液即为无细胞提取物。将菌体细胞和无细胞提取物于4 ℃保存备用。
(2) 副干酪乳杆菌清除DPPH能力测定:根据文献[26]修改如下,分别取2 mL菌体悬浮液(无细胞提取物)、DPPH溶液(0.2 mmol/L),室温下避光反应0.5 h,测定OD517 nm,空白为无水乙醇。按式(4)计算菌株DPPH清除率。
(4)
式中:
S4——菌株DPPH清除率,%;
Ai——2 mL DPPH+2 mL样品的OD517 nm;
Aj——2 mL无水乙醇+2 mL样品的OD517 nm;
A0——2 mL DPPH+2 mL无水乙醇的OD517 nm。
(3) 副干酪乳杆菌清除羟基自由基能力测定:根据文献[26]修改如下,分别取2 mL邻菲啰啉(2.5 mmol/L)、磷酸盐缓冲溶液(pH 7.4,0.02 mol/L)、蒸馏水,混匀。分别加入2 mL硫酸亚铁溶液(2.5 mmol/L)、H2O2(20 mmol/L)溶液,混匀,37 ℃水浴90 min。4 ℃下5 000 r/min 离心6 min,测定OD536 nm,空白为磷酸盐缓冲溶液。按式(5)计算羟基自由基清除率。
(5)
式中:
S5——羟基自由基清除率,%;
Ai——2 mL蒸馏水代替2 mL H2O2的OD536 nm;
Aj——用2 mL细胞悬浮液或无细胞提取物代替2 mL 蒸馏水的OD536 nm;
A0——磷酸盐缓冲溶液的OD536 nm。
1.3 数据处理
数据统计及处理采用Excel 2013以及SPSS 17.0,采用Origin 9绘图。
2 结果与分析
2.1 乳酸菌的菌落形态
从酱油渣中分离得到10株乳酸菌,分别为菌株HT31、HT51、HT90、HT111、HT125、HT155、HT158、HT159、HT253及HT256,菌落颜色均为奶白色,中央凸起,菌落表面光滑有光泽,边缘齐整,直径为0.5~1.5 mm,菌落形态如图1所示。经革兰氏染色试验及酶触试验发现,10株乳酸菌的菌体形态均为杆状,酶触试验均呈阴性,菌体形态如图2所示。

图1 乳酸菌在MRS固体培养基的菌落形态
2.2 乳酸菌生理生化试验特征
由表1可知,菌株HT31、HT51、HT90、HT111、HT125、HT155、HT158、HT159、HT253和HT256在酶触、硝酸盐还原、明胶液化、H2S产生、吲哚试验中均呈阴性,参考张刚[28]、华鹤良[29]的方法,结合形态学结果,初步判定上述菌株为乳杆属(Lactobacillus)。
图2 部分乳酸菌菌株的菌体形态
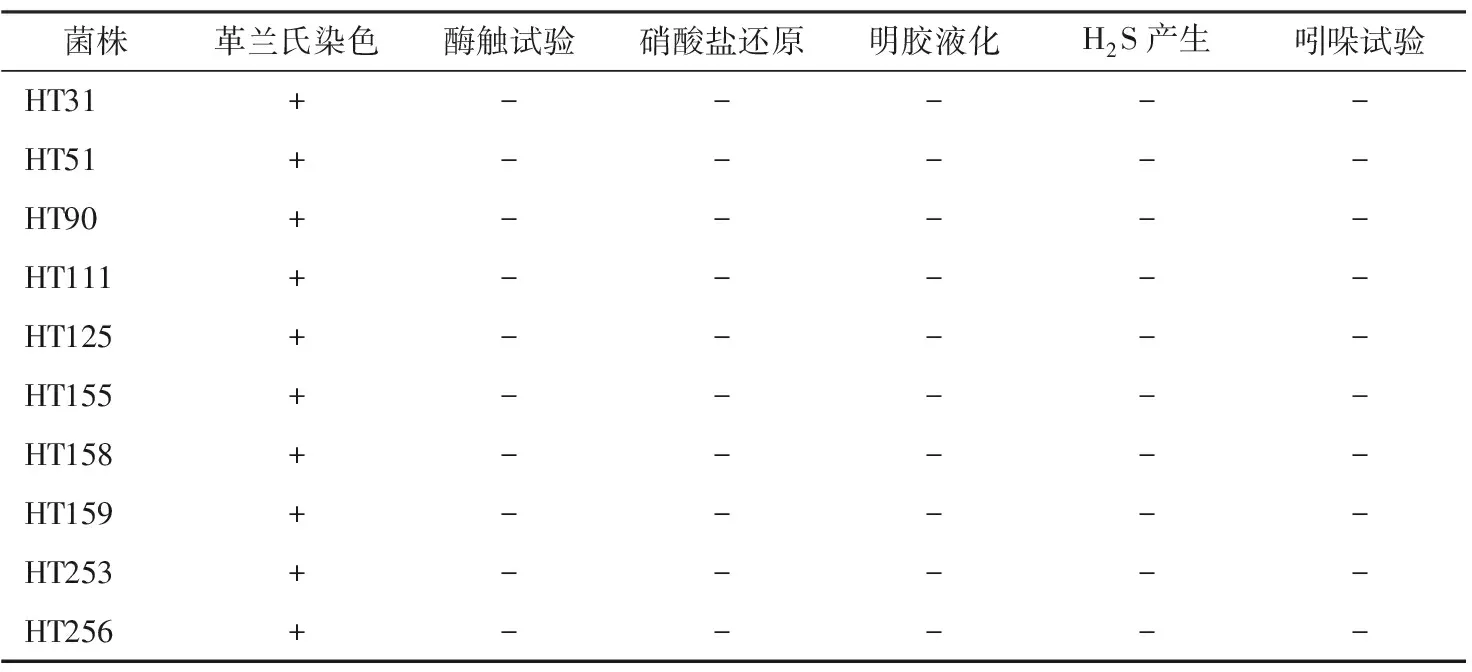
表1 酱油渣中乳酸菌的生理生化鉴定结果†
† “+”表示反应呈阳性;“-”表示反应呈阴性、不生长或生长不明显。
2.3 菌株分子生物学鉴定
对10株乳酸菌进行基因组提取、PCR扩增及测序。凝胶电泳图如图3所示。由图3可知,10株乳酸菌的PCR扩增产物大小均在1 500 bp左右,且电泳带光亮明显,无杂质,可进行测序[30]。
得到菌株16S rRNA基因序列后,进行Blast比对,结果如表2所示。使用Mega 5.0构建系统发育树,如图4 所示。由图4可知,菌株HT31、HT51、HT90、HT111、HT125、HT155、HT158、HT159、HT253、HT256均与模式菌株Lactobacillusparacaseisubsp.paracaseiATCC 25302T、Lactobacillusparacaseisubsp.toleransJCM 1171T处于同一分支。结合表2,将菌株HT31、HT51、HT90、HT111、HT125、HT159、HT253、HT256鉴定为Lactobacillusparacaseisubsp.paracasei(副干酪乳杆菌副干酪亚种);将菌株HT155、HT158鉴定为Lactobacillusparacaseisubsp.tolerans(副干酪乳杆菌坚韧亚种)。Wei等[31]发现参与酱油发酵的细菌主要有乳杆菌、魏斯氏菌、芽孢杆菌等;胡传旺[12]研究发现,酱油发酵过程的主要微生物有乳杆菌、片球菌、魏斯氏菌等。
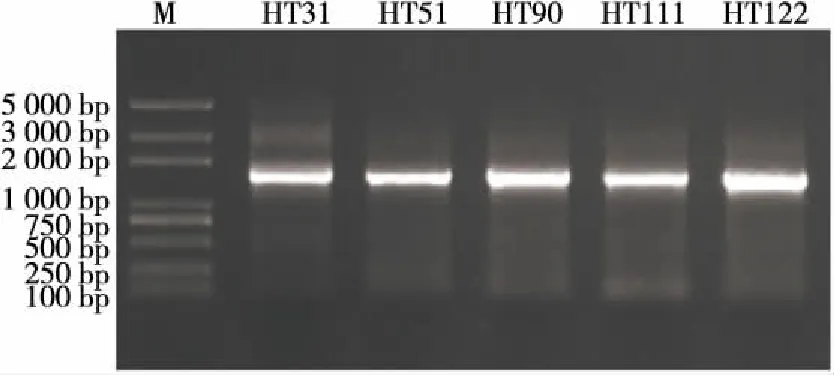
电泳条件:3 μL样品+1%琼脂糖凝胶,使用Trans 2K@Plus DNA Marker
图3 部分乳酸菌16S rRNA PCR扩增产物电泳图
Figure 3 Electrophoresis of 16S rRNA amplified products of partial lactic acid bacteria
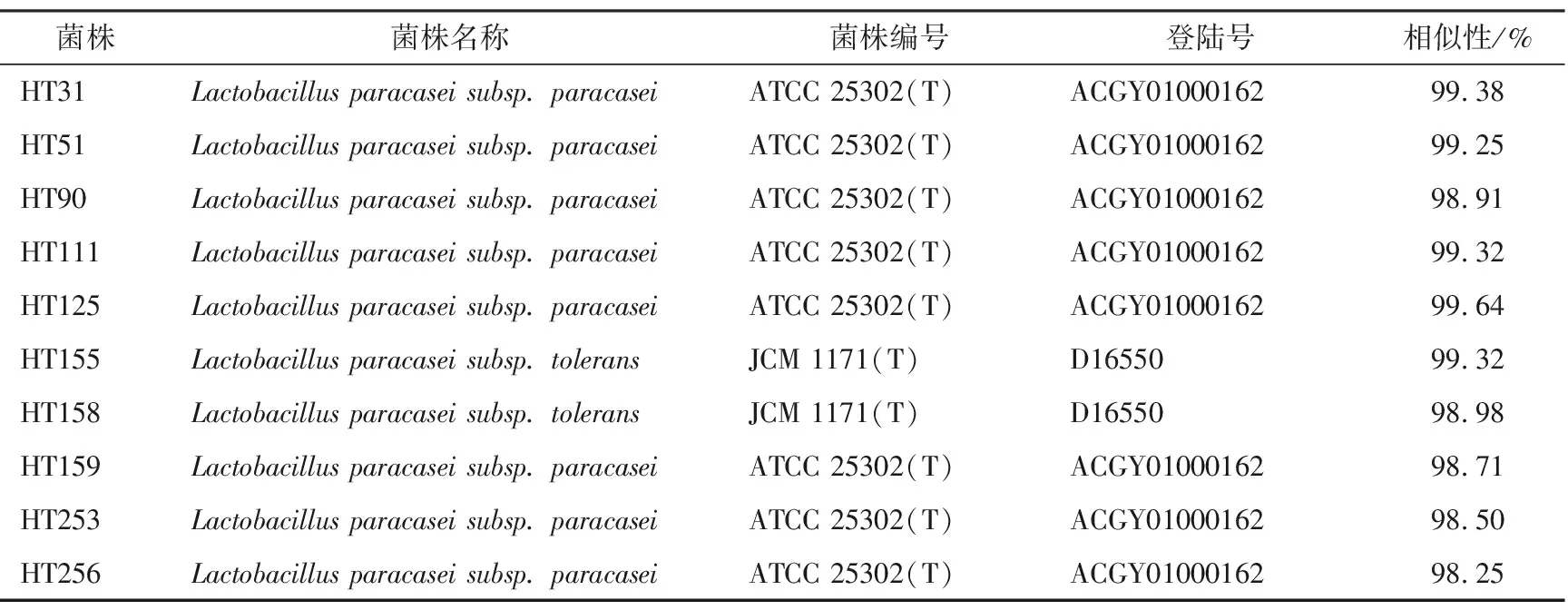
表2 酱油渣中分离菌株的16S rRNA序列同源性比对结果

0.02表示2%的碱基替换率
2.4 副干酪乳杆菌模拟胃液耐受能力
在实际应用中,乳酸菌要发挥其积极作用会受到诸多因素的限制,其中包括机体消化道中低pH胃液的作用[32]。如乳酸菌耐受胃液的能力差,则导致菌株存活率过低,难以发挥其益生特性,因此胃液耐受能力是研究乳酸菌益生特性的指标之一。由图5可知,菌株HT31、HT256对模拟胃液耐受性较好,在胃液中耐受3 h后,菌株存活率分别为(86.33±1.24)%,(80.88±5.39)%;菌株HT90、HT158、HT159、HT253耐受胃液3 h后,菌株存活率分别为(66.32±0.35)%,(69.08±0.41)%,(67.15±0.03)%,(63.47±0.67)%;菌株HT155、HT51、HT111耐受胃液3 h后,菌株存活率分别为(57.43±1.56)%,(48.66±0.28)%,(31.37±0.50)%;菌株HT125的存活率较低,仅为(13.45±0.11)%。

图5 副干酪乳杆菌在模拟人工胃液中的存活率
Figure 5 The experimental results ofLactobacillusparacaseiin simulated artificial gastric juice
2.5 副干酪乳杆菌模拟肠液耐受能力
乳酸菌耐受机体肠道高胆汁酸的能力是研究其益生特性的又一指标[32]。由图6可知,菌株HT31、HT253、HT111、HT155耐受肠液能力较好,耐受肠液4 h后的存活率分别为(95.40±0.55)%,(85.36±0.02)%,(74.56±0.44)%,(71.57±0.15)%;其余菌株耐受肠液4 h后的存活率均在30%~60%。耐受模拟肠液8 h后,菌株HT31、HT111、HT155的耐受能力较好,存活率分别为(60.22±0.16)%,(62.18±0.70)%,(52.84±0.00)%;菌株HT51、HT90、HT158耐受模拟肠液能力稍差,存活率分别为(39.04±1.03)%,(36.00±0.04)%,(43.67±0.09)%;菌株HT125、HT159、HT253、HT256耐受模拟肠液8 h后,存活率<30%。
2.6 副干酪乳杆菌表面疏水性
乳酸菌进入人体肠道后,需要有一定的肠道附着能力才能发挥其益生特性。细菌的疏水性有利于细菌对肠膜的黏附,疏水性越大,细菌黏附力越大[33]。由图7可知,菌株HT111、HT155疏水性较好,疏水率分别为(26.51±0.66)%,(25.41±0.58)%;菌株HT31、HT256、HT253的疏水性稍弱,疏水率分别为(18.52±0.76)%,(17.59±0.24)%,(15.77±0.49)%;其余菌株的疏水率<10%。
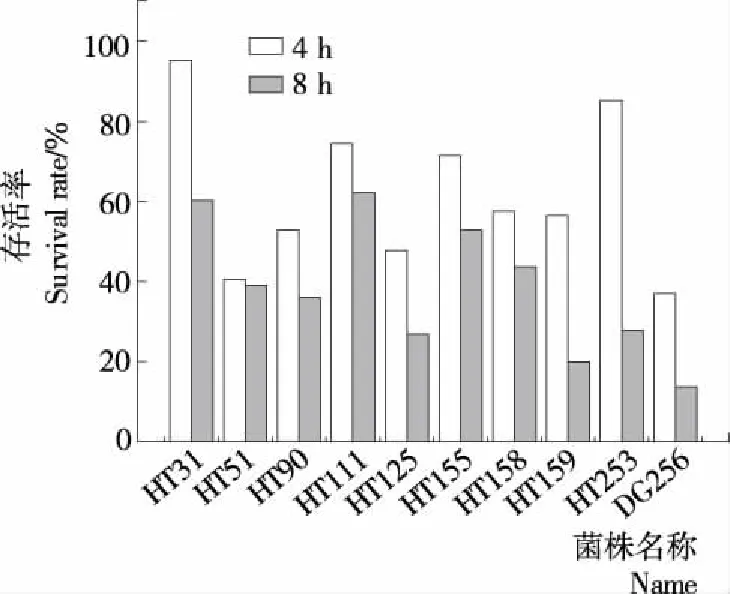
图6 副干酪乳杆菌在模拟人工肠液中的存活率
Figure 6 Experiments on the number of living bacteria ofLactobacillusparacaseiin simulated artificial intestinal fluid

图7 副干酪乳杆菌的表面疏水率
2.7 副干酪乳杆菌抗氧化能力
挑选模拟胃液、肠液耐受性良好,疏水性较好的副干酪乳杆菌菌株HT31、HT111、HT155进行抗氧化能力测定。由图8可知,菌株HT31清除DPPH的能力较好,其细胞悬浮液的DPPH·清除率为(26.25±0.01)%,无细胞提取物的清除率为(16.03±0.03)%;菌株HT111、HT155细胞悬浮液的DPPH·清除率<10%,其无细胞提取物的DPPH·清除率分别为(15.03±0.02)%,(18.67±0.09)%。由图9可知,菌株HT31、HT155清除·OH能力较好,其细胞悬浮液清除率分别为(42.88±0.21)%,(36.10±0.00)%,其无细胞提取物·OH清除率分别为(27.74±0.01)%,(38.24±0.73)%;菌株HT111的细胞悬浮液、无细胞提取物·OH清除率分别为(33.33±0.00)%,(28.24±0.06)%。综上,菌株HT31抗氧化能力最佳。
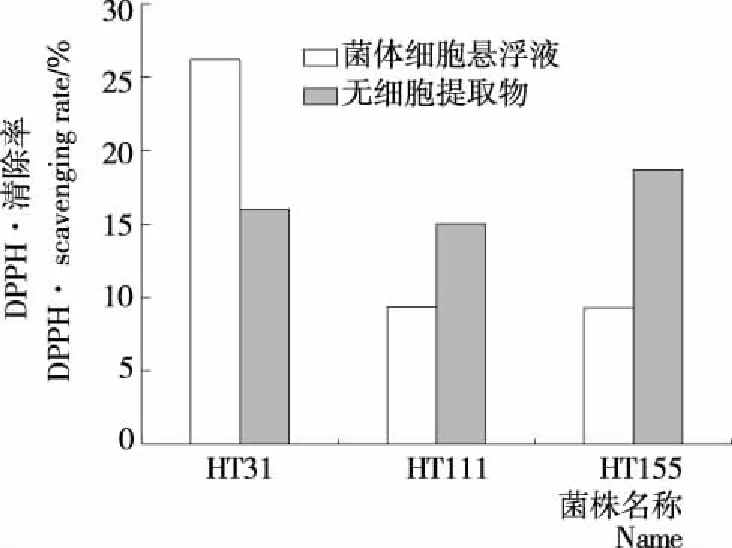
图8 副干酪乳杆菌清除DPPH·的能力
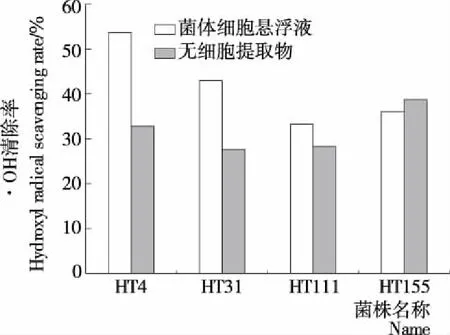
图9 副干酪乳杆菌清除·OH的能力
3 结论
从酱油渣中分离得到10株乳酸菌,经鉴定,8株属于Lactobacillusparacaseisubsp.paracasei,2株属于Lactobacillusparacaseisubsp.tolerans;对10株菌株进行模拟胃肠液耐受性、疏水性及抗氧化试验发现,菌株HT31的耐受模拟胃肠环境能力、疏水能力以及抗氧化能力较强。菌株HT31丰富了乳酸菌资源库,后续可研究菌株HT31的益生特性及应用性能,为酱油渣的深入开发及应用提供科学依据。
