pH及离子强度对燕麦分离蛋白功能特性及亚基特性的影响
2019-11-14王美玉陈振家刘龙龙
王美玉 王 愈 陈振家 闫 舟 刘龙龙
(1. 山西农业大学,山西 晋中 030801;2. 山西省农业科学院农作物品种资源研究所,山西 太原 030031)
贮藏蛋白是多数植物种子的主要蛋白质,在种子萌发过程中作为氮、硫和碳水化合物的来源。贮藏蛋白主要分为球蛋白和醇溶蛋白,双子叶植物种子的主要贮藏蛋白质为球蛋白,而单子叶植物则为醇溶蛋白,多数谷物种子的主要贮藏蛋白质为醇溶蛋白,而燕麦和大米只含有少量的醇溶蛋白胺(5%~10%),其主要贮藏蛋白为球蛋白[1],并与双子叶植物中的11S球蛋白相似,有研究[2]表明燕麦和大米贮藏蛋白在水中的溶解性比双子叶植物的差,燕麦球蛋白的溶解需要0.8~1.0 mol/L的NaCl,而水稻球蛋白的溶解需要变性溶剂。燕麦球蛋白含量高,占燕麦总蛋白含量的50%~80%,氨基酸比例合理,其中赖氨酸含量为4.2%,高于除大米以外的其他谷物[3],因此近年来受到广泛关注。
影响蛋白质溶解度的因素有pH、离子强度、溶剂类型及温度。Ma等[4]研究表明,在极端酸性或碱性条件下,β-折叠结构(1 626,1 634,1 682 cm-1)条带向更高或更低的波数移动,表明构象发生了变化;在一定的盐浓度下,1 626,1 634 cm-1谱带向上移动,1 634 cm-1峰强度明显减小。球蛋白组分呈U型溶解度曲线,在pH 6~7时溶解度最小;在曲线的酸性、碱性端,溶解度均达到90%以上[5]。前期研究[6]发现,高盐离子强度下燕麦球蛋白有更高的溶解性,而球蛋白为燕麦分离蛋白的主要成分。
在前人研究的基础上,试验拟扩大pH及离子强度范围,研究燕麦分离蛋白的功能特性及亚基特性,利用十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)从亚基角度解释不同pH及离子强度下,可溶性燕麦分离蛋白的亚基特性及其与部分功能特性之间的关系,旨在为燕麦分离蛋白的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
燕麦:坝莜一号,山西农业科学院;
氢氧化钠、氯化钠、盐酸:分析纯,国药集团化学试剂有限公司;
考马斯亮蓝G250、30%制胶剂、四甲基乙二胺、SDS、甘油、低分子量蛋白质Marker:分析纯,北京索莱宝科技有限公司。
1.2 仪器与设备
紫外—可见分光光度计:UV-1200型,上海美谱达仪器有限公司;
pH计:ST3100型,奥豪斯仪器(常州)有限公司;
磁力加热搅拌器:791型,金坛市科析仪器有限公司;
高速离心机:HC-2064型,安徽中科中佳科学仪器有限公司;
电泳仪:DYY-7C型,北京市六一仪器厂。
1.3 试验方法
1.3.1 燕麦分离蛋白的制备 根据文献[7]修改如下,挑选籽粒饱满,无病虫害的燕麦磨粉,燕麦粉与石油醚按1∶5(g/mL)混合搅拌过夜,然后经抽滤、晾干除去石油醚即为燕麦脱脂粉。燕麦脱脂粉与水按1∶10(g/mL)混合并调节pH为9.0,50 ℃下恒温提取2 h, 4 000 r/min离心15 min,取上清液,调节上清液pH为5.0,4 000 r/min离心15 min,沉淀匀浆后调节pH至中性,经真空冷冻干燥,即为燕麦分离蛋白(含量为80.3%)。
1.3.2 不同pH及离子强度下可溶性燕麦分离蛋白浓度的测定 配制质量分数为1%的燕麦分离蛋白溶液,搅拌0.5 h,用1 mol/L HCl及NaOH溶液分别调节pH至2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0,加入NaCl溶液分别配成浓度梯度为0.01,0.05,0.10,0.20,0.30,0.40,0.50,0.60,0.70,0.80,0.90,1.00 mol/L的溶液,搅拌15 min,10 000 r/min离心10 min,上清液用考马斯亮蓝法[8]测定蛋白质含量。
1.3.3 起泡性及泡沫稳定性的测定 参照何帼英等[9]方法,略作修改。配制质量分数5%的燕麦分离蛋白溶液,搅拌0.5 h。用1 mol/L HCl及NaOH溶液调节为不同pH;加入NaCl调节为不同离子强度,分别取10 mL蛋白溶液,13 500 r/min均质2 min,分别记录均质停止时及放置30 min后泡沫的体积。按式(1)、(2)计算起泡性及泡沫稳定性。
(1)
(2)
式中:
FA——起泡性,%;
FS——泡沫稳定性,%;
V0——搅打停止时泡沫总体积,mL;
V——搅打前液体体积,mL;
V30——放置30 min后泡沫体积,mL。
1.3.4 乳化性及乳化稳定性的测定 参照管骁等[10]方法,略作修改。配制质量分数1%的燕麦分离蛋白溶液,搅拌0.5 h。用1 mol/L HCl及NaOH溶液调节为不同pH;加入NaCl调节为不同离子强度,分别取15 mL蛋白溶液与5 mL大豆油混合,13 500 r/min均质2 min。分别从瓶底取20 μL均质停止时及放置30 min后的乳浊液,与5 mL SDS(0.1%,质量分数)溶液混合,在500 nm下测定吸光值(以SDS溶液为空白)。按式(3)、(4)计算乳化性及乳化稳定性。
(3)
(4)
式中:
EAI——乳化性,m2/g;
ESI——乳化稳定性,min;
A0——初始乳化液吸光值;
C——样品浓度,g/mL;
φ——乳化液中油相的比例;
L——比色杯光径,mm;
N——稀释倍数;
A30——30 min后乳化液的吸光值。
1.3.5 SDS-PAGE 根据文献[11]略作修改,取1.3.2中离心所得上清液进行电泳试验,浓缩胶与分离胶浓度分别为5%,12%,样品上样量6 μL,恒压电泳,电流40 mA,浓缩胶电压100 V,分离胶电压150 V。电泳结束后,电泳胶片固定3 h,再通过染色,脱色,最后成像仪成像。
1.4 数据处理
试验重复3次,使用Excel 2010和Origin 8.0进行数据处理。
2 结果与分析
2.1 pH与离子强度对燕麦分离蛋白溶解性的影响
由图1可知,燕麦分离蛋白溶解度呈U型曲线,pH在5.0~6.0(等电点)时,溶解度最低,与管骁等[5,10]研究结果相近,而许英一等[12]则认为pH为4.0时燕麦分离蛋白溶解度最低,但pH为6.0时其溶解度同样也较低,可能是由于原料或提取条件的不同造成的。因此,燕麦分离蛋白在pH 5.0~6.0缺乏静电排斥作用,蛋白质—蛋白质之间的疏水相互作用远大于带电残基产生的亲水性和水合作用,燕麦分离蛋白此时几乎完全不溶解,而在碱性pH下具有较高的溶解度。

图1 pH对燕麦分离蛋白溶解特性的影响
由图2可知,添加盐离子(<0.05 mol/L)会使燕麦分离蛋白的溶解度降低,表现为盐析,一方面为燕麦分离蛋白含有较高比例的非极性区域,降低了溶解度[13],另一方面为少量盐离子与水分子相互作用,减少了燕麦分离蛋白表面亲水基团与水分子间的相互作用[14],促进蛋白质—蛋白质相互作用,使蛋白质分子间发生聚集,导致溶解性降低。继续添加盐离子,燕麦分离蛋白的溶解度逐渐升高,表现为盐溶,与Hari等[2]的报道一致,与大豆蛋白溶解特性相反[15]。燕麦球蛋白在酸性多肽的C末端附近含有8个富含谷氨酰胺的氨基酸重复序列(大豆球蛋白中该区域由不同长度的酸性残基组成),该区域位于球蛋白表面,暴露于溶剂,与其他球蛋白相比,燕麦球蛋白的亲水性较低,部分解释了燕麦球蛋白溶解度所需的盐浓度较高[16]。

图2 离子强度对燕麦分离蛋白溶解特性的影响
Figure 2 Effect of ionic strength on the dissolution characteristics of oat protein isolate
2.2 pH与离子强度对燕麦分离蛋白起泡性的影响
由图3可知,燕麦分离蛋白在等电点(pH 5.0~6.0)时起泡性最差,泡沫仅由蛋白质的可溶部分参与形成,但泡沫最为稳定,与Guan等[17]的研究一致。等电点时,蛋白质—蛋白质间缺乏静电排斥相互作用,有利于界面上的蛋白质—蛋白质相互作用及形成黏稠的膜。
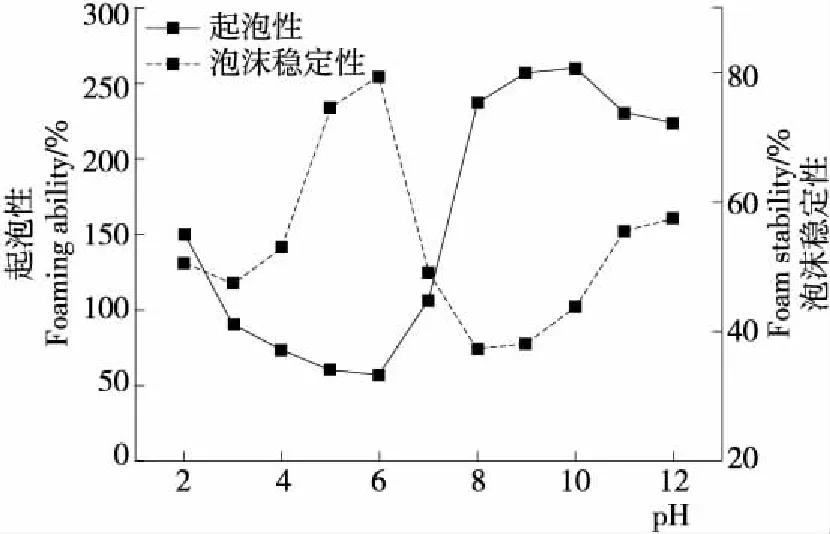
图3 pH对燕麦分离蛋白起泡性和泡沫稳定性的影响
由图4可知,加入盐离子后燕麦分离蛋白起泡性明显降低。当NaCl浓度<0.1 mol/L 时,燕麦分离蛋白的起泡性随盐离子浓度的增加而降低,可能是NaCl对燕麦分离蛋白的盐析作用;当NaCl浓度>0.1 mol/L 时,随着盐离子浓度的进一步增加,燕麦分离蛋白的起泡性迅速下降并趋于平缓,可能是燕麦分离蛋白对NaCl的盐溶作用;当NaCl浓度达到0.8 mol/L时,燕麦分离蛋白表现出良好的起泡性,与何帼英等[18]的研究结果相近。不同离子强度下,燕麦分离蛋白的泡沫稳定性先上升后下降,随后趋于平缓。当NaCl浓度为0.1 mol/L时,燕麦分离蛋白泡沫稳定性最佳,当NaCl浓度≥0.2 mol/L时,随离子强度的增加,泡沫稳定性无明显变化。

图4 离子强度对燕麦分离蛋白起泡性和泡沫稳定性的影响
Figure 4 Effects of different ionic strength on foaming and foam stability of oat protein isolate
2.3 pH与离子强度对燕麦分离蛋白乳化性的影响
由图5可知,在等电点附近,由于蛋白微溶且缺乏静电排斥力,燕麦分离蛋白乳化性较差,在碱性条件下,燕麦分离蛋白表现出了良好的乳化性,与Guan等[17]的研究一致。在酸性和中性条件下,乳化稳定性变化趋势与乳化性变化趋势相反;而碱性条件下,乳化性与乳化稳定性变化趋势相同,在一定范围内随pH的增加,乳化性及乳化稳定性均不断升高。

图5 pH对燕麦分离蛋白乳化性和乳化稳定性的影响
由图6可知,盐离子的添加整体降低了燕麦分离蛋白的乳化性能。当NaCl浓度<0.2 mol/L时,燕麦分离蛋白的乳化活性随盐离子浓度的增加而降低,NaCl浓度为0.2 mol/L时,乳化性最差;当NaCl浓度>0.2 mol/L时,乳化性先上升后下降,NaCl浓度为0.7 mol/L 时乳化性最佳,与何帼英等[18]研究结果相近。乳化稳定性变化趋势与乳化性相反,NaCl浓度为0.3 mol/L时乳化稳定性最高。

图6 离子强度对燕麦分离蛋白乳化性和乳化稳定性的影响
Figure 6 Effect of different ionic strength on emulsifying and emulsifying stability of oat protein isolate
2.4 SDS-PAGE
由图7可知,当蛋白质在中性pH附近时,静电排斥能量小于其他稳定蛋白质相互作用的能量,因此大部分蛋白较为稳定;在极端pH时,高静电荷引起的强烈的分子内静电排斥力导致蛋白质分子的肿胀和展开。在碱性条件下,可溶性燕麦分离蛋白亚基之间无明显区别,可能是由于其中含有少量的天冬氨酸(Asp)、谷氨酸(Glu)[19]残基。而酸性条件对可溶性燕麦分离蛋白亚基影响较大,pH由2.0~6.0,在可溶性蛋白浓度逐渐降低的过程中,相对分子质量>66.2 kDa的亚基先完全消失,随后是相对分子质量为22.0~43.0 kDa的亚基,最后是相对分子质量为43.0~66.2 kDa的亚基。pH为2.0,3.0时,酸性条件造成了肽链的部分水解,形成了相对分子质量为31.0~43.0 kDa的亚基条带,其中pH 2.0时形成的亚基相对分子质量较pH 3.0时大,被还原后形成了14.4~22.0 kDa 的小分子多肽。
由图8可知,不同离子强度对可溶性燕麦分离蛋白的亚基条带影响显著,对比图7中pH 7.0时亚基条带可知,由于盐离子的加入,造成了可溶性燕麦分离蛋白肽链的断裂(可能是二硫键的断裂),形成了相对分子质量分别为43.0,66.2 kDa的多肽链,且被还原后未发生变化,说明断裂后的多肽链不含二硫键。当NaCl浓度为0.05 mol/L 时,可溶性蛋白主要由相对分子质量为43.0 kDa 的亚基组成,随着盐离子浓度的增加,相对分子质量为66.2 kDa多肽先溶解,随后相对分子质量为43.0~66.2 kDa的亚基(酸性多肽与碱性多肽通过二硫键连接形成)溶解。
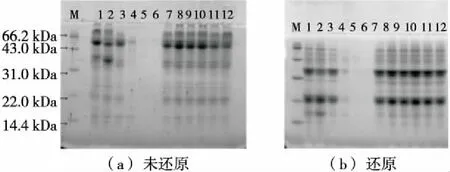
M. 低分子量蛋白Marker 1~12. 依次为pH 2.0,3.0,4.0,4.5,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0
图7 不同pH条件下燕麦分离蛋白SDS-PAGE图
Figure 7 SDS-PAGE analysis of oat protein isolate under different pH conditions

M. 低分子量蛋白Marker 1~12. 依次为NaCl浓度0.01,0.05,0.10,0.20,0.30,0.40,0.50,0.60,0.70,0.80,0.90,1.00 mol/L
图8 不同离子强度下燕麦分离蛋白SDS-PAGE图
Figure 8 SDS-PAGE analysis of oat protein isolate under different ionic strength conditions
3 结论
燕麦分离蛋白在pH 5.0~6.0时溶解度最低,起泡性最低,泡沫稳定性最高,在碱性条件下乳化性及乳化稳定性较高;pH 2.0,3.0的酸性条件造成了可溶性燕麦分离蛋白肽链的部分水解,形成了相对分子质量为31.0~43.0 kDa 的亚基条带,碱性条件下无明显区别。NaCl浓度为0.05 mol/L时溶解度最低,NaCl浓度为0.6~0.9 mol/L 时,起泡性、泡沫稳定性及乳化性均较高;溶解度最低时,可溶性蛋白主要是由相对分子质量为43.0 kDa 的亚基组成,NaCl的加入造成了可溶性燕麦分离蛋白肽链的断裂,形成了相对分子质量分别为43.0,66.2 kDa的多肽链。试验仅研究了pH及离子强度对燕麦分离蛋白的功能特性与亚基特性的影响,后续可采用现代高新技术分析其他相关性质指标。
