青蒿素基于PI3K/AKT信号通路对人急性髓系白血病细胞凋亡的作用机制
2019-11-14贾国存成怡冰王海军郭亚琼
王 朦,贾国存*,成怡冰,王海军,刘 炜,郭亚琼
0 引言
急性髓系白血病(Acute myeloid leukemia,AML)为起源于多能干细胞的髓系增殖性肿瘤,在儿童中发病率高,预后差[1]。目前主要采用化疗、干细胞移植与放疗等手段进行治疗,化疗药物毒副作用大,干细胞移植要求高,兼容性差,排斥反应大;放疗可引起相邻器官组织损伤。因此,寻找高效低毒、可行性高的药物迫在眉睫[2]。随着人们对AML研究的深入,信号通路逐渐成为其研究重点,其中磷脂酰肌醇3-激酶(Phosphatidylinositol 3-Kinases,PI3K)/蛋白激酶B(Protein kinase,PKB,又称AKT)受到了广泛关注,与肿瘤细胞增殖、凋亡、分化、迁移等生物学行为过程密切相关,可能成为肿瘤治疗的新靶点[3]。青蒿素是我国中医学家首次从菊科植物黄花蒿中提取的新型中成药。青蒿琥酯(Artesunate,ART)是青蒿素类衍生物,有潜在抗肿瘤作用,可抑制肿瘤细胞增殖与分化、促进细胞凋亡[4]。本文主要基于PI3K/AKT信号通路分析青蒿素对人AML细胞凋亡的作用机制,现报道如下。
1 材料与方法
1.1 材料 选择2016年10月至2018年10月我院收治的44例AML患儿,均经世界卫生组织(WHO)的MICM分型明确诊断,为初治或复发病例,且免疫表型检测发现抗原阳性细胞≥20%,患儿家属均对本研究内容知情且签署知情同意书。其中,男27例,女17例;年龄9个月~14岁,平均(8.20±0.86)岁;2010年美国国家综合癌症网络(NCCN)危险分级:低危、中危、高危分别16例、23例、5例。另选择人慢性粒细胞白血病K562细胞株4株,均由中国医学科学院基础医学研究所细胞资源中心传代保存。
1.2 主要仪器与试剂 仪器:5417低温高速离心机(德国Eppondoff公司);倒置显微镜、激光共聚焦显微镜(日本,Olympus);FACSCaliber流式细胞仪(美国BD公司)。
试剂:注射用青蒿琥酯粉针剂(广西桂林南药股份有限公司,60 mg/支);RPMI-1640细胞培养基(美国Gibco公司),胎牛血清(杭州,四季春);Trizol试剂(美国Ambiong公司);全蛋白提取试剂盒(凯基生物技术有限公司);BCA蛋白定量试剂盒(碧云天);Goat anti-Rabbit二抗(Boster公司)或HRP标记的Goat anti-Mouse二抗(Boster公司);Western blot凝胶制备试剂盒(武汉谷歌生物公司);β-action(中国,Abmart公司);PI3K、AKT、P-AKT、Bcl-2、Bax、caspase-3、PTEN检测试剂盒均购自美国CST公司。
1.3 方法
1.3.1 青蒿琥酯溶液的配制 无菌条件下,将60 mg青蒿琥酯粉针剂(1瓶),加入5% NaHCO3溶液1 ml,振摇1 min使之充分溶解,注入RPMI-1640培养液适量,混匀,依次制成浓度为12.5、25.0、50.0 μg/ml的青蒿琥酯溶液,保存于-20 ℃备用,另选择不含青蒿琥酯的RPMI-1640培养液100 ml作为对照。
1.3.2 人AML原代细胞的提取及K562细胞株的培养 将44例AML患儿随机分为4组,各11例;K562细胞株随机分为4组,每组1株。在无菌条件下取AML患儿骨髓液4~5 ml,加入抗凝离心管(含肝素0.3 ml)中,取等体积PBS液对骨髓液进行稀释,充分混匀。取淋巴细胞分离液4~5 ml加入干燥离心管,将稀释后的骨髓液缓慢加入分离液上层,于2 500 r/min下离心约20 min,取中间呈白膜状单个核细胞层,移入另一个干燥洁净的离心管,采用PBS液漂洗2次,之后在1 000 r/min下离心5 min,弃上清液,以1640培养液稀释,加入75 ml培养瓶,放置在37 ℃、湿度95%、含5% CO2的培养箱中培养,每3天换液1次。K562细胞株培养于含10% 胎牛血清、100 μg/ml链霉素、100 μg/ml青霉素的RPMI-1640培养液中,放置在37 ℃、5% CO2培养箱中培养,每2天换液1次。取对数生长期的细胞,1 000 r/min离心5 min,以PBS洗涤细胞2次,普通培养基重悬,取30 μl细胞计数并观察细胞活度,以每孔3×105~5×105个细胞接种在24孔板,加入相应浓度的青蒿琥酯,培养72 h。
1.3.3 细胞生长趋势观察 提取骨髓单个核细胞层,加入适量含20%胎牛血清的1640培养液,调细胞初始浓度为1×106个/ml。分别于提取时及培养24、48、72 h观察并计数细胞,在低倍显微镜下(100×)观察计数板细胞数,其中呈蓝色染色细胞为死亡细胞,不染色细胞为活细胞,计算细胞存活率,细胞存活率=(细胞总数-蓝色细胞数)/细胞总数×100%,将计数细胞悬液滴样的所得数值求平均值。
1.3.4 流式细胞术检测细胞凋亡 将各组细胞分别培养24、48、72 h后收集,取1×106个细胞,以预冷的PBS洗涤2次,采用FACSCalibur流式细胞仪分析细胞凋亡情况。
1.3.5 Western blot法检测凋亡相关蛋白 制备12%分离胶和4%积层胶,微量加样器加入20 μg总蛋白,连接电泳槽与电源正负极,浓缩胶60 V电泳30 min,分离胶100 V电泳70 min,之后将滤纸和膜置于转膜缓冲液中平衡10 min,低温稳流摇动,封闭60 min,按1∶3 000稀释,4 ℃孵育过夜,TBST漂洗3次,10 min/次,以HRP标记的Goat anti-Rabbit二抗(Boster公司)1∶6 000孵育相应的膜,缓慢摇动,室温孵育120 min,漂洗,曝光10 s,以KODAK显影液和定影液冲洗胶片,培清凝胶成像分析系统分析拍照。

2 结果
2.1 细胞生长状态观察 AML原代细胞、细胞株K562 24 h内细胞存活率≥80%,对照组AML原代细胞、细胞株K562 48~72 h细胞存活率仍≥70%,而实验组AML原代细胞、细胞株K562培养48 h细胞存活率均降至50%以下,且明显低于对照组(P<0.05)。在培养72 h后,随着青蒿素浓度上升,原代细胞与K562细胞株的细胞存活率下降,实验组青蒿琥酯25 μg/ml、50 μg/ml组72 h后细胞大量死亡,存活率≤10%,实验组青蒿琥酯25.0 μg/ml组的细胞存活率最低,明显低于12.5 μg/ml组及对照组(P<0.05),25.0 μg/ml组、50.0 μg/ml组的细胞存活率比较差异无统计学意义(P>0.05)。见图1、图2。

图1 不同浓度青蒿琥酯对原代细胞存活率的影响
注:*与对照组比较,P<0.05;#与青蒿琥酯12.5 μg/ml组比较,P<0.05

图2 不同浓度青蒿琥酯对K562细胞存活率的影响
注:*与对照组比较,P<0.05;#与青蒿琥酯12.5 μg/ml组比较,P<0.05
2.2 不同浓度青蒿素对细胞凋亡相关蛋白的影响 培养48 h后,原代细胞及K562细胞株中各组中PI3K、P-AKT、Bcl-2均明显下调(P<0.05),而Bax、caspase-3、PTEN表达上调,见图3、图4。青蒿琥酯25 μg/ml组培养48 h后PI3K、P-AKT、Bcl-2低于对照组及青蒿琥酯12.5 μg/ml组,而Bax、caspase-3、PTEN最高(P<0.05),除25 μg/ml组与50 μg/ml组外,其他各组上述指标两两比较差异均有统计学意义(P<0.05),各组AKT无明显变化,且组间比较差异无统计学意义(P>0.05)。见表1、表2。

表1 不同浓度青蒿素对原代培养细胞凋亡相关蛋白的影响
注:*与对照组比较,P<0.05;#与青蒿琥酯12.5 μg/ml组比较,P<0.05
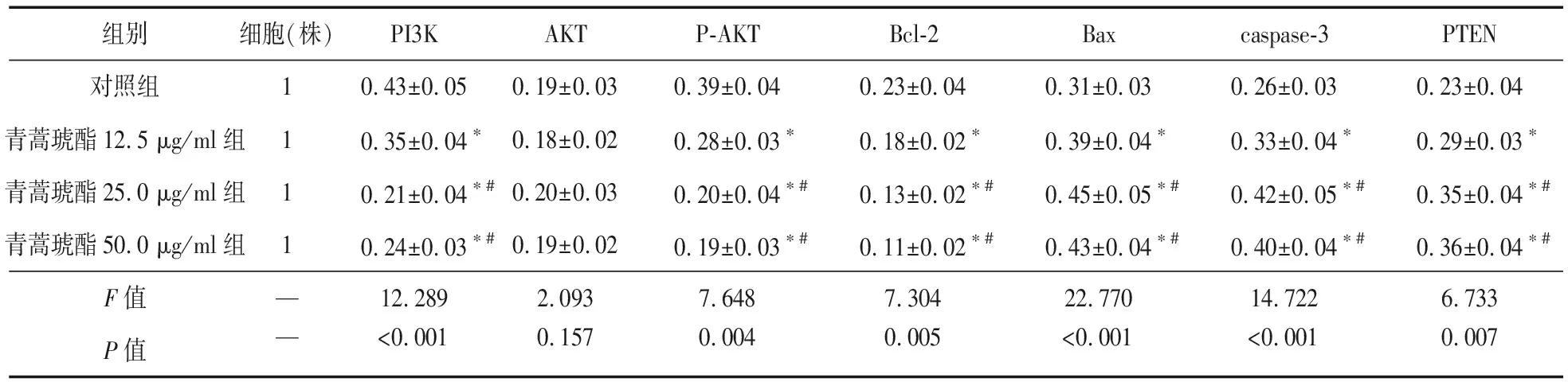
表2 不同浓度青蒿素对K562细胞株凋亡相关蛋白的影响
注:*与对照组比较,P<0.05;#与青蒿琥酯12.5 μg/ml组比较,P<0.05
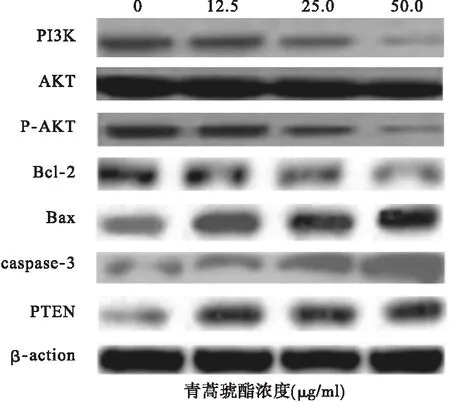
图3 不同浓度青蒿琥酯对AML原代细胞凋亡相关蛋白表达的影响
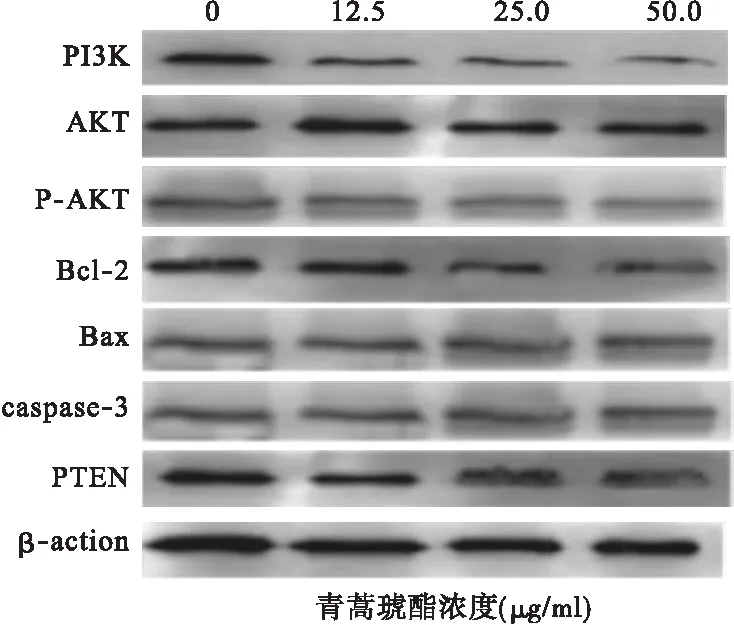
图4 不同浓度青蒿琥酯对K562细胞凋亡相关蛋白表达的影响
3 讨论
急性白血病为儿童时期最常见的恶性肿瘤,可分为急性淋巴细胞白血病(ALL)及AML。其中,AML为临床及生物学特性均有异质性的恶性疾病,其长期治疗仍面临着复发率与治疗相关死亡风险高及化疗相关不良反应多等挑战[5]。随着生物医学研究的进展,研究者针对白血病细胞增殖、分化和凋亡的不同信号转导途径研究出不同的抗白血病药物,其中PI3K/AKT信号通路在近年来受到关注[6-7]。有研究发现,PI3K/AKT信号通路在人白血病细胞株K562细胞增殖与凋亡中发挥着重要作用,其活化有促进K562增殖和抑制K562凋亡的作用,因此是治疗AML的新靶点[8]。青蒿琥酯为中国自主研发的青蒿素类抗疟特效药,作为可溶性青蒿素类衍生物,青蒿琥酯能调控细胞信号传导、抑制肿瘤血管新生、侵袭和转移[9],但其对AML影响的研究较少。
细胞凋亡是一个精细的过程,经复杂的基因编码分析网络调控正常组织的生长及体内平衡参与凋亡,包括死亡受体介导的细胞外途径与线粒体介导的细胞内途径[10],其中线粒体介导的细胞内途径是研究重点。本研究发现,青蒿素呈浓度依赖性诱导人AML原代细胞及K562细胞株凋亡,在培养48 h后,随着药物浓度增加,原代细胞、K562细胞的存活率均下降,意味着更多的AML细胞凋亡,这与王玮琴等[11]报道的不同浓度青蒿琥酯(0、1.87、3.75、7.5、15 μmol/L)青蒿琥酯处理12 h后,K562细胞与阿霉素耐药K562细胞凋亡率依次增加的结果相近,说明青蒿琥酯可呈浓度依赖性诱导AML原代细胞或细胞株K562凋亡,青蒿琥酯为青蒿中提取的倍半萜内酯药物,有显著的肿瘤细胞杀伤作用,且不产生耐药性,其对肿瘤细胞的信号传导通路有调节作用,从而促进肿瘤细胞凋亡[12]。同时,本研究也发现,实验组青蒿琥酯浓度为25.0 μg/ml的细胞存活率最低,25.0 μg/ml组、50.0 μg/ml组的细胞存活率比较差异无统计学意义,表明25 μg/ml可能是青蒿琥酯作用于AML的最佳剂量。
PI3K/AKT信号通路在肿瘤发生发展中发挥重要作用,PI3K的激活能促进细胞增殖与抑制细胞凋亡,AKT为PI3K下游重要的靶激酶,均是PI3K/AKT信号通路的重要组成部分,与各种生理状态下的线粒体凋亡有关[13]。线粒体通路的基本环节为外界凋亡刺激引起线粒体膜通透性改变,导致内膜中细胞色素C释放入细胞质中,形成凋亡小体,激活caspase-9、caspase-3,激活的caspase在细胞凋亡中起主要作用[14],且研究也证实Bcl-2家族经Bax等凋亡基因及Bcl-2等抗凋亡基因的调节在细胞凋亡中发挥核心作用[15]。Bcl-2既可阻断Ca2+从内质网释放,降低Ca2+依赖性核酸内切酶活性,阻断细胞凋亡,也可阻止caspase的活化而发挥其抗凋亡作用。Bcl-2参与抗氧化通路,可改变线粒体膜电位,调控细胞凋亡。而PTEN抗肿瘤作用主要通过其脂质磷酸酶活性,调控信号分子AKT去磷酸化而实现。本研究显示,培养48 h后,原代细胞及K562细胞株中各组PI3K、P-AKT、Bcl-2均明显下调,而Bax、caspase-3、PTEN表达上调,表明青蒿琥酯可能通过抑制原代AML细胞及K562细胞株中PI3K/AKT通路,调节相关凋亡蛋白(Bcl-2、Bax、caspase-3、PTEN)的表达,如活化caspase-3,诱导K562细胞凋亡,上调PTEN抑癌基因表达而抑制AKT信号通路,抑制肿瘤细胞增殖,从而促进AML细胞凋亡[16]。此外,本研究中,青蒿琥酯25 μg/ml组培养48 h后,PI3K、P-AKT、Bcl-2低于对照组及青蒿琥酯12.5 μg/ml组,而Bax、caspase-3、PTEN最高,除25 μg/ml与50 μg/ml组外,其他各组上述指标两两比较差异有统计学意义,证实青蒿琥酯浓度为25 μg/ml时对PI3K/AKT信号通路的抑制作用最佳,此时青蒿琥酯药物浓度也可能达最大。
综上所述,青蒿素类衍生物青蒿琥酯可能通过抑制PIK/AKT信号通路而调控Bcl-2、Bax、caspase-3、PTEN等凋亡相关蛋白的表达,从而促进人AML细胞及K562细胞凋亡。
