眠期家蚕抗菌肽基因的转录表达分析
2019-11-14杨伟克唐芬芬刘增虎董占鹏
杨伟克,唐芬芬,刘增虎,董占鹏
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
【研究意义】抗菌肽(Antibacterial pepetides,AMPs)是一类普遍存在的防御性蛋白质,它是一类具有生物活性的小分子多肽,由20~60个氨基酸残基组成,这类活性多肽多数具有强碱性、热稳定性以及广谱的抗菌活性,在昆虫先天免疫防御系统中发挥了极其重要的作用[1-2]。家蚕幼虫在眠前停止食桑,排空肠内的内容物,经过一定的时间,机体生成新皮蜕去旧皮,进入下一个龄期。就眠蜕皮是桑蚕生长发育过程中非常重要的生理特征之一,然而关于家蚕眠期免疫调控机制的研究鲜见报道,因此开展家蚕眠期免疫应答模式的研究,探究抗菌肽基因的表达变化规律,为丰富和完善昆虫先天性免疫防御机制的提供新线索。【前人研究进展】家蚕作为鳞翅目昆虫的模式生物,其基因组测序已完成,Cheng等通过对家蚕基因组框架图序列的搜寻找到了35条抗菌肽基因序列[3-5]。目前已确认在家蚕基因组中主要存在7个抗菌肽基因家族,即Cecropin、Moricin、Gloverin、Attacin、Lebocin、Enbocin和Defensin家族[6-7]。目前对家蚕抗菌肽基因表达调控的研究报道相对较多,主要集中在外源病原微生物、物理化学因子或特定的环境胁迫诱导的免疫反应,但这些免疫反应均是通过经典的Toll或IMD信号途径调控抗菌肽基因的表达[8-10]。在果蝇的先天免疫研究中,研究者发现饥饿可以调控抗菌肽基因的表达,并且不依赖于Toll和IMD信号途径[11],笔者前期的研究发现,饥饿同样可以诱导鳞翅目昆虫家蚕抗菌肽基因DefensinB的表达[12]。昆虫进入眠期发育时,处于停食的相对饥饿状态和对病原抵抗性的相对薄弱环节,此时机体主动提高其细胞免疫或体液免疫的活性,增强自身免疫力,保护机体免受伤害,这有利于昆虫的正常生长发育[13-14]。【本研究切入点】一般家蚕的幼虫期有4个眠期,蚕进入眠期主要表现为不吃不动,此时自身的能量代谢会变慢,这在一定程度上会影响相应的免疫防御能力。【拟解决的关键问题】家蚕眠期免疫相关因子和基因表达调控的研究少见报道,以四龄眠至五龄起蚕不同发育阶段的血淋巴和脂肪体为实验材料,测定血淋巴的抗菌活性,同时检测分析7个抗菌肽基因的表达变化情况,旨在明确家蚕眠期抗菌肽基因的变化规律,为深入研究和解析家蚕眠期免疫防御机制提供新线索。
1 材料与方法
1.1 供试昆虫
家蚕品系大造(Dazao)人工孵化,在恒温培养箱于25 ℃桑叶饲养。
1.2 仪器与试剂
主要仪器:PCR扩增仪,琼脂糖凝胶电泳仪,凝胶成像系统,低温高速离心机,Bio-Rad公司CFX-96实时荧光定量PCR检测仪、恒温培养箱。主要试剂:高纯总RNA快速提取试剂盒(Bioteke公司,货号RP1202),反转录试剂盒(TaKaRa公司,货号RR047A),荧光定量试剂(Bio-Rad公司,货号1725121)。
1.3 方法
1.3.1 样品采集 在家蚕四龄眠期0、12、24 h和眠起(五龄起蚕)取材。用脱脂棉蘸取75 %的酒精进行体表消毒、晾干,在冰上用昆虫针刺其腹足,收集血淋巴,用沸水煮5 min进行预处理,7500 r/min 离心1 min,上清液用于抗菌活性的测定。同时将家蚕表皮剪开,用镊子刮取脂肪体,保存于1.5 mL Trizol中,液氮保存。根据高纯总RNA快速提取试剂盒(北京百泰克生物技术有限公司)操作步骤提取家蚕脂肪体总RNA。用紫外分光光度计测定RNA样品浓度,并反转录为cDNA。
1.3.2 血淋巴抗菌活性测定 选用革兰氏阳性菌金黄色葡萄球菌(Staphylococcusaureus)和革兰氏阴性菌大肠杆菌(E.coliK12D31)为供试菌株。分别取对数生长期的菌液加入96孔板中,每孔80 μl,加入预处理的家蚕血淋巴20 μl,终体积为100 μl。设1个阴性对照和1个阳性对照组,阴性对照组和阳性对照组分别以PBS缓冲液和卡那霉素替代家蚕血淋巴。混匀后用酶标仪测OD570值,然后置于37 ℃摇床培养,每隔1 h进行测定,利用抑菌曲线表示其抗菌活性。每种处理设5个重复,取其平均值。
1.3.3 抗菌肽基因引物设计 分别选取7个家蚕抗菌肽家族的主效基因,以真核翻译起始因子4A基因(家蚕芯片探针 ID:sw22934)作为荧光定量内参基因运用引物设计软件 Primer Premier 5.0 进行引物设计。引物由华大基因合成,引物序列见表1。
1.3.4 实时荧光定量PCR检测抗菌肽基因的转录活性 参照实时荧光定量PCR试剂盒说明书进行操作,反应程序:95 ℃,30 s →(95 ℃,5 s →60 ℃,30 s)40个循环→65 ℃,5 s(然后每次加0.5 ℃,直到95 ℃,5 s)。Bio-Rad公司CFX-96实时荧光定量PCR检测仪记录实验数据,根据文献报道的公式2-△△Ct计算基因的相对表达量[15-16]。
1.3.5 数据处理 用Excel2016和SPSS 21.0进行数据处理及图表制作。
2 结果与分析
2.1 眠期血淋巴抑菌活性检测
分别取四龄眠0、12、24 h和五龄起的家蚕幼虫血淋巴,以PBS和卡那霉素作为对照组,测定抑菌活性。从图1可以看出,四龄眠0 h和五龄起蚕的血淋巴对大肠杆菌没有抑菌活性,其抑菌曲线与阴性对照组无差异,而四龄眠12 h和四龄眠24 h的血淋巴对大肠杆菌均有显著的抑菌活性(t测验,P<0.05)。而图2结果表明家蚕四龄眠0、12、24 h和五龄起蚕的血淋巴对金黄色葡萄球菌均没有抑菌活性。这一结果暗示四龄眠12和24 h的家蚕血淋巴中产生了某些抑菌物质,但其抑菌活性具有选择性,仅对革兰氏阴性菌株有抑菌作用。
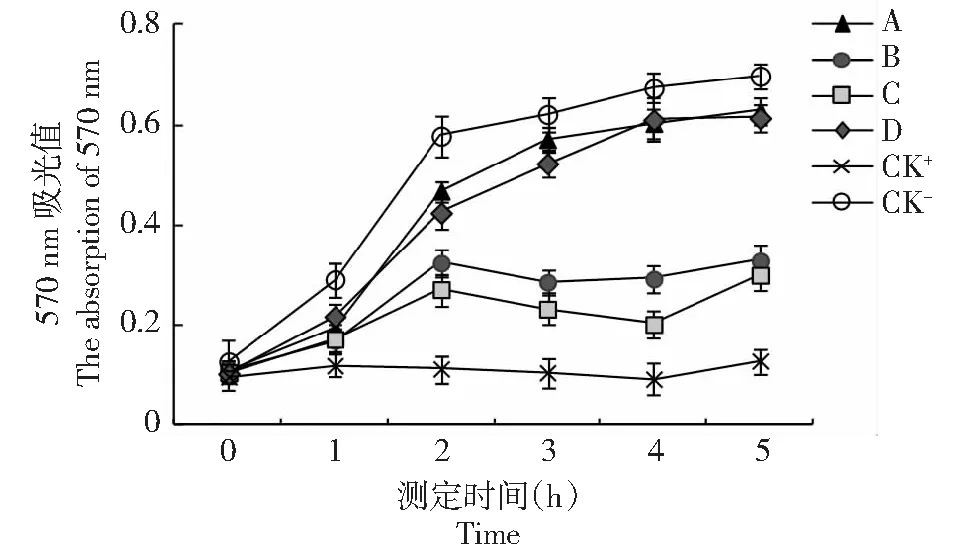
A:四龄眠0 h;B:四龄眠12 h;C:四龄眠24 h;D:五龄起蚕;CK+:阳性对照;CK-:阴性对照。下同A: The fourth molting for 0 hours; B: The fourth molting for 12 hours; C: The fourth molting for 24 hours; D: The newly molted fifth instar; CK+: Positive control; CK-: Negative control. The same as below图1 血淋巴对大肠杆菌抑菌曲线Fig.1 The antibacterial curve of hemolymph against Escherichia coli
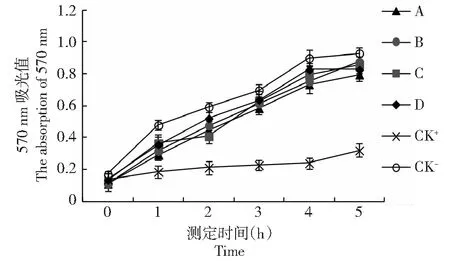
图2 血淋巴对金黄色葡萄球菌抑菌曲线Fig.2 The antibacterial curve of hemolymph against Staphylococcus aureus
2.2 cDNA模板检测
以提取RNA反转录获得的cDNA为模板,家蚕管家基因Actin3的引物进行普通PCR检测。结果如图3所示,所有cDNA模板均能扩增出亮度均一的条带,说明反转录得到的cDNA模板质量较高,可以用于后续实时荧光定量PCR实验。
2.3 家蚕抗菌肽基因的相对表达量测定
家蚕抗菌肽基因主要在脂肪体组织中转录表达,随后分泌到血淋巴中发挥免疫防御功能[17]。抑菌曲线结果显示在四龄眠12和24 h的家蚕血淋巴对大肠杆菌具有一定的抑制活性,表明此时血淋巴中产生了抗菌物质。进一步利用实时荧光定量PCR对家蚕四龄眠0、12、24 h和五龄起蚕脂肪体的抗菌肽基因进行定量分析,结果如图4所示。抗菌肽基因Lebocin3和Moricin在四龄眠0、12、24 h和五龄起蚕的表达量均相对较低,并且在测定的时间范围内无明显变化。Attacin1基因仅在四龄眠24 h表达量较高。在四龄眠0 h至五龄起蚕这段时间内,CecropinB6和Gloverinv2基因出现下调表达的趋势,而Enbocin2和DefensinB的表达量逐渐升高,呈现上调表达趋势。这表明在家蚕四龄眠期,抗菌肽基因的表达规律并不一致。
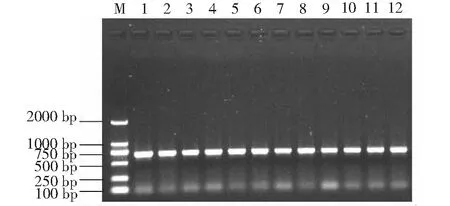
M:DL2000 Marker;1~3:四龄眠0 h;4~6:四龄眠12 h;7~9:四龄眠24 h; 10~12:五龄起蚕M:DL2000 Marker; 1-3: The fourth molting for 0 hours; 4-6: The fourth molting for 12 hours; 7-9: The fourth molting for 24 hours; 10-12: The newly molted fifth instar图3 管家基因Actin3的PCR扩增结果Fig.3 The PCR amplification of Actin3
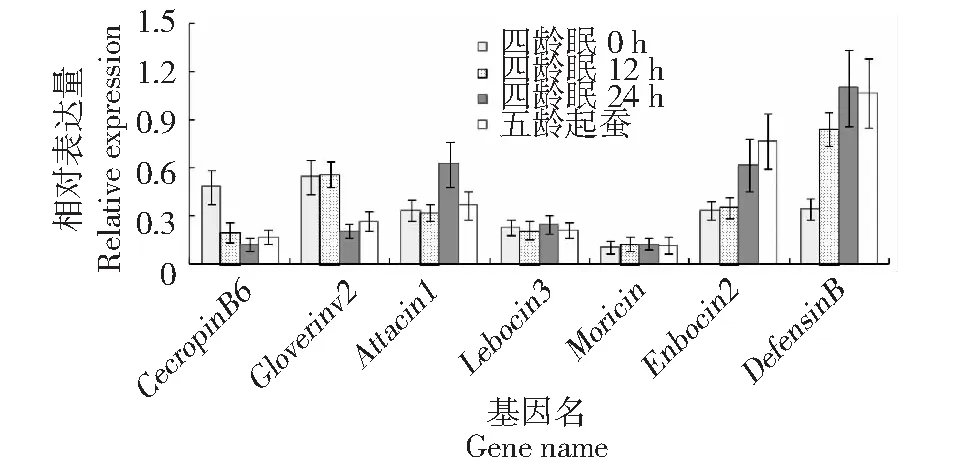
图4 家蚕抗菌肽基因的表达变化Fig.4 The expression changes of antibacterial peptide genes in silkworm
3 讨 论
鳞翅目模式昆虫家蚕体液免疫主要是由血淋巴中的脂肪体应答外源病原微生物的感染,诱导产生抗菌肽,分泌到血淋巴中发挥免疫防御功能[17-18]。昆虫抗菌肽的产生主要通过两条经典的信号传导途径(Toll信号通路和IMD信号通路),其中Toll信号通路主要由真菌和革兰氏阳性菌激活,而IMD信号途径主要由革兰氏阳性菌激活[19-21]。
试验结果显示,家蚕四龄眠12和24 h的血淋巴对革兰氏阴性菌具有一定的抑菌作用,但对革兰氏阳性菌金黄色葡萄球菌却无抑菌效果,表明此时血淋巴中产生了抑菌物质,并且该抑菌物质的抑菌作用具有选择性。荧光定量PCR结果显示,被测试的7个抗菌肽基因出现不同程度的应答,其中Lebocin3和Moricin2个基因在四龄眠至五龄起蚕的不同发育时间段的表达量无变化,表明这2个基因在眠期不发挥免疫防御功能,而CecropinB6和Gloverinv2基因出现下调表达的趋势,推测这2个抗菌肽基因在家蚕眠期能量相对匮乏时受到负调控。另外Attacin1基因仅在四龄眠24 h出现上调表达,而Enbocin2和DefensinB基因从四龄眠开始到五龄起蚕这段时间呈现上调表达趋势,其表达量均是逐渐升高。推测在家蚕眠期Attacin1、Enbocin2和DefensinB可能是受到饥饿、激素或是其它信号的正向调控,促进或激活了基因的表达,主动提高家蚕自身的免疫防御能力。
当昆虫处于饥饿状态,机体能量代谢相对变慢,其自身免疫防御能力会减弱,此时为了防御外来病原微生物的侵染,很有可能会通过其它途径主动增强自身免疫[13-14]。前期对家蚕的研究发现,饥饿胁迫能诱导抗菌肽基因DefensinB的表达,但调控机理未知[12]。而在对果蝇免疫研究中发现,在非感染状态下,饥饿可以诱导抗菌肽基因Drosomycin的表达,并且证实饥饿条件下Drosomycin的表达既不依赖Toll信号通路也不依赖IMD信号通路,而是通过类胰岛素(Insulin-like signaling, ILS)信号水平下降介导FoxO转录因子(fork-head transcript factor)调控抗菌肽基因的表达[11]。家蚕进入眠期,不再进食,自身代谢变慢,此时机体处于相对饥饿状态,相应的免疫力会有所下降或减弱,推测机体通过其它途径诱导抗菌肽等免疫蛋白的产生,主动增强自身免疫,其调控原理及机制是否与果蝇相似,有待进一步去探究和证实。
4 结 论
家蚕四龄眠12和24 h的血淋巴产生了具有选择性的抑菌活性物质,并且仅对革兰氏阴性菌具有一定的抑菌作用。在四龄眠至五龄起蚕的不同发育时间抗菌肽基因Enbocin2和DefensinB的表达量逐渐增加,而Attacin1仅在四龄眠24 h出现高表达,提示这3个抗菌肽基因在家蚕眠期发挥了重要的免疫防御功能,但其免疫调控机理还不明确。
