牦牛VGLL2基因多态性与体尺性状的关联性分析
2019-11-14杨玉梅柴志欣信金伟王吉坤张成福钟金城姬秋梅
杨玉梅,柴志欣,信金伟,王 会,王吉坤,张成福,钟金城*,姬秋梅*
(1.西南民族大学 青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;2. 省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,西藏 拉萨 850009)
【研究意义】牦牛(Bosgrunniens)是生活在高寒缺氧等极端环境的特有牛种,以食草为生,生性强悍,为青藏高原牧民提供主要的生产和生活资料,是高原草地畜牧业不可替代的重要畜种[1]。牦牛是一个全能型的优质资源,其生长性状是选育工作的重要参考,由于粗放式养殖和不健全的良种体系影响牦牛群体的生产力,具体变现为体格小、体重下降和繁殖率降低等生产性能“退化”症候,严重限制牦牛业快速、高效的发展[2]。因此,提高牦牛生产水平成为了育种工作的重中之重。【前人研究进展】残迹(Vestigial)基因在果蝇中与TEAD(TEA domain)/转录调节因子TEF(transcription enhancer factor)相互作用,在果蝇的翅膀和飞行肌肉分化与发育过程中起重要作用[3-6],其家族包含4个成员(VGLL1-VGLL4)。哺乳动物VGLL1-4蛋白含有TEF-1相互作用结构域称为TDU结构域(Tondu domain),并有助与TEAD的组织特异性功能因子结合[7-8]。其中残迹相似基因2(Vestigial like family member2,VGLL2/VITO-1)从小鼠肌肉特异表达基因芯片中筛选出来的,该基因编码具有转录调节因子1(TEF-1)相互作用结构域的蛋白质,编码的蛋白质可以在骨骼肌发育期间充当TEF-1调节基因表达的辅因子,已研究发现编码多种同种型的剪接转录物变体[9]。VGLL2在小鼠发育过程的体节肌节和咽囊中表达,而在成人的骨骼肌中选择性表达[10-11]。研究表明,对小鼠进行过表达研究,过表达VGLL2增强10T1/2细胞MyoD介导的肌源性转换[12]。此外,TEAD1的骨骼肌特异性过表达可诱导成年小鼠快速-慢速纤维型转变[13]。使用反义吗啉代的敲低研究表明,抑制VGLL2表达会减弱C2C12成肌细胞和禽肢肌肉中的MyHC表达[14]。因此,以上研究均显示VGLL2可在体外作用于肌肉分化。VGLL2缺陷小鼠在基础条件下表现出更快的肌肉收缩表型,并且Myh7/miR-208b及其下游转录抑制蛋白的下游靶标在新生儿骨骼肌中表现出缓慢抽搐纤维的显着表达变化[15]。VGLL2在正常骨骼肌纤维分布中具有很强的活性,在体内直接和间接发挥作用。【本研究切入点】鉴于VGLL2基因属骨骼肌分化协同转录因子,可作用于生肌细胞分化,VGLL2基因在骨骼肌中可特异性表达,推测其可能直接或间接影响畜禽的生长发育。迄今为止,关于VGLL2基因的作用机制在人、小鼠、斑马鱼等物种进行了较为深入的研究,但尚未有牦牛的相关研究报道。【拟解决的关键问题】因此,本研究以VGLL2基因为目标基因,分析标记位点对牦牛生长性状的影响,以期为牦牛分子育种提供新的理论方法和技术途径。
1 材料与方法
1.1 试验动物
随机选取西藏申扎牦牛(53)、帕里牦牛(19)、类乌齐牦牛(44)、斯布牦牛(28)和四川麦洼牦牛(94)健康成年个体,剪取耳组织,置于75 %乙醇带回实验室,-80 ℃超低温冰箱保存备用。在样品采集过程中,同时测定牦牛生长性状(包括体重、体高、体斜长、胸围和管围)。
1.2 基因组DNA提取和DNA混合池构建
采用动物组织基因组DNA提取试剂盒(天根生化科技有限公司)提取基因组DNA,用1 %琼脂糖凝胶电泳和紫外分光光度计分别检测DNA的纯度和浓度,-20 ℃保存备用。
分别从5个不同牦牛群体中随机抽取10份DNA模板,利用分光光度计法分3次测定DNA样品浓度(上、中、下层),取其平均值,再分别稀释至50 ng/μl。每个样品取1 μl混匀构建DNA池,于4 ℃环境下静置24~48 h。
1.3 引物设计与PCR扩增
根据牛VGLL2基因序列(NC_037336.1)设计引物,分别针对3个外显子序列利用 Primer 5.0设计3对引物(表 1),引物送英维捷基(上海)生物技术有限公司合成。
引物VGLL2-1和VGLL2-2PCR反应体系(25 μl),其中上、下游引物各1 μl、DNA模板1 μl,ddH2O 9.5 μl,Premix ExTaq预混酶12.5 μl。引物VGLL2-3PCR反应体系为25 μl,上、下游引物各1 μl、DNA模板1 μl、金牌MIX 22 μl。
其中引物VGLL2-2和VGLL2-3PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s、退火30 s(各引物退火温度见表1)、72 ℃延伸45 s,共35个循环,72 ℃延伸8 min,4 ℃保存;VGLL2-1PCR扩增程序:98 ℃预变性2 min;98 ℃变性10 s、退火30 s(引物退火温度见表1)、72 ℃延伸10 s,共30个循环,72 ℃延伸2 min,4 ℃保存;1.5 %琼脂糖凝胶电泳检测。

表1 牦牛VGLL2基因的引物序列
1.4 基因SNP位点的筛查与检测
通过构建好的DNA池扩增牦牛VGLL2基因,PCR扩增产物送生物技术擎科有限公司进行正反双向测序,运用DNAMAN 5.0将测序结果与NCBI上参考目的片段序列进行比对并校正拼接;使用Chromas软件筛选双峰位点(突变位点)。对于筛选到的SNPs位点利用PCR扩增产物直接测序法对各类群牦牛共238个个体进行分型,判定基因型。
2 结果与分析
2.1 PCR扩增产物
用DNA池对所设计引物进行PCR扩增(图1)。由图1可知,PCR扩增产物均为单一特异性条带,与预期大小基本一致,确定为目的基因。用BioEdit 7.0.5生物软件查找双峰位点,预测多态位点,结果见图2。
2.2 VGLL2基因测序结果
对上述3对扩增产物进行测序,结果显示,在VGLL2-2引物的PCR扩增片段上发现存在4个突变位点(图2),一处位于外显子G5000A,剩余3处位于内含子(C4868T、C4872G和G4889A)。
2.3 VGLL2基因SNPs的筛查和检测
3个SNPs位点扩增产物经琼脂糖凝胶电泳检测结果表明,G5000A位点包括GG、GA、AA 3种基因型,帕里牦牛包括GA和AA 2种基因型,申扎牦牛、麦洼牦牛、斯布牦牛和类乌齐牦牛包含GG、GA、AA 3种基因型;C4868T位点包括CC和CT 2种基因型,在5个群体中拥有CC和CT 2种基因型;C4872G位点包括CC和CT 2种基因型,麦洼牦牛和类乌齐牦牛含有CC和CT 2种基因型,而申扎牦牛、斯布牦牛、帕里牦牛仅存在CC基因型;G4889A位点包括GG和GA 2种基因型,麦洼牦牛和类乌齐牦牛含有GG和GA 2种基因型,而申扎牦牛、斯布牦牛、帕里牦牛仅存在GG基因型。因C4872G和G4889A位点的GC型和GA型仅在麦洼牦牛和类乌齐牦牛中发现。

M: DAN Marker D2000, 1、2、3:第一、二、三外显子的PCR扩增产物M: DNA Marker, 1,2,3: PCR products of first, second and third exons图1 牦牛VGLL2基因的PCR扩增产物琼脂凝胶电泳Fig.1 Agarose gel electrophpresis of PCR amplified VGLL2 gene in yak
2.4 牦牛VGLL2基因的遗传多样性
2.4.1 基因型频率、基因频率及χ2适合性检验 由表2可知,在C4868T位点中,CC基因型在申扎牦牛、麦洼牦牛、斯布牦牛、帕里牦牛和类乌齐牦牛中的分布频率分别为0.9623、0.7872、0.8214、0.9474和0.7727,为优势基因型。C4872G位点中,GG基因型在麦洼牦牛和类乌齐牦牛群体中为优势基因型。G4889A位点中为优势基因型。G5000A位点中,GA基因型在申扎牦牛、麦洼牦牛和类乌齐牦牛群体中为优势基因型;AA基因型在麦洼牦牛和斯布牦牛群体中为优势基因型。C4868T位点中,等位基因C基因频率在5个群体中分别为0.9811、0.8936、0.9107、0.9737和0.8864,为优势等位基因。C4872G位点中,等位基因G在2个群体中分别为优势等位基因。G4889A位点中,等位基因G在5个群体中为优势等位基因。G5000A位点中,等位基因A在5个群体中为优势等位基因。

图2 牦牛VGLL2基因DNA池部分测序Fig.2 The results of sequencing of VGLL2 fragment in yak

图3 牦牛VGLL2基因4个SNP位点测序Fig.3 Sequencing of 4 SNP sites in VGLL2 fragment of yak
对牦牛VGLL2基因4个SNP位点进行卡方适应性检验(表3),位点C4868T、C4872G、G4889A和G5000Aχ2值均未达到显著水平(P>0.05),符合Hardy-Weinberg平衡状态。

表2 5个牦牛类群基因4个SNP位点等位基因及基因型频率
续表2 Continued table 2

位点Loci牦牛类群Yak group数量Quantity基因型频率Genotypic frequency等位基因频率Allele frequencyCCCTTTCTC4872G麦洼牦牛940.9149(86)0.0851(8)00.95740.0426类乌齐牦牛440.9545(42)0.0455(2)00.97730.0227GGGAAAGAG4889A麦洼牦牛940.9255(87)0.0745(7)00.96280.0372类乌齐牦牛440.9545(42)0.0455(2)00.97730.0227GGGAAAGAG5000A申扎牦牛530.1889(10)0.4151(22)0.3962(21)0.39620.6038麦洼牦牛940.2234(21)0.4362(41)0.3404(32)0.44150.5585斯布牦牛280.0714(2)0.3571(10)0.5714(16)0.250.75帕里牦牛1900.4211(8)0.5789(11)0.21050.7895类乌齐牦牛440.0227(1)0.5227(23)0.4545(20)0.28410.7159

表3 5个牦牛类群VGLL2基因4个SNP位点的Hardy-Weinberg平衡的χ2检验
2.4.2 群体遗传多态性 运用PIC_CALC软件计算多态信息含量,位点C4868T、C4872G和G4889A在群体中的PIC含量均低于0.25,属于低度多态;位点G5000A在群体中的PIC含量均大于0.25低于0.5,属于中度多态(表4),可见不同群体的多态性程度差异较大,其中麦洼牦牛多态性含量最高,为0.3716,帕里牦牛的最低,为0.2771。
2.4.3VGLL2基因多态性与牦牛生长性状的关联性分析 运用SPSS16.0分析软件中的单因素分析,对238头牦牛个体VGLL2基因的2个SNP位点C4868T和G5000A不同基因型与体高、体斜长、胸围、管围和体重等生长性状进行相关性分析(表5)。结果表明,位点C4868T与体高、体斜长、胸围和体重均具有差异显著性(P<0.05)。CC基因型个体体高、体斜长、胸围和体质量显著高于GC基因型。位点G5000A除管围外其他生长性状基本遵循GA基因型个体均值略高于AA和GG基因型个体均值的趋势,但差异不显著(P>0.05)。对138头类乌齐牦牛和麦洼牦牛个体VGLL2基因的2个SNP位点(C4872G,G4889A)不同基因型与体高、体斜长、胸围、管围和体重等生长性状进行相关性分析(表5),C4872G、G4889A位点两种基因型在体高、体斜长、胸围、管围和体重等生长性状上无显著差异(P>0.05)。
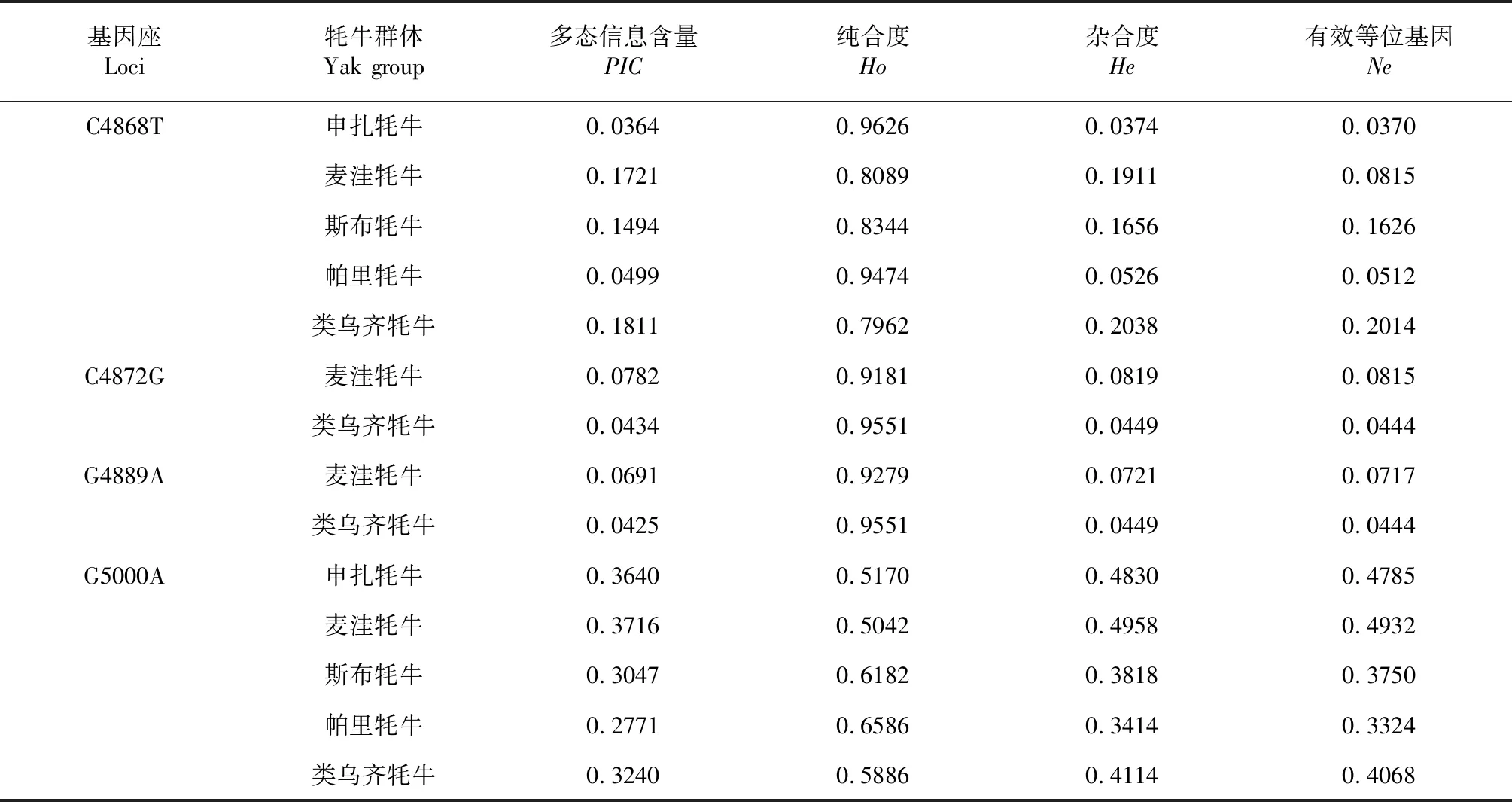
表4 5个牦牛类群VGLL2基因4个SNP位点的遗传多态性指标

表5 牦牛VGLL2基因位点不同基因型与生长性状关联性分析
注:同列不同字母表示差异显著(P<0.05),同列相同字母表示差异不显著(P>0.05)。
Note: Different letters in the same column indicate significant difference (P<0.05), and the same letter in the same column indicates that the difference is not significant (P>0.05).
3 讨 论
VGLL2基因与新生儿肌肉中的TEAD1/4形成复合物,在骨骼肌中发挥协同作用。TEAD1的过表达诱导朝向慢肌收缩表型和卫星细胞增生的过渡[16-17]。VGLL2有助于肌肉特异性基因的TEAD依赖性调节,特别是在慢肌纤维中,以上研究表明,VGLL2基因可能对生长性状有所影响。
目前,对VGLL2基因的研究主要集中在对人的横纹肌肉瘤的研究[18]及对鸡胚胎骨骼肌形成的研究[19],且在其他物种上的研究多集中在调控机理上,而进行多态性研究较少,故可用于该基因多态性研究方面可供参考的文献较少。目前,对牦牛VGLL2基因多态性及性状相关性的研究尚未有报道。本试验通过DNA混合池测序和直接测序法分析了牦牛VGLL2基因的3个外显子的遗传多样性及其与生长性状的关联性,结果显示第一外显子和第三外显子高度保守未发现突变,在第二外显子上存在1个SNP位点G5000A和第二内含子上有3个SNP位点(C4868T,C4872G,G4889A),内含子虽为基因中无编码功能的序列,但其对基因表达调控起着重要作用[20],研究发现,内含子突变够能影响附近的剪切供体和调节原件,进而导致基因编码蛋白发生改变[21]。许多研究证实了这一结论,牦牛PPARδ基因第3内含子g.10045A/G和g.10226A/G变异与体重显著相关[22],牦牛TMEM-18第一内含子861(A/C)和1267(C/T)变异与体重显著相关[23]。可见SNP位点(C4868T,C4872G,G4889A)变异可能不同程度影响VGLL2蛋白的活性,进而影响其有关的生长发育性状。
Hardy-Weinberg平衡说明,4个SNP位点P值均大于0.05,处于Hardy-Weinberg平衡状态,说明4个SNP位点受选择、基因突变等影响较小,可能是人工选育、迁徙和遗传漂变下处于动态平衡中,且对这些位点可以加强选择力度。在遗传多态性分析中,多态信息含量(PIC)、纯合度(Ho)、杂合度(He)和有效等位基因(Ne)等指标从不同方向证实了群体的遗传变异水平。群体的杂合度一般认为与遗传多样性密切相关,群体杂合度越高,说明群体的遗传变异较大,遗传多样性较丰富[24]。群体的杂合度一般认为与遗传多样性密切相关,群体杂合度越高,说明群体的遗传变异较大,遗传多样性较丰富[25]。多态信息含量数据显示,位点C4868T、C4872G和G4889A在群体中属于低度多态,低度多态可能是遗传分化程度较低,缺乏与其他种群的基因交流,可能在该位点的遗传变异程度较小,突变少,使得基因的纯合型得以积累;位点G5000A在群体中属于中度多态,中度多态可能是遗传分化程度较高,与其他种群的基因交流较丰富,可能在该位点的遗传变异程度较大,突变大。数据显示C4868T、C4872G、G4889A仅发现2个基因型,分别缺失TT、CC和AA基因型,这可能是遗传漂变所致,由于该纯合基因型为致死基因,在长期的选择中被淘汰或者是因试验样本数较少,后期可较大样本量进行进一步验证。
本研究通过对牦牛VGLL2基因4个多态位点与生长性状进行相关性分析,结果表明,牦牛VGLL2基因C4868T位点处的不同基因型与牦牛体高、体斜长、胸围和体重显著相关,表现为CC基因型个体体高、体斜长、胸围和体质量显著高于GC基因型(P<0.05)。其余3个位点的不同基因型与牦牛体高、体斜长、胸围、管围和体重差异不显著(P>0.05)。因此推断VGLL2基因上的C4868T位点可能影响牦牛的体高、体斜长、胸围和体重,可作为与牦牛生产性状相关的候选分子标记,为今后的牦牛选育提供理论依据。
4 结 论
牦牛VGLL2基因的C4868T位点与牦牛的体高、体斜长、胸围和体重显著相关,可作为牦牛生产性状分子标记辅助育种的候选位点,可对后续牦牛的体高、体斜长、胸围和体重性状的选择提供理论依据。
