癌结节与结直肠癌患者临床病理因素及预后关系的研究*
2019-11-14
结直肠癌是一种在世界范围内具有高发病率与高死亡率的常见恶性肿瘤[1]。肿瘤的TNM分期是描述肿瘤性质、预后及治疗策略选择的最佳参考。癌结节(tumor deposits,TD)最早于1935年由Gabriel等[2]报道,但直至60年后才首次被纳入第5版TNM分期中,主要依据TD直径是否达到3 mm将其视为原发肿瘤的连续性扩散或区域淋巴结转移(lymph node metastasis,LNM)[3]。第6版TNM分期弃用了上述标准,转而依据肿瘤结节的外形特征进行分类[4]。第7版及第8版TNM分期首次指出TD是结直肠癌患者的预后影响因子,这与当前大多数研究结果一致[5-6]。同时,第8版TNM分期在TD的分期方法上做出了重大更新:将TD阳性同时LNM阴性的病例归入N1c期[7-8]。但第8版TNM分期将所有TD阳性同时LNM阴性的病例均归入N1c期,T3~4aN1a/1b与T3~4aN1c均归入TNMⅢB期,忽略了不同的TD状态及数目在预后上的差异。目前,TD的定义及分类方法尚存在诸多争议,研究者们对TD尚缺乏统一的认识。本研究拟通过回顾性分析探讨与TD的状态及数目相关的临床病理因素,了解TD对结直肠癌预后的影响,并从预后的角度验证第8版TNM分期中TD分期方法的合理性。
1 材料与方法
1.1 一般资料
回顾性分析2013年8月至2017年12月于西南医科大学附属医院住院行手术治疗的1 375例结直肠癌患者的临床资料。纳入标准:1)有完整的病历资料;2)接受完整周期的静脉化疗。排除标准:1)术前相关检查已提示存在远处转移;2)合并有明显影响患者预后的其他疾病;3)接受术前新辅助治疗者;4)术后出现非结直肠癌原因所致的死亡;5)结直肠多原发癌或非原发性结直肠癌;6)患者失访,连续3次电话未能联系的。因本研究的目的在于讨论TD状态及数目与结直肠癌患者预后的关系,故将包括远处转移(Ⅳ期)在内的明显影响预后的因素也定为排除标准。
通过病历资料获取患者的性别、年龄、术前肿瘤标志物(CEA、CA199)、手术日期、术中肿瘤位置、术后病理报告(大体分型、病理分型、分化程度、浸润深度、淋巴结转移数目、肿瘤大小、脉管/神经侵犯情况及TD个数)以及患者目前生存状态等资料。本研究已通过西南医科大学附属医院伦理委员会审批(编号:KY2019029)。
1.2 方法
提取入组患者的相关病历资料并进行随访,随访开始时间为2013年8月,截止时间为2018年12月31日,结局事件定为患者死亡。随访时间为12~64个月。本研究中所有患者分期采用结直肠癌第8版TNM分期(pTNM)。TD定义为结直肠癌周围脂肪组织内远离原发肿瘤且无可辨认的淋巴、血管或神经组织的非连续性肿瘤结节(图1)[7]。需特别指出的是,按照第8版TNM分期,TD阳性组中不存在N0(LNM=0,TD阴性)及TNMⅠ/Ⅱ期(TxN0)。
1.3 统计学分析
采用SPSS 23.0软件进行统计学分析。不同TD状态(阴性或阳性)间各临床病理因素的比较使用χ2检验,不同TD数目组间采用Kruskal-Wallis H检验或Wilcoxon秩和检验分析各临床病理因素的差异,所有P<0.1的临床病理因素纳入Logistic回归分析以筛选独立危险因素。生存分析采用Kaplan-Meier法,生存曲线组间比较使用Log-rank法。使用X-tile软件确定TD数目的cutoff值。P<0.05为差异具有统计学意义。
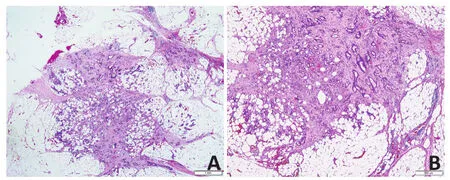
图1 来自同一结肠黏液腺癌病例的两个癌结节
2 结果
经上述标准筛选后共有517例患者符合条件入组,其中TD阳性者91例(17.6%),TD阴性者426例(82.3%)。中位随访时间为33个月(95%CI:31.077~34.923)。患者临床病理特征分布情况见表1。
2.1 TD状态及数目与临床病理因素的关系
TD阴性与TD阳性组相比,单因素分析显示肿瘤分化程度(P=0.020)、T分期(P<0.001)、CEA(P<0.001)、CA199(P<0.001)、脉管侵犯(P<0.001)及神经侵犯(P=0.002)与TD的发生相关,而性别、年龄、肿瘤位置、肿瘤大体类型、病理类型、N分期及肿瘤大小与TD发生无关(表1)。不同TD数目组间比较时发现,肿瘤分化程度(P<0.001)、T分期(P=0.021)、N分期(N1~2,P=0.002)、CEA(P=0.039)及脉管侵犯(P=0.016)与TD数目相关,而性别、年龄、肿瘤位置、肿瘤大体类型、病理类型、CA199、神经侵犯及肿瘤大小与TD数目无关(表1)。将所有P<0.1的临床病理因素因素赋值后纳入Logistic回归分析,结果提示T分期是TD发生的独立危险因素,而肿瘤分化程度是TD数目的独立危险因素(表2)。研究同时显示,CEA与CA199阳性是TD发生的保护因素(P=0.040,OR=1.740,95%CI:1.026~2.949;P=0.013,OR=2.079,95%CI:1.164~3.716),此与临床实际情况相反的结果可能是由于实验中合并有混杂因素所致(表2)。由于例数较少,将不同TD数目下的T2、T3期合并。
2.2 TD状态及数目与预后的关系
全组病例中,TD阴性组的中位生存时间为45个月(95%CI:40.002~49.998),TD阳性组的中位生存时间为25个月(95%CI:21.394~28.606),且TD阴性组的1~5年各累积生存率均优于TD阳性组(表3)。生存曲线显示TD阴性组生存曲线高于TD阳性组,差异具有统计学意义(P<0.001,图2A)。
在TD数目与结直肠癌患者预后的关系上,结果显示,不同的TD数目其预后不同,且随着TD个数增多,患者中位生存时间及1~5年累积生存率逐渐降低。TD=1组中位生存时间为42个月(95%CI:32.479~51.521),累积生存率由96.7%降至26.6%;TD=2组中位生存时间为25个月(95%CI:17.303~32.697),累积生存率由85.2%降至10.0%;TD=3组中位生存时间为21个月(95%CI:7.114~34.886),累积生存率由73.3%降至0;TD≥4组中位生存时间为11个月(95%CI:8.214~13.786),累积生存率由41.4%降至0(表3)。生存分析显示,TD=1组生存曲线高于TD=2、TD=3及TD≥4组,且TD=2组与TD=3组生存曲线均高于TD≥4组,差异具有统计学意义(P<0.05),但TD=2组与TD=3组间生存曲线差异无统计学意义(P=0.186,图2B)。X-tile软件分析结果显示,TD数目的cutoff值为TD=2及TD≥4,即TD=1、TD=2~3与TD≥4三组预后明显不同(图3)。
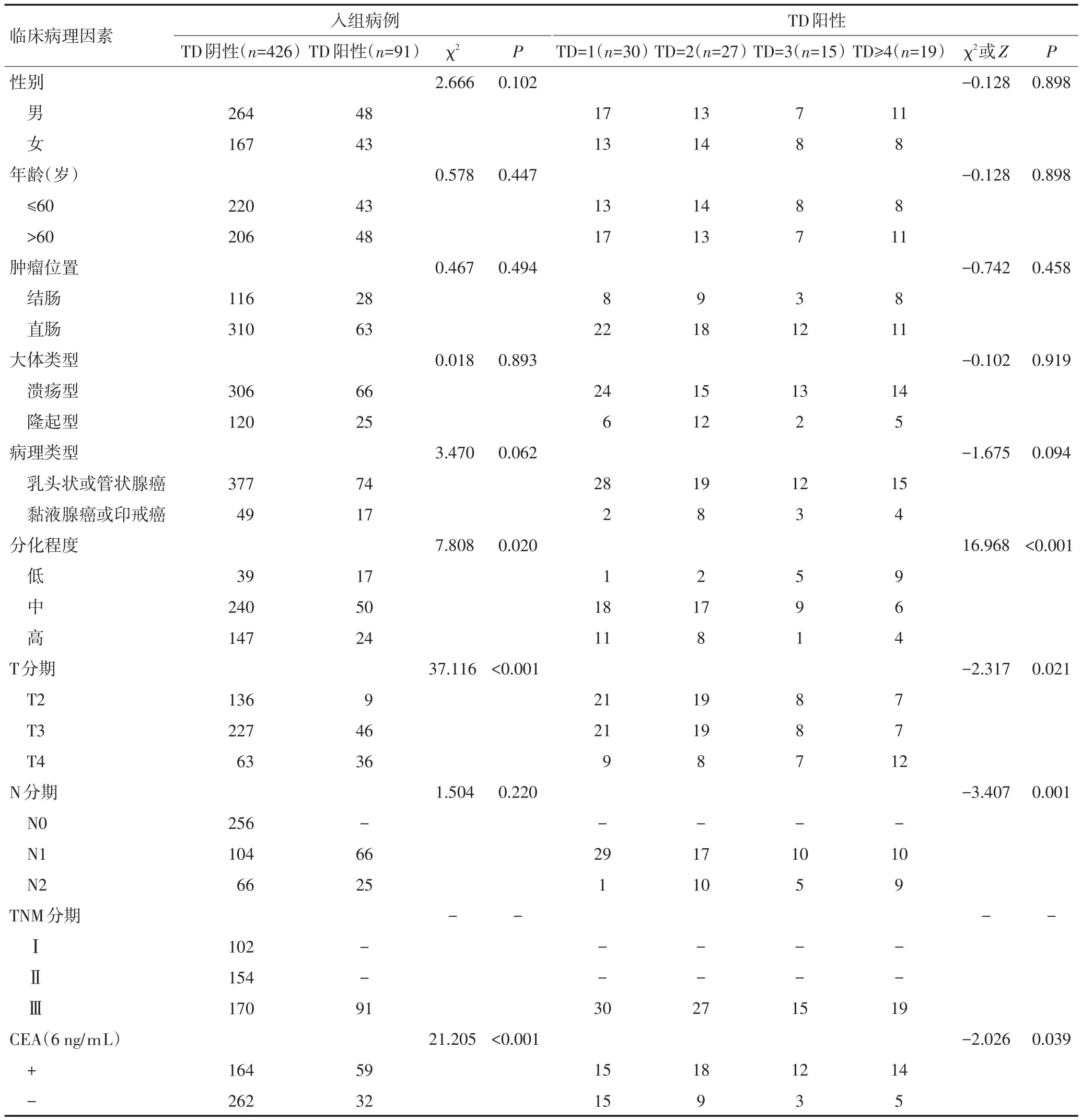
表1 各临床病理因素在不同TD状态及数目下的分布情况 例
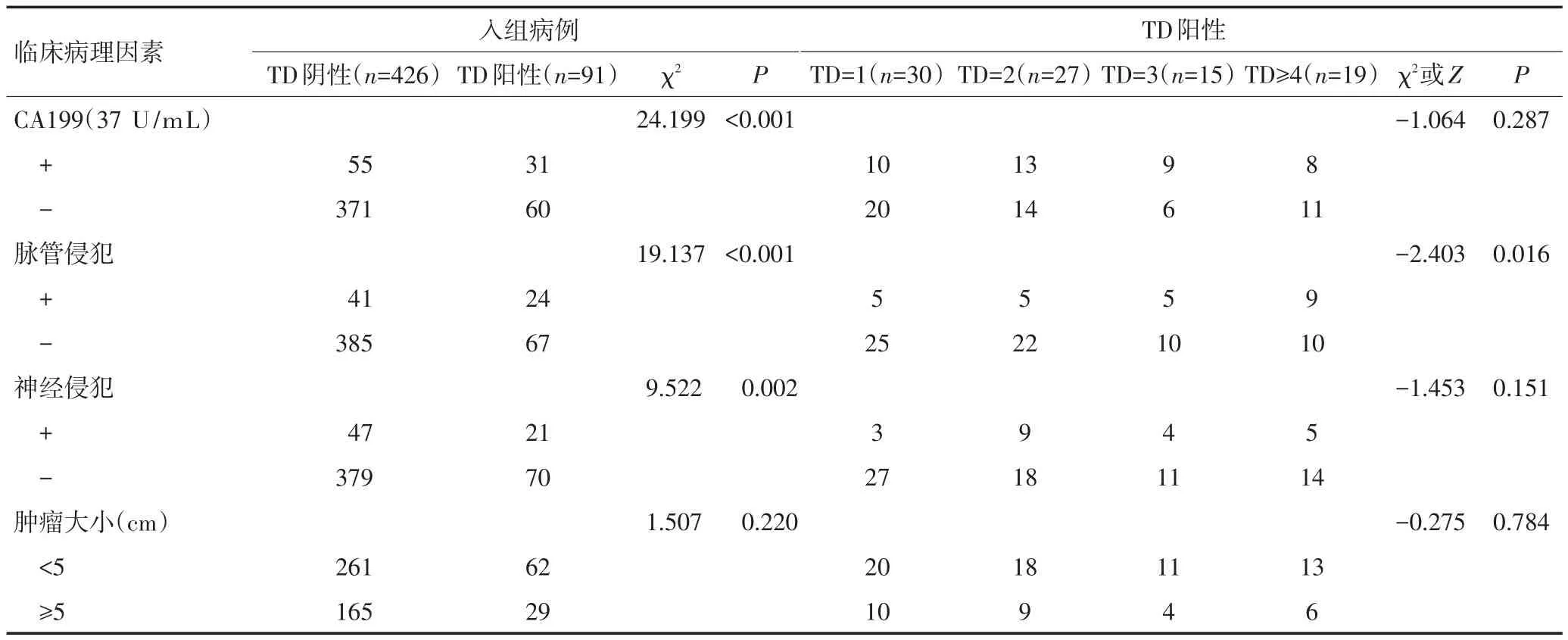
表1 各临床病理因素在不同TD状态及数目下的分布情况 例(续表1)
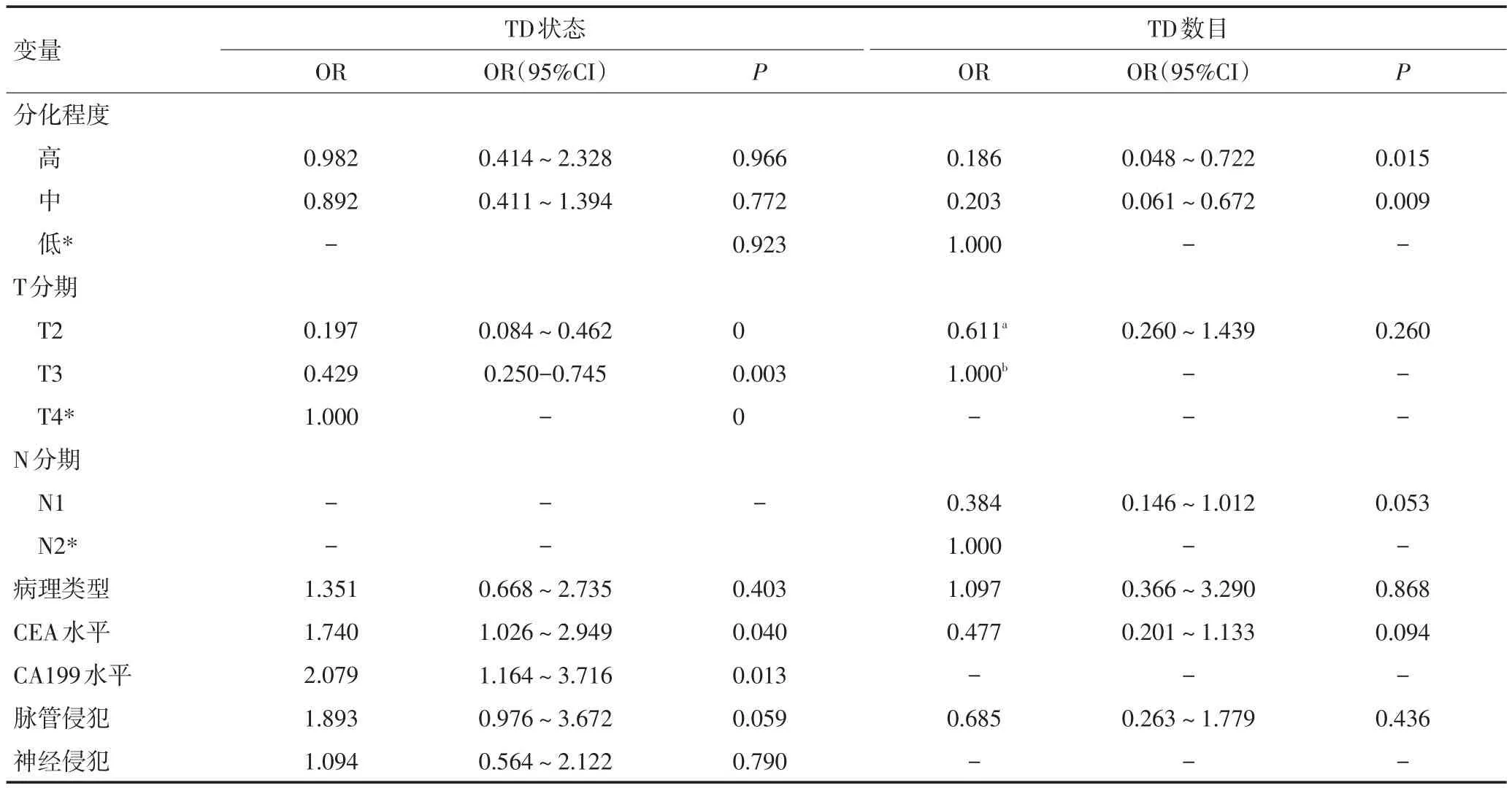
表2 不同TD状态及数目与临床病理因素间的Logistic回归分析

表3 不同TD状态及数目的中位生存时间与生存率

图2 不同TD状态及数目间的生存分析
2.3 从预后的角度验证TD分期的合理性
按照以往不纳入TD的TNM分期系统中的N分期方法(即无N1c期)将91例TD阳性病例进行N分期并做生存分析,结果显示生存曲线N0>N1>N2期,差异具有统计学意义(P<0.05),与N分期等级顺序一致(图4A)。纳入TD后,N1期内不同亚组的生存分析结果显示,N1c期生存曲线明显高于N1b期(P=0.020),N1a期与N1b期(P=0.420)、N1a期与N1c期(P=0.379)间的生存曲线差异无统计学意义(图4B)。但N1c期与合并后的N1a/1b期相比时,两组生存曲线不同,差异具有统计学意义(P=0.042,图4C)。将同属于ⅢB期的T3~4aN1c期与T3~4aN1a/1b期进行生存分析比较,结果显示两组的生存曲线明显不同(P=0.022,图4D)。
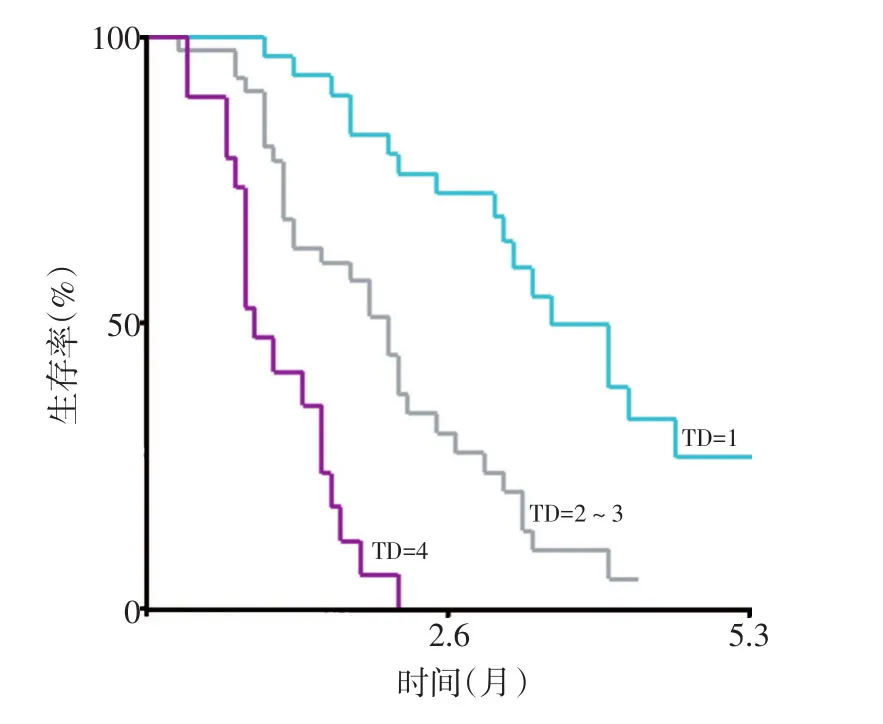
图3 X-tile软件确定TD数目分组的cutoff值及生存分析
2.4 TD与LNM在预后判断上的差异
TD阴性组中不同N分期生存分析显示N0>N1>N2期(P<0.05,图5A),与N分期等级顺序一致。当TD阳性组中TD数目与TD阴性组中LNM数目相同时,生存分析显示,N1a期TD阴性与TD=1组间生存曲线差异均无统计学意义(P=0.509,图5B),而N1b期TD阴性与TD=2~3、N2期TD阴性与TD≥4两组间生存曲线差异均具有统计学意义(P=0.004、P<0.001,图5C,D)。ⅢB(T3~4aN1a/1b)期与ⅢB(T3~4aN0,TD=1~3)期相比,生存分析显示两者预后差异无统计学意义(P=0.166,图5E)。
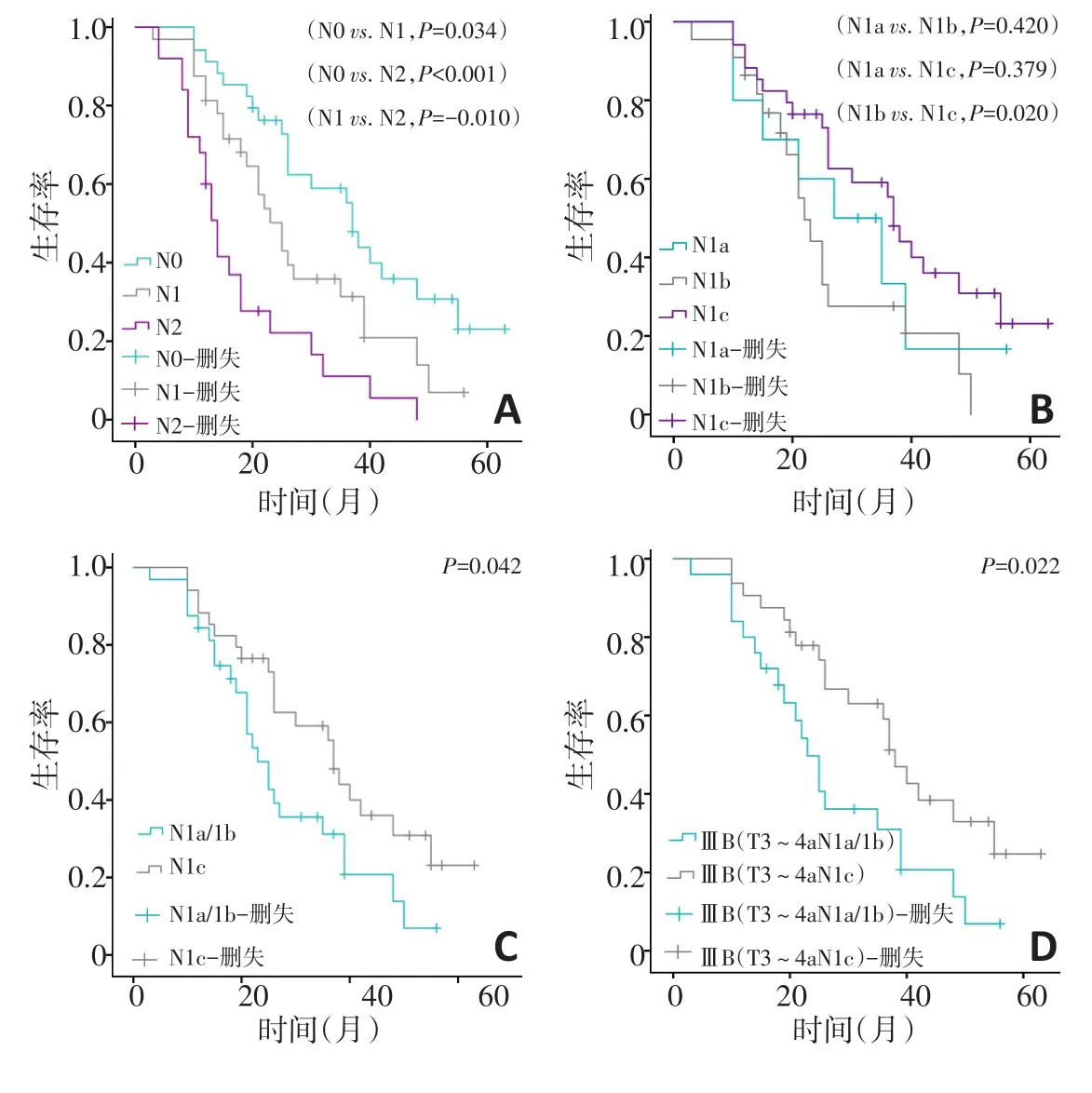
图4 91例TD阳性病例中N分期、N1分期及TNMⅢB分期内各亚组间的生存曲线比较
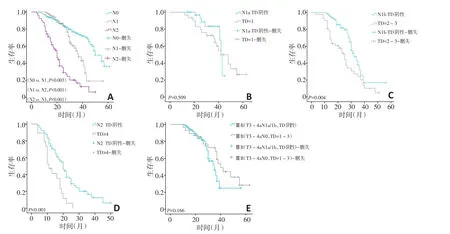
图5 同等数目下TD(TD阳性组)与LNM(TD阴性组)对预后判断的差异
3 讨论
在结直肠癌第8版TNM分期中,所有的TD阳性同时LNM阴性的病例均被归入N1c期,且T3~4aN1a/1b期与T3~4aN1c期均被归入TNMⅢB期,尽管其有着不同的TD数目及状态。本研究分析TD与结直肠癌患者在临床病理因素及预后的关系,并从预后的角度验证了TNM分期中TD分类方法的合理性。
通过分析不同TD状态在各临床病理因素分布上的差异,本研究明确了TD产生的高危因素。结果显示,T分期是TD发生的独立危险因素,而肿瘤分化程度是与TD数目相关的独立危险因素。有研究[9-10]认为TD多数源于对血管、淋巴管及神经浸润而转移所致,且部分结直肠癌[11]及胃癌[12]的研究表明脉管侵犯与TD发生相关。本研究结果显示脉管或神经侵犯与TD的发生相关,但并非TD发生的独立危险因素。
本研究结果显示TD提示预后不良。TD阳性组的中位生存时间、生存曲线及1~5年各累积生存率均明显低于TD阴性组。同时,TD数目与结直肠癌患者预后在总体上呈负相关。从TD=1至TD≥4,患者的中位生存时间及生存曲线总体上逐渐减低,但TD=2及TD=3两组无显著性差异。为确定在预后上的最佳TD分层标准,本研究运用X-tile软件获取TD数目的cutoff值。根据cutoff值将TD分为TD=1、TD=2~3及TD≥4三组,其生存曲线逐渐降低。这说明TD对结直肠癌预后的影响并非随其数目的增加而依次递增,其影响应该是分层的,TD=1、TD=2~3及TD≥4是三个可能的层级。需指出的是,由于TD≥4组的病例数目较少,未再进行细分,不能排除还存在其他分层标准的可能。其他研究也探讨了TD数目与预后的关系,但研究结果存在差异。Goldstein等[13]报道结肠癌中TD=1~2与TD≥3组间的5年生存率不同(P<0.01)。Puppa等[14]的研究显示结肠癌中TD=1、TD=2、TD=3组间的预后不同,TD≥2是结直肠癌预后的独立因素(P=0.008;HR=2.03,95%CI:1.20~3.44)。结合本研究的结果,目前不同TD数目对预后的影响不同或已证实,但具体的TD数目分层标准需要大样本、多中心的联合研究数据以明确。
由于第8版TNM分期将癌结节阳性且区域淋巴结转移阴性(TD阳性LNM阴性)的病例归于N1c期,这导致之前归于N0的TD阳性LNM阴性病例升级为N1c期,位于N1a期与N1b期之后,而现在的N0需同时满足TD阴性LNM阴性。同时,N分期的跃迁导致TNM分期也发生了改变,原先的TNMⅠ~Ⅱ(TxN0)升级为TNMⅢA/B(T1~4aN1/1c)期,所以N1c期在TNM分期中涉及TNMⅢA/B两个亚期。TNM分期是评估预后的主要参考,但T1~2N1、T1~2N1c期 与T3~4aN1、T3~4aN1c期均被分别归类于TNMⅢA、TNMⅢB期,这种分期方法认为N1a/1b期与N1c期在预后上无差异,忽略了TD对预后的影响。为此,本研究绘制了在将TD不纳入于N分期后的91例TD阳性患者生存曲线,结果提示N0>N1>N2期。这说明TD不纳入N分期时预后情况仍与N分期等级顺序一致。为了解按照第8版TNM分期纳入TD后的预后情况,本研究考察了N1期中不同层级的预后情况(按照第8版TNM分期,91例TD阳性患者中无N0期),结果显示N1c期生存曲线明显高于N1b期,N1a期与N1b期、N1a期与N1c期间的生存曲线无显著性差异。实际上,T、N期各单项指标的级别与预后的关系并非是完全对应的,临床工作中更多使用TNM分期(TNMⅠ~Ⅳ)来评估患者预后。因此,本研究拟比较涉及N1c期的TNMⅢA期及TNMⅢB期与预后的关系。但在本研究中,TNMⅢA期病例仅9例,TNMⅢB期57例,故仅比较TNMⅢB期。结果显示,T3~4aN1c期明显高于T3~4aN1a/1b期。这说明将T3~4aN1、T3~4aN1c期均归类于TNMⅢB期可能不合理。
根据X-tile软件的分析结果表明,TD的分组标准为TD=1、TD=2~3与TD≥4。该分组标准下的TD数目与N分期的LNM数目(N1a=1,N1b=2~3,N2≥4)相同。结果显示,TD/LNM=1(TD=1与N1a TD阴性)时两组预后无显著性差异,TD/LNM=2~3及≥4(TD=2~3与N1b TD阴性、TD≥4与N2 TD阴性)时组间有显著性差异,且LNM组对应的预后优于TD阳性组。同时,本研究表明在ⅢB期内,当TD/LNM=1~3时,T34aN1a/1b期与T3~4aN1c期(TD=1~3)两组预后无显著性差异。这表明同等数量的TD与LNM并非通常具有相同的预后,两者存在差异。
另外,关于TD纳入N分期是否正确这一问题也尚存争议。有研究[15-16]认为TD等同于LNM,研究者将TD个数计入淋巴结转移个数评估预后并得出阳性结果。但von Winterfeld等[17]及Goldstein等[13]的研究却表明TD对预后的影响与LNM不同且更为明显,将TD纳入LNM计数并不合理。本研究仅探讨将不同TD数目均归入N1c是否合理,尚不涉及将TD归入N分期是否正确这一问题。
综上所述,本研究揭示了与TD发生及数目相关的临床病理因素,分析不同TD状态及数目间的预后差异,初步明确了在预后上的TD分层标准。预后分析结果提示,结直肠癌第8版TNM分期中TD分期方法可能并不合理,因其未能考虑到不同TD数目及状态在预后影响上的差异。同时,相同数量下的TD与LNM其预后并不完全相同,两者存在差异。但本研究为单中心且TD阳性样本量偏少,这使得结果较为局限,有待后期进行多中心研究及纳入更多病例进行深入探讨。从不断修改的TD定义及分类方法中可以看出,目前学界对TD尚缺乏准确的、共同的认识,当前针对TD的研究也多局限于TD发生及对预后的影响上。本研究希望通过了解TD的生物学特点提出伴TD肿瘤患者的个体化治疗方案,以期获得更好的预后。
