羊膜泪小管支架治疗去势雄兔干眼症的实验研究
2019-11-12朱佩文闵幼兰石文卿
黎 彪,袁 晴,朱佩文,林 启,闵幼兰,石文卿,叶 蕾,邵 毅
0引言
现如今,由于激素水平的改变、长时间阅读或使用电脑、屈光手术、角结膜接触镜的使用、频繁滴用眼药水等因素的影响,干眼症在世界各地的发病率有上升趋势,可达5%~35%,其作为导致慢性眼表疾病最常见原因之一,是一种治疗较为困难的慢性疾病[1-3]。由于泪膜稳定性下降,引起患者视疲劳、眼干、持续性红肿、视力波动、眼内异物感等不适,严重影响了患者的生活质量[4]。目前,针对不同的病因和患者自身的情况,治疗干眼症的方法主要有抗炎药物、抗氧化剂[5]、人工泪液、激素替代治疗、泪道栓塞等,但均存在不良反应,疗效也不尽相同。其中泪道栓塞对于患者的治疗有较好的效果,但由于材料的局限性,对患者可能带来较强的异物感而不易被接受。
羊膜泪小管支架以羊膜为主要材料,将其填入泪道,可以通过堵塞泪道的方式,一定程度上保留残留泪液,从而达到治疗干眼症的目的。同时,相比于目前常用的材料,羊膜泪小管支架具有抑制新生血管形成、抗原性低、炎性反应轻和抑制瘢痕增生等优势[6-7]。现为探究羊膜支架栓塞泪小管对手术阉割雄兔干眼症的治疗作用,为泪小管栓塞治疗干眼症提供实验依据。
1材料和方法
1.1材料成年新西兰雄兔,体质量1.5~2.0kg(由南昌大学医学院动物中心提供),使用裂隙灯显微镜和眼底显微镜筛选出36只无眼疾的健康雄兔,在安静且恒温的环境下喂养。将36只雄性兔随机均分为3组,每组12只,其中A组为假阉割手术组,B组为假植入组,C组为羊膜泪小管支架组。本次实验全部选用雄兔的右眼进行,实验期间保持对所选雄兔的正常饲养。本实验研究符合动物伦理委员会的要求[8],充分考虑了实验动物的利益,减少对实验动物损伤和痛苦,尊重动物的生命。
1.2方法
1.2.1手术方法本次实验所有操作和检查均由同一人于相同操作条件下完成。切去所选36只雄兔的第三眼睑,在眼部抗感染下喂养1wk。参照马轶群等[9]方法,对36只雄兔进行分组,分组情况如前述,B、C两组行双侧睾丸切除术,去除辜丸及附辜,术中对精索静脉和输精管行缝线打结,以阉割雄兔去势。其中,对于A组雄兔仅切开阴囊,不切除睾丸,术后不进行其他处理。检查造模后的所有雄性兔,B、C两组兔角膜干燥、少光泽,角膜荧光素染色(FL)可见散在的点状溃疡。所有造模兔泪液分泌试验(SⅠt)均<10mm/5min则造模成功。B、C两组植入羊膜泪小管支架(图1):B组为阳性空白对照组,于阉割当日植入羊膜泪小管支架10s后取出,观察其眼部情况;C组为实验组,阉割手术当日植入羊膜泪小管支架。分别于植入前和植入后2、4、6wk行FL染色和SⅠt检查,并使用共焦显微镜观察角膜神经变化。
1.2.2泪小管羊膜生物力学特性测定参照文献[10],由同一操作者将泪小管羊膜切割,获取3.5cm×1.0cm的实验样本,将泪小管羊膜放在符合传感器中施力拉伸,待其断裂后记录其抗拉强度(MPa)、断裂伸长率(%)和弹性模量(MPa)。
1.2.3泪液分泌试验弯折刻度滤纸,置于眼内结膜囊的中外1/3处,5min后取出滤纸,量其浸润长短。按照文献的标准[11],若所量得长度<5mm/5min则为干眼。
1.2.4 FL染色和评分于雄兔的结膜囊内滴1%荧光素钠,使其眨眼,获取其FL图像并观察角膜上皮的染色情况。采用12分法进行评分[12]:角膜分4个区域,每区域得分0~3分,0分:未见染色;1分:染色<5个点;2分:染色≥5个点;3分:≥5个点并有溃疡或丝状物染色。
1.2.5共焦显微镜检查检查实验兔角膜神经的变化情况,用非侵入性共聚焦显微镜扫描角膜神经,具体操作参考文献[13]:固定兔头,用5g/L盐酸丙美卡因滴眼液表面麻醉兔眼,调整实验兔,使其平视正前方,每次操作由同一操作者逐渐慢速推进镜头,中央角膜处行全层扫描,获取所需角膜神经图像。
1.2.6神经密度的测定为单个图像中神经纤维的总长度。通常在35~50μm的深度观察角膜下神经丛。角膜下神经纤维的长度由AUTOCAD软件确定。为了计算神经纤维密度,调整每个图像的尺度,使得每帧对应于0.16mm2(400μm×400μm)的实际角膜面积。使用折线命令描绘神经纤维的形状。所有的神经纤维被描绘在单个图像中,然后复制所有描绘的折线(图2),所有折线的总长度通过折线的特征来确定。随后,将测得总长度除以面积(0.16mm2),即神经纤维密度(mm/mm2)。
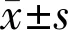
2结果
2.1泪小管支架的生物力学特性比较羊膜泪小管支架的抗张强度为0.709±0.187MPa,断裂伸长率为15.653%±3.023%,而羊膜泪小管支架弹性模量为3.132±1.382MPa,显示泪小管羊膜有一定弹性和抗拉伸性能。
2.2三组羊膜泪小管支架植入前后FL染色与SⅠt结果比较植入羊膜泪小管支架前后,各组FL染色图像:(1)A组角膜表面光滑、清晰,FL染色不明显(图3A、D);(2)B组角膜表面粗糙,角膜上皮可见点片状染色(图3B、E);(3)C组角膜表面较假手术组更为光滑、清晰,无明显点状染色(图3C、F)。三组不同时间的FL评分和SⅠt结果比较,采用重复测量数据的方差分析:(1)三组间FL评分比较,差异有统计学意义(F组间=18.542,P组间=0.004;F时间=16.858,P时间=0.007;F交互=13.653,P交互=0.009);(2)三组间SⅠt结果比较,差异有统计学意义(F组间=15.764,P组间=0.011;F时间=19.781,P时间=0.007;F交互=22.251,P交互=0.003)。植入泪小管支架前,三组间FL评分和SⅠt两两比较,差异无统计学意义(均P>0.05)。羊膜泪小管支架植入6wk后,C组FL评分和SⅠt与植入前比较,差异有统计学意义(均P<0.05);且B组FL评分和SⅠt与植入前比较,差异有统计学意义(均P<0.05)。B组和C组植入泪小管支架后2、4、6wk时三个时间点FL评分和SⅠt结果两两比较,差异有统计学意义(均P<0.05,表1)。

图1B、C组羊膜泪道支架植入示意图A:麻醉后充分暴露兔眼泪小点;B~D:用眼科显微平镊将羊膜泪小管支架沿泪小管走形植入,图B部分植入(植入10s后取出),图C大部分植入(植入后保留6wk),图D完全植入。
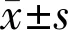

组别眼数干预前干预后2wk干预后4wk干预后6wkFL染色(分) A组121.05±0.401.04±0.220.96±0.281.07±0.31 B组121.00±0.452.10±0.53e3.12±0.64e3.35±0.73e C组121.10±0.331.94±0.64a,c,e2.91±0.91a,c,e3.06±0.75a,c,eSⅠt(mm/5min) A组129.84±1.959.92±1.959.85±2.069.97±1.99 B组129.69±1.557.63±1.65e6.24±1.99e4.58±1.61e C组129.96±1.648.41±2.04a,c,e6.64±1.06a,c,e5.11±1.30a,c,e
注:A组:假阉割手术组;B组:假植入组;C组:羊膜泪小管支架组。aP<0.05vsA组;cP<0.05vsB组;eP<0.05vs干预前。
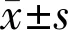

组别眼数干预前干预后2wk干预后4wk干预后6wk神经纤维密度(mm/mm2) A组1220.16±4.9920.09±4.54e20.96±4.73e20.21±4.85e B组1216.67±2.4116.22±2.55e16.89±2.59e16.39±2.76e C组1216.19±2.3917.12±2.61a,c,e18.93±3.12a,c,e19.14±3.51a,c,e纤维分支(分支数/图) A组1210.54±3.0510.54±2.91e10.77±2.95e10.47±2.63e B组127.63±2.517.53±2.45e7.44±2.61e7.52±2.44e C组127.72±2.628.06±2.73a,c,e8.67±2.86a,c,e9.17±2.55a,c,e曲率评分 A组123.29±0.693.31±0.62e3.27±0.71e3.34±0.66e B组121.82±0.621.89±0.69e1.84±0.53e1.79±0.52e C组121.86±0.662.05±0.81a,c,e2.69±0.86a,c,e3.16±0.74a,c,e
注:A组:假阉割手术组;B组:假植入组;C组:羊膜泪小管支架组。aP<0.05vsA组;cP<0.05vsB组;eP<0.05vs干预前。

图2神经密度的测定A:CAD软件获得的共焦显微图像中的角膜神经纤维走行(×120);B:根据共焦显微图像中的角膜神经纤维描绘的折线。
2.3各组植入泪小管支架前后角膜共焦显微镜图像结果A组兔角膜上皮下神经显示为相对直的神经丛,数量多,清晰可见(图4A)。B组角膜上皮下神经可见弯曲,数量有所减少(图4B)。C组角膜上皮下神经较直,与正常雄兔角膜上皮下神经相比,数量略有减少(图4C)。A组雄兔角膜基质内神经为较清晰的直的神经丛(图4D)。B组角膜基质内神经丛弯曲(图4E)。C组的角膜基质内神经与正常雄兔角膜基质内神经比较略有弯曲(图4F)。
2.4各组羊膜泪小管支架植入前后神经检查定量分析结果三组不同时间的角膜上皮下神经纤维密度、分支或曲率评分结果比较(表2),采用重复测量数据的方差分析:(1)不同组间神经纤维密度、分支或曲率评分比较,差异有统计学意义(F=6.143、5.280、7.621,P=0.041、0.046、0.036);(2)不同时间的神经纤维密度、分支或曲率比较,差异有统计学意义(F=6.637、5.748、6.864,P=0.039、0.032、0.044);(3)三组不同组间不同时间神经纤维密度、分支或曲率评分比较,差异有统计学意义(F=5.547、6.326、5.754,P=0.045、0.036、0.039)。

图3三组羊膜泪小管支架植入前后FL染色和SⅠt结果A:假阉割手术组角膜表面光滑、清晰,FL染色不明显;B:假植入组角膜表面粗糙,见点片状染色;C:羊膜泪小管支架组角膜表面较清晰,无明显点状染色;D:假手术组角膜未见有FL染色;E:假植入组角膜上皮见染色斑点;F:羊膜泪小管支架组角膜上皮未见明显点状染色。

图4各组角膜上皮下神经丛和基质内层神经丛的共焦显微镜图像(×120)A、D:假阉割手术组角膜上皮下神经丛、基质内层神经丛,数量多,清晰可见;B、E:假植入组角膜上皮下神经丛、基质内层神经丛,皮下神经可见弯曲,数量有所减少;C、F:羊膜泪小管支架组角膜上皮下神经丛、基质内层神经丛,走形略有弯曲。
3讨论
干眼症作为多因素影响的慢性眼表疾病,其主要是由于泪液的基础分泌量减少,泪液加快蒸发,泪液质量、泪膜稳定性均降低,从而导致角结膜干燥,出现眼部不适症状。泪膜稳定性受神经、体液调节机制的调控。例如,激素水平的变化,尤其是雄激素水平的下降,是干眼发病的关键。有研究发现,低雄激素可能导致睑板腺功能障碍,睑板受损腺体分泌物减少,泪液蒸发加快[14]。因此,激素替代治疗对于干眼症的治疗有着较好的疗效。有研究者前期对鬼针草滴眼液预防、医治阉割雄兔干眼症做了相关的研究,但其作为激素替代治疗的长期不良反应仍难以确定[15-17]。而通过泪小管栓塞方式治疗干眼症,并不会引起患者体内激素水平的改变,极大程度上减少了不良反应的发生。
羊膜是来源于胚胎的透明组织,它本身没有神经、血管、淋巴管[18],且有良好的韧性和生物相容性,因此近年来被广泛用于眼科领域的各种眼表疾病,如眼表化学灼伤、结膜缺损、角膜溃疡和穿孔、睑球粘连、角膜炎症和缺损等[19]。羊膜自身所具有的干细胞和细胞因子可以促进组织修复和愈合、减轻炎症反应、预防组织粘连等。而羊膜泪小管支架很大程度上继承了羊膜的特性,其本身并没有药物的毒性作用,本实验结果也表明,羊膜泪小管支架质地较为柔软,具有良好弹性和韧性,并有一定的弯曲能力和扩张度。且羊膜泪小管支架植入时简单方便,易于操作。羊膜泪小管支架通过抑制干眼症患者眼部的炎症反应,促进泪道上皮功能的恢复,抑制病变组织纤维化,一定程度上改善泪膜的稳定性。同时,此种支架符合泪小管的解剖结构,对泪道的摩擦程度小,极大地减少了机械损伤,并通过泪小管栓塞的方式很大程度上保留了天然泪液,稳定了泪膜的功能,减少了患者眼干等症状。
泪小管栓塞较为安全、可靠,其优势主要体现在以下几个方面:(1)极大限度地保留了天然泪液,使泪膜稳定;(2)栓子可自动调节其直径,以适合术眼泪小管内径;(3)植入后,栓子与泪小管结合紧密,不易脱落;(4)栓子不易发生外漏,降低了眼部异物感出现的几率和眼部炎症发生率。而本实验中的羊膜泪小管支架,便是通过泪小管栓塞的方式对手术阉割雄兔的干眼症产生作用。
前期的研究表明,羊膜泪道支架对于干眼症有一定的预防作用,并着重观察羊膜支架植入前后的FL评分和SⅠt结果,以及角膜共聚焦显微镜下角膜上皮基底细胞、炎症细胞变化情况,而此次研究除了对比羊膜泪小管支架植入前后的FL评分和SⅠt结果外,进一步比较了三组动物干预后不同时间的角膜上皮下神经纤维密度、分支或曲率评分结果。本实验结果显示:在植入羊膜泪小管支架后,阉割雄兔干眼症状和体征有所改善,表明其对干眼症的治疗有作用。植入6wk后,羊膜泪小管支架组SⅠt、FL评分较治疗前有改善,而假植入组则出现了恶化,这说明羊膜泪小管支架通过保留泪液,对泪膜的功能具有稳定作用。这可能是干眼症进展的自然过程,也可能由于泪液的存留而使泪腺的功能有一定程度的改善。而对角膜上皮下神经基质内神经情况的观察,可以发现羊膜泪小管支架组角膜上皮下神经和角膜基质层神经干相对直,与正常雄性兔上皮下神经相比,数量有所减少,且支架植入后2wk和4wk神经密度、神经数量有明显提高,而假植入组和假手术组术后2wk和4wk神经密度、数量增加不明显,甚至减少。而在假植入组中,角膜上皮下神经和角膜基质层神经干弯曲,数量减少。说明羊膜泪小管支架植入后角膜神经的变性程度更低。相较于治疗中常用的泪道栓子,羊膜泪小管支架不易引起泪小管硬化、感染、栓子脱落或移位等,其治疗效果似乎也更具有优势,泪液量增加更为显著,泪膜稳定性改善更为明显[20-22]。
羊膜泪小管支架可以在很大程度上改善阉割去势雄兔干眼症的症状,在减少治疗的不良反应和稳定泪膜的功能方面都能起到一定的作用。且羊膜泪小管支架给患者带来的异物感较低,具有一定的临床应用价值。但其在人干眼症的治疗过程中所可能带来的不良反应犹未可知。同时,其对于不同程度干眼症的治疗效果也需进一步深入研究,以便于为干眼症的治疗提供更多的实验依据。
