中考化学数字化实验题例析
2019-11-11区大柱
区大柱
数字化实验题是全国近几年考查的新趨势,主要从压强传感器、温度传感器、pH传感器、O2浓度传感器、CO2浓度传感器等角度进行考查,常以坐标曲线图的形式呈现。解答这类试题的思路为:①直接读出坐标中的两个变量(横、纵坐标)之间的变化关系(关注起点、终点以及变化的趋势);②对多个变化曲线,要对比它们之间的关系;③结合化学反应过程,形成对变化规律的认识;④根据题干要求作出解答。
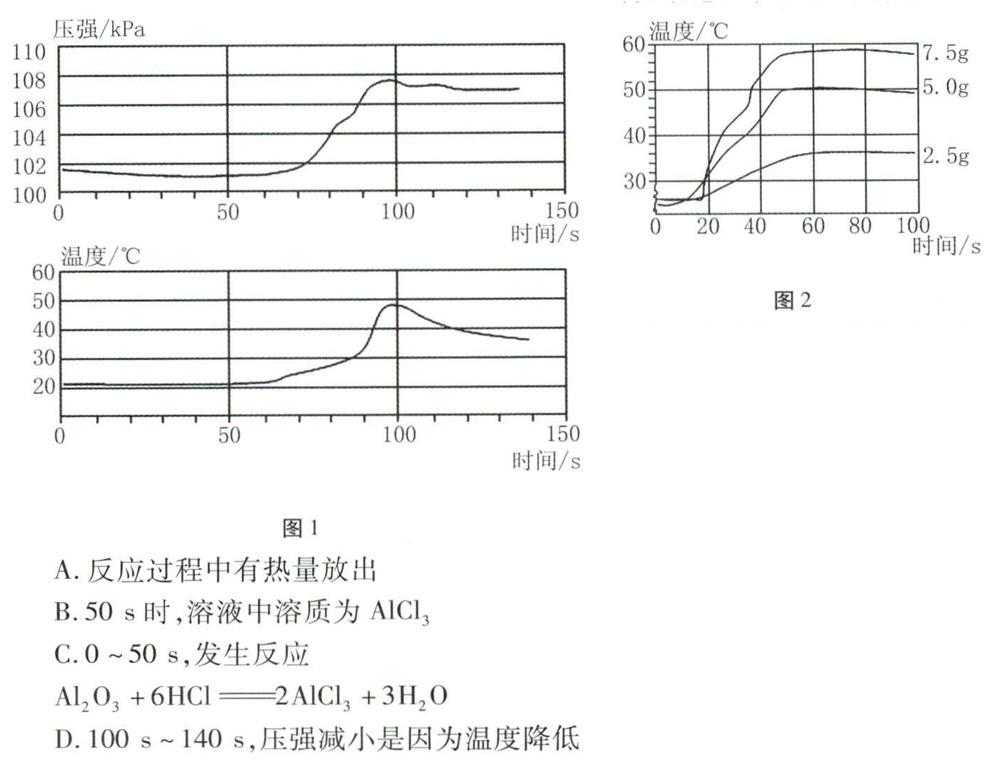
例1(2019年新疆)小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如图1所示。从图中所获信息不正确的是( )。
解析从温度与时间的图像看,50s~100s,溶液的温度升高明显,因此反应过程中放出热量,A正确。50 s,压强开始增大,说明盐酸与铝反应生成了氢气,因此,溶液中的溶质除氧化铝与盐酸反应生成的氯化铝外,还有盐酸,B错误。0-50 s,密闭容器中的压强没有改变,即铝与盐酸没有反应,可确定该段时间内是盐酸与氧化铝的反应,c正确。因为反应过程中容器是密闭的,所以容器内的压强减小,是温度降低的结果,D正确。
答案:B
例2(2019年海南)某实验小组进行物质溶解实验,20°C时,称取2.5 g、5.0 g、7.5 g NaOH固体,分别加入3个小烧杯中(均已盛装50 mL水),均完全溶解。通过数字化实验测得它们在溶解过程中溶液温度的变化情况如图2所示。
依据该实验,你能获得哪些有关NaOH在水中溶解的实验结论?(写出两点,请按示例回答)
示例:证据:曲线均呈上升趋势。结论:NaOH在水中溶解时放出热量。
解析(1)证据:2.5g氢氧化钠溶于水时,温度上升最小;7.5g氢氧化钠溶于水时,温度上升最大。结论:相同条件下,溶解的氢氧化钠越多,放出的热量越多。(2)证据:20℃时,7.5 g氢氧化钠能完全溶解在50 mL水中。结论:氢氧化钠易溶于水。
答案:相同条件下,溶解的氢氧化钠越多,放出的热量越多;氢氧化钠易溶于水(合理即可)
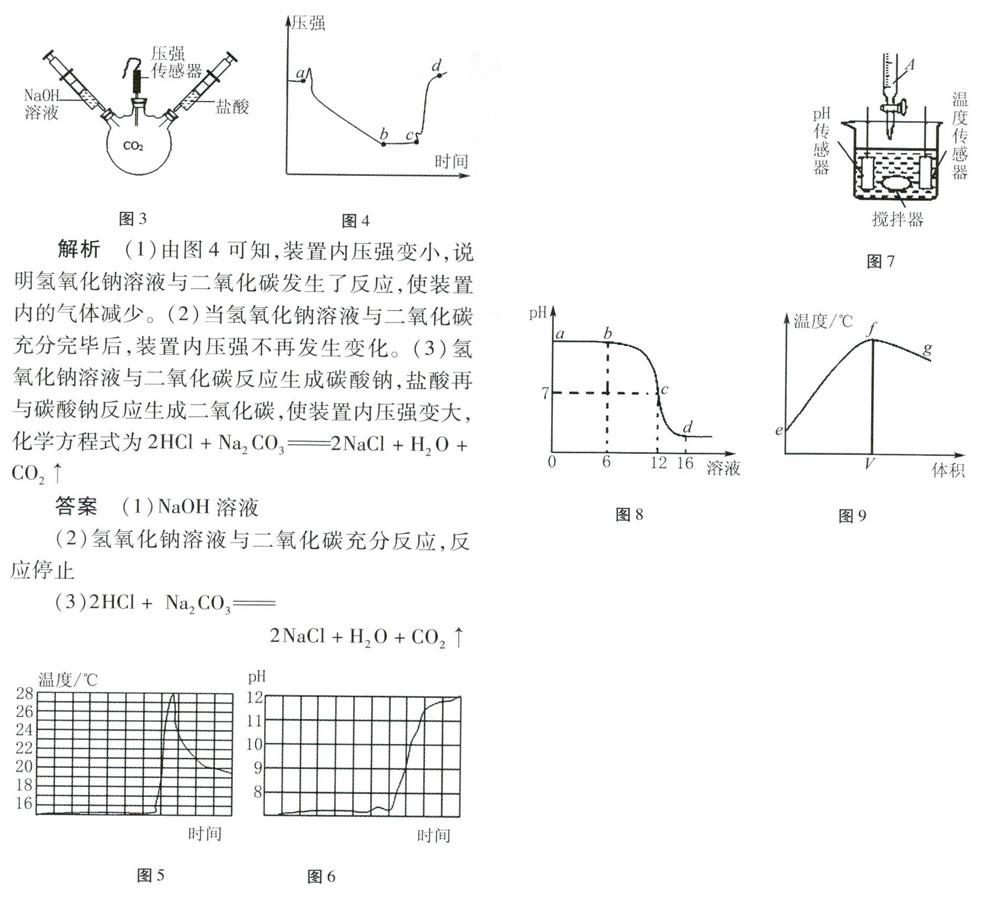
例3(2019年北京)用图3装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图4所示。
(1)先推入的溶液是——。
(2)6c段压强不变,原因是——。
(3)cd段压强变大,用化学方程式解释:
例4(2019年攀枝花)某学习小组运用传感器探究钠与水的反应得到图像,其中图5是反应过程中溶液温度与时间的图像,图6是反应过程中溶液pH与时间的图像。
回答下列问题:
(1)钠与水的反应属于——反应(填“吸热”或者“放热”)。
(2)反应产生的气体为氢气。检验氢气纯度的操作是(请补充完整):用拇指堵住集满气体的试管口,——。实验中能表明氢气不纯的现象是一C)
(3)钠与水反应的化学方程式为——。
(4)将少量金属钠投入稀的氯化铁溶液中,产生了无色气体和一种红褐色沉淀,红褐色沉淀的化学式为——;与反应前溶液相比,反应后溶液质量——(填“增大”、“不变”或者“减小”)。
解析(1)根据图5信息可知,钠和水的反应过程中,温度升高,属于放热反应。(5)检验氢气的纯度,其操作是用拇指堵住集满氢气的试管口,靠近火焰,移开拇指点火,如发出尖锐的爆鸣声,则不纯。(3)根据图6信息可知,钠和水反应后溶液的pH>7,呈碱性,生成了氢氧化钠溶液,化学方程式为2Na+2H2O=2NaOH+H2。
(4)将金属钠投入稀的氯化铁溶液中,钠先与水反应生成氢氧化钠溶液和氢气,氢氧化钠溶液再与氯化铁溶液反应生成红褐色的氢氧化铁沉淀;分析化学方程式可知,反应过程中生成的氢气和氢氧化铁沉淀的质量大于投入钠的质量,故反应后溶液的质量减小。
答案:(1)放热(5)靠近火焰,移开拇指点火发出尖锐的爆鸣声(3)2Na+2H2O=2NaOH+H2(4)Fe(OH)3减小
例5(2019年常州)中和反应是一类重要的化学反应。某同学利用如图7装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图8和图9。
(1)烧杯中发生反应的化学方程式为——;
(2)仪器A中溶液的溶质是——(填化学式);
(3)图9中V的数值最接近——(填“6”、“12”或“16”);
(4)下列说法错误的是——。
A.图8中6点所示溶液中的溶质是NaCI和NaOH;
B.取图8中d点所示溶液加热蒸干所得固体为纯净物
C.图8中c→d所示溶液中NaCl的质量不断增加;
D.图9中e→f变化趋势可说明该反应是放热反应
解析(1)在烧杯中氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为NaOH+HCl=NaCl+H2O。(2)根据图8,反应过程中pH逐渐减小,是将酸逐渐加入碱中,因此仪器A中是盐酸溶液,溶质是HCl。(3)根据图8和图9的信息可知,该反应是放热反应,当二者恰好完全反应时,溶液的温度最高,所以图9中y的数值最接近12。(4)图8中6点所示溶液中pH>7,溶液呈碱性,溶液中的溶质是NaCl和NaOH,A正确;图8中d点所示溶液中pH<7,溶液呈酸性,溶质是NaCl和HCl,氯化氢气体在蒸发过程中逸出了,所得固体为纯净物,B正确;图8中在c点盐酸和氢氧化钠恰好完全反应,c→d所示溶液中,氯化钠的质量不会增加,C错误;图9中e→f变化趋势可说明该反应是放热反应,D正确。
答案:(1)NaOH+HCI=NaCI+H2O
(2)HCI(3)12(4)C
