季节性冻融区农业土壤矿质氮有效性变化规律原位试验
2019-11-11吴从林黄介生
赵 强,吴从林,王 康,常 丹,黄介生
季节性冻融区农业土壤矿质氮有效性变化规律原位试验
赵 强1,2,吴从林2,王 康1,常 丹1,2,黄介生1※
(1. 武汉大学水资源与水电工程国家重点实验室,武汉 430072;2. 长江勘测规划设计研究院,武汉 430010)
为了更好地认识冻融过程对季节性冻融农业区土壤矿质氮有效性的影响,以吉林省长春市黑顶子河流域为研究对象,采用改进的树脂芯法开展了自然状态下表层土壤氮素原位培养试验。结果表明:土壤冻结过程使各下垫面土壤铵态氮含量增加了170%,硝态氮含量减少了19%,进而增加了土壤矿质氮含量及铵态氮所占比例,同时使各下垫面土壤铵态氮含量变异系数减小36%,硝态氮含量变异系数增加了250%。冻土融化过程中,土壤铵态氮含量无显著变化,硝态氮含量显著增加后趋于稳定;冻土融化初期,积雪融化和积雪融化与冻土融化的叠加过程使各下垫面土壤铵态氮含量变异系数分别增加了39%和48%,硝态氮含量变异系数减小了65%和40%,但大部分阶段硝态氮变异系数大于铵态氮。冻融过程中,土壤含水率的变化并未对土壤中铵态氮和硝态氮含量产生显著影响。
土壤;氮素;季节性冻融;农业区;有效性
0 引 言
土壤矿质氮是作物吸收氮素的主要形式,包括铵态氮和硝态氮,通常作为土壤供氮能力和氮素有效性的主要判定指标[1-2]。
在寒冷地区冻融过程是土壤氮素转化的关键驱动力,它通过改变土壤的物理结构和生物学性状来影响土壤中矿质氮含量[3-5]。Oztas和Henry等[6-7]研究表明冻融作用能够降低土壤团聚体的稳定性,将大团聚体破碎成小团聚体,使原先固定在土壤胶体中不可利用的NH4+-N裸露出来[8]。李源等[9-12]对不同区域土壤的冻融试验结果均表明,土壤铵态氮含量随着冻融频次、温差和含水率的增加而增加。Műller等利用15N同位素示踪技术对草地硝化作用进行研究,发现土壤融化阶段硝化速率仅为0.1g/(g∙d),而融化后则达到了11.4g/(g∙d)[13],李源等的研究得到了类似的结论[14]。Masuko等的研究结果表明冻融作用降低了反硝化细菌的数量,但反硝化细菌亚硝酸盐还原酶活性增加了2.5~4.5倍[15-16]。此外,冻融作用一方面可以通过冻结使得植物细根大量死亡,减少植物对氮素的摄取量,另一方面可以将死亡的根系分解为土壤提供氮素,来影响土壤氮素的循环[17-18]。
目前针对冻融作用对土壤矿质氮有效性的研究仍存在以下不足:1)目前冻融循环对土壤氮素转化的试验多在室内采用均质土及固定的冻融温度、频率开展,其试验条件与自然状态下的实际情况偏差较大;2)试验多关注冻结温度、冻融循环次数,而对水分这一在冻融过程中会对土壤结构、通气性具有显著影响的因素鲜有关注;3)研究区域多集中在高寒地区的森林、苔原、草地等受人为干扰较小的自然生态系统冻土,这些区域的微生物群落、氮素来源与低纬度、低海拔,且受施肥、灌溉、耕作等影响的农业区有着显著的区别,所得规律并不完全适用于受冻融影响的农业区。
为此,本文选取受季节性冻融影响显著的农业区—黑顶子河流域作为为研究区域。前期研究表明,春季融雪产流过程不同阶段河道中矿质氮浓度变化较大,玉米田、水稻田和滨水河岸区域是流域矿质氮主要来源,且不同下垫面对不同形态氮素贡献量有着显著差异[19-20]。因此在2015—2016年冻融期采用改进的树脂芯法在不同下垫面土壤中开展原位培养试验,研究自然状态下冻融过程对农业区表层土壤矿质氮有效性的影响,并分析了其主要影响因素。本研究对于解释季节性冻融农业区氮素循环过程,指导该区域农业生产有着重要意义。
1 材料与方法
1.1 研究区域概况
黑顶子河流域位于吉林省长春市双阳区内(125°34′27″~125°42′22″E,43°22′48″~43°29′37″N),是松花江的三级支流,区域内河长16 km,流域面积为75.25 km2,属于温寒带半湿润大陆性季风区气候,年平均气温4.8 ℃,最高22 ℃,最低气温-17 ℃,多年平均降水量624.7 mm,多年平均水面蒸发量1 381.4 mm。封冻期一般为11月中旬至次年3月上旬,期间平均温度和降水量分别为-10.5 ℃和31.8 mm,历史最大冻土深度为158 cm;融化期一般从3月上旬至4月底,平均温度和降水量分别为5.25 ℃和40.7 mm。研究区域土地利用类型主要分为3种,玉米田、水稻田、林地和农村居住区,分别占流域面积的69.1%、12.5%、14.0%和4.4%。根据双阳县土壤普查数据,流域内土壤主要为黑钙土、草甸土、白浆土和暗棕土等。
1.2 原位培养试验
本文采用改进的树脂芯法分别在林地、玉米田、水稻田、玉米田边河岸、水稻田边河岸5种典型下垫面开展土壤氮素的原位培养试验。由于在冻土区取样困难,且试验区典型作物玉米和水稻根系主要集中在20 cm以内土层[21-22],因此选取表层20 cm土壤作为研究对象。试验装置如图1所示。
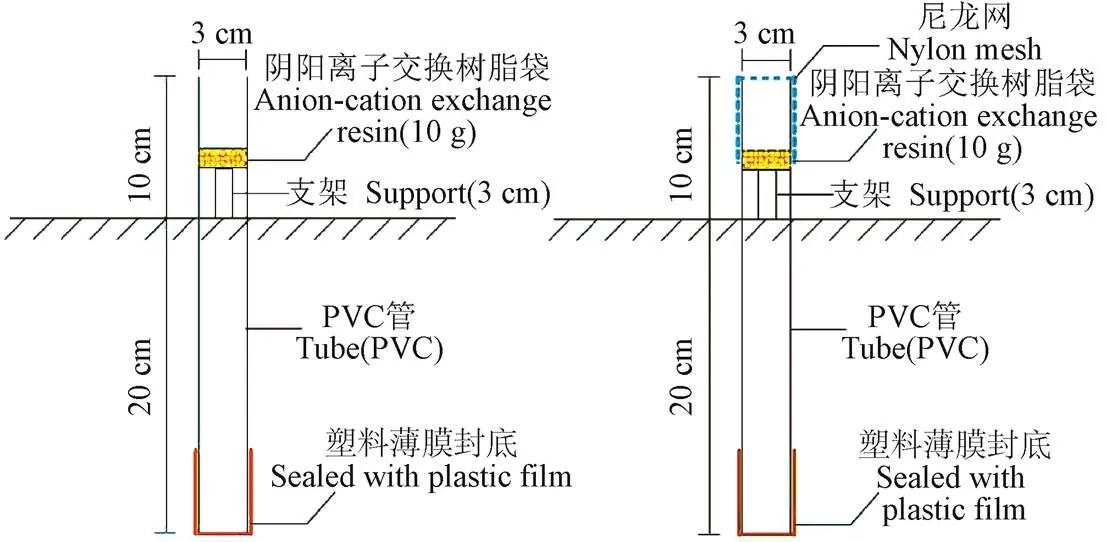
a. 自然降雨(雪)状态 b.削减自然降雨(雪)状态
Di Stefano等提出,可以采取先用PVC管取土,再将盛有交换树脂的尼龙网袋放在PVC管两端,然后埋入土中的方法进行氮素的原位培养,并称之为树脂芯法(resin-core method)[23]。该方法的优点是可以阻止水中或者土壤中的其他离子进入PVC管,又能保证管中的离子不会淋失,且可以保持管内外相似的土壤水分含量和土壤呼吸。
本文采用直径3 cm,长30 cm的PVC管作为培养皿。在冻融区,一方面由于温度梯度的存在,土壤水分会向上运移,另一方面在融化初期大量积雪的融化会造成地表积水,为了减少培养皿底部土壤水分运移的影响以及避免因融雪积水导致的土壤、融雪水、交换树脂接触,因此在土壤冻结前,首先将PVC管打入土中20 cm,然后重新取出,在底部缠绕塑料薄膜后重新埋入土中,在顶端放入一个3 cm的塑料支架后再塞进交换树脂(图 1a)。此外,为了营造不同的土壤含水率环境,检验不同土壤含水率对氮素转化的影响,我们还设置了一些对比试验装置,如图1b所示,在试验装置的顶端用尼龙网包裹,这样可以减少飘入管内的降雪,从而减小融化期土壤含水率。
原位培养试验于2015—2016年冻融期开展,试验装置于2015年10月26日埋入5种下垫面土中,每个下垫面埋入6组图1a所示装置,在林地和玉米田还另外埋入1组图1b所示装置,每组3个重复。装置图1a分别于2015年10月26日(冻结前)、2016年3月3日(融雪前)、2016年3月13日(融雪初期)、2016年3月18日(显著融雪期&冻土融化初期)、2016年3月23日(融雪后期&冻土显著融化期)、2016年3月28日(冻土融化后期)进行了6次取样,每次取一组;装置图1b取样日期为2016年3月24日,与装置图1a即3月23日所取样品对比分析。
所取土样用自封袋密封,用保温箱冷藏,在最短的时间内运回实验室,一部分土壤用烘干法(105 ℃烘8 h)测土壤含水率,另一部分土壤按照1∶5的比例加入氯化钾溶液(2 mol/L)浸提,每个样品3个重复,所得浸提液采用CleverChem 200全自动流速分析仪测定硝态氮和铵态氮含量。
1.3 统计方法
使用SPSS软件对试验结果进行统计分析。采用最小显著差异法(LSD)(Fisher和Tukey检验)来检测在5%显著水平,不同取样点和不同取样时间处理间各形态氮素测量值之间差异。
2 结果与讨论
2.1 冻融期表层土壤水分变化规律分析
图2和图3为冻土融化期流域不同阶段和不同下垫面表层土壤含水率统计图,其中2016年3月23日和2016年3月24日取样是人为营造的不同土壤水分含量的对照处理。由图2a和图3可知,经过尼龙网覆盖处理的原位培养皿内(2016年3月24日)土壤含水率显著小于正常情况下土壤含水率(2016年3月23日)。整体来看流域表层土壤含水率积雪融化前(2016年3月3日)在5%的显著性水平下显著小于融化后(2016年3月13日—2016年3月28日),其他阶段之间无显著差异(图2a),说明积雪融化显著改变了地表土壤含水率,但是由于培养皿边壁及内部离子交换树脂的遮挡,有效地减小了蒸发及降雨的影响,使得整个融化期土壤含水率并未发生显著变化;此外,积雪显著融化前各下垫面之间土壤含水率变异系数最小(0.12),积雪融化后各下垫面之间含水率差异相对较大(0.17),这是由于地形地势的不同,流域内积雪分布不同导致的。
2.2 冻融期表层土壤铵态氮变化规律分析
图4和图5为融化期流域不同阶段和不同下垫面表层土壤浸提液中铵态氮含量统计图。由图4a和图5可知:冻结后土壤铵态氮含量相比于冻结前增加了170%,融化期各阶段之间土壤铵态氮含量无显著差异,与大多数室内模拟试验的结果一致[10-11,14],其主要原因可能是:一方面冻结过程中极低的温度杀死了一部分微生物,造成其细胞破裂释放出一部分铵态氮,另一方面冻融改变了土壤物理性状,引起晶格开放,释放出固定的铵态氮以及之前不可利用的土壤胶体中的铵态氮[8-10,12]。此外,土壤冻结时,冻土层的存在以及土壤颗粒表面冻结后形成的冰膜,均会使土壤颗粒形成封闭的缺氧环境,抑制硝化作用,有利于铵态氮的累积[9-10,12]。而冻融过程中,土壤含水率的变化并未对土壤铵态氮的含量产生显著影响(图2a和图4a)。

a. 不同阶段表层土壤含水率
a. Soil moisture content of different stages
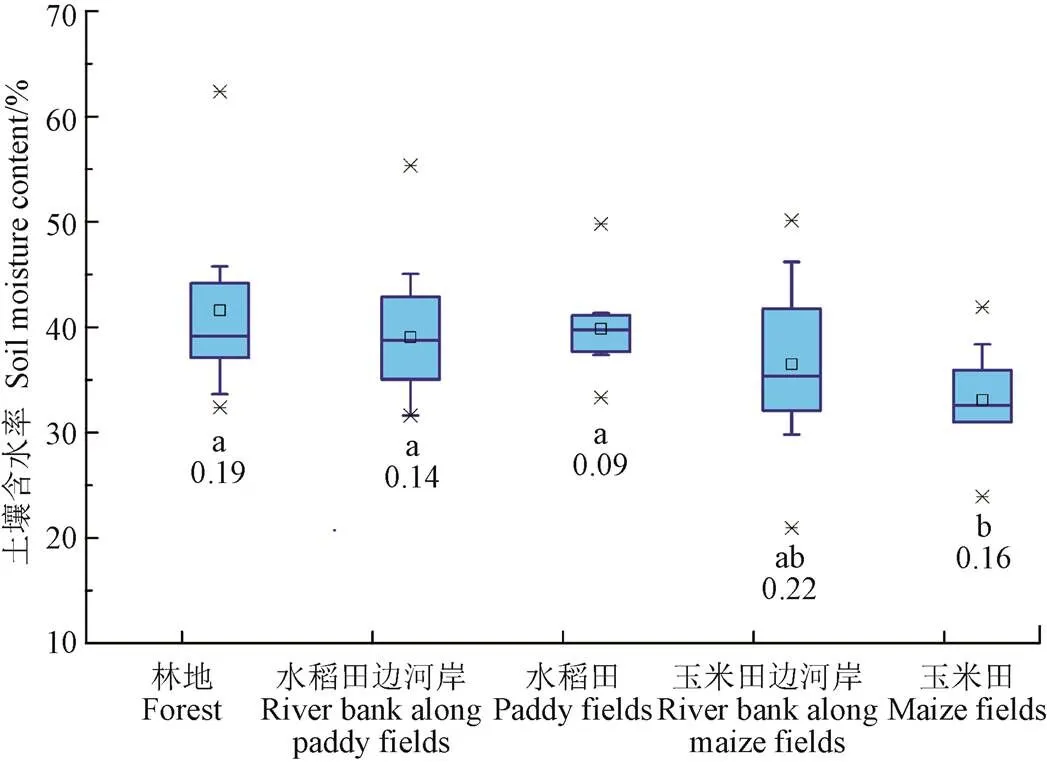
b. 不同下垫面表层土壤含水率
b. Soil moisture content of different underlying surfaces


图2 冻融期不同阶段和下垫面表层土壤含水率
Fig. 2 Soil moisture content of different underlying surfaces and stages during freezing and thawing periods
此外,由图4a可知,土壤冻结过程使流域各下垫面表层土壤中铵态氮含量之间的变异系数减小了36%(0.28到0.18),而积雪融化(3月3日-3月13日)和积雪融化与冻土融化的叠加过程(3月13日-3月18日)则使其变异系数分别增加了39%和48%(从0.18到0.25,从0.25到0.37),其主要原因是土壤冻结过程使得各下垫面之间土壤环境(土壤结构、液态水含水率、通气性、微生物活性等)差异变小,但是由于不同下垫面微生物种群有一定区别,土壤中有机质含量、地表积雪量差异均较大,冻土融化后微生物迅速生长,积雪融化,各下垫面微生物量、土壤含水率等影响土壤铵态氮含量的因素之间差异迅速增大,从而使得融化期各下垫面之间铵态氮浓度差异越来越大。

注:A、B、C、D表示各取样时间不同下垫面在5%显著性水平的差异显著程度,a、b、c、d表示各下垫面在不同取样时间处理之间在5%显著性水平的差异显著程度,未标注显著性水平的处理是因为只测了一个土样,因此未做差异显著性分析,下同。
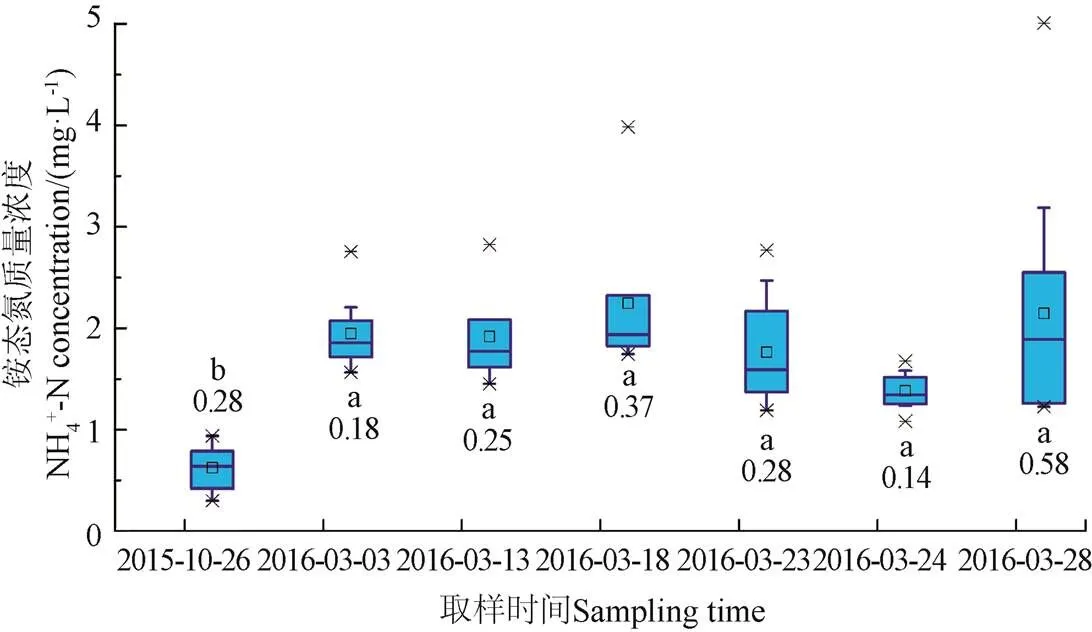
a不同阶段表层土壤铵态氮浓度
a NH4+-N concentration in soil at different stages
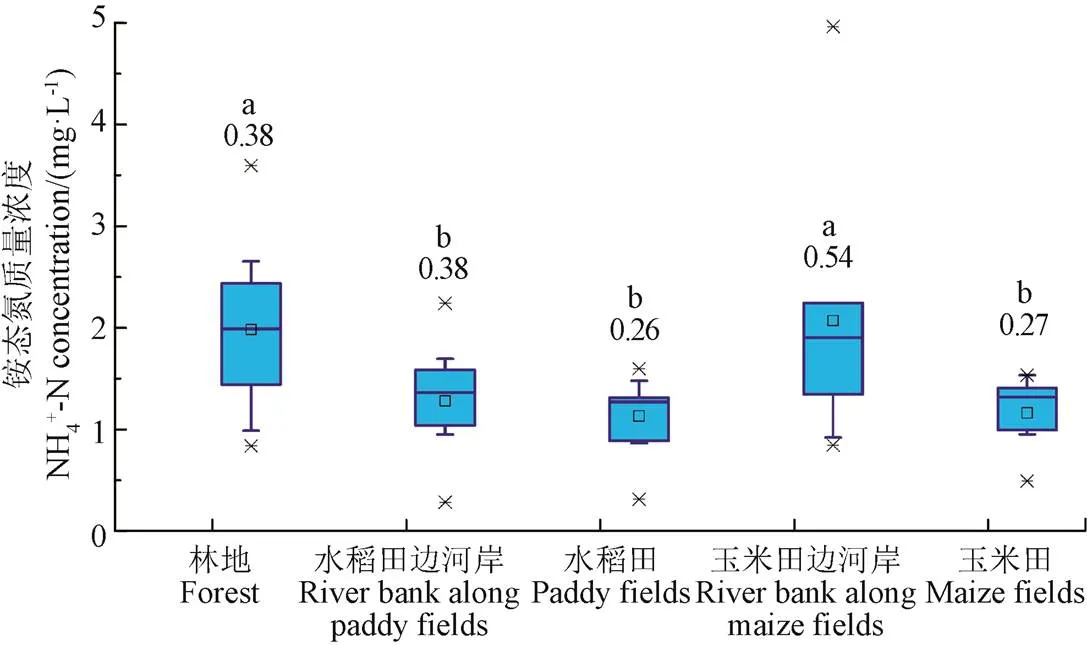
b不同下垫面表层土壤铵态氮浓度
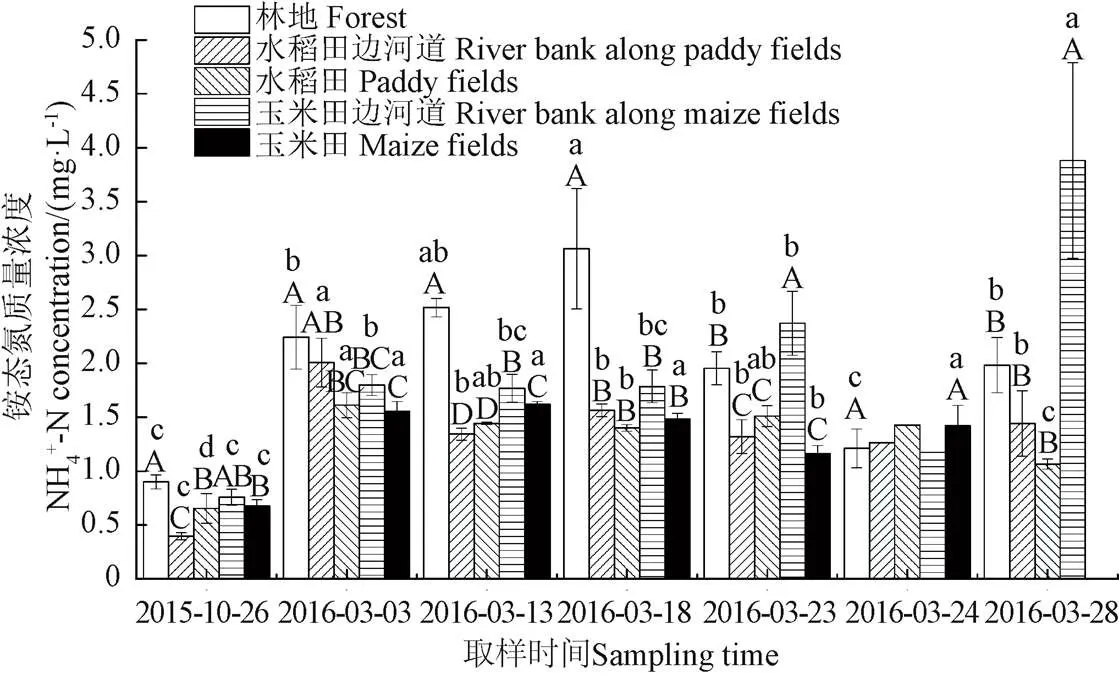
图5 不同下垫面和阶段土壤铵态氮含量
2.3 冻融期表层土壤硝态氮变化规律分析
图6和图7为融化期流域不同阶段和不同下垫面表层土壤浸提液硝态氮含量统计图。由图6a和图7可知,冻结过程(2015年10月26日至2016年3月3日)显著减少了水稻田边河岸、水稻田和玉米田边河岸土壤中硝态氮的含量,而玉米田则显著增加;整体来看冻结后流域土壤硝态氮含量减少了19%,融雪产流初期(3月3日-3月13日)土壤中硝态氮含量进一步减小,并在冻土融化初期(显著融雪期)迅速恢复到冻结前的水平,在进入融雪后期(冻土显著融化期)后不再发生显著变化。此外,经历冻融过程后,土壤含水率的变化对土壤硝态氮的含量无显著影响(图2a和图6a)。
造成以上现象的原因是融雪产流初期(3月3日—3月13日),积雪融化导致土壤含水率增加了4.25%(图 2a),日平均温度仍小于零度,且经历了5个冻融循环,冻土仍未融化,封闭的缺氧环境使反硝化作用强烈,另一方面硝化细菌对外界环境尤其是温度极为敏感,且其恢复速度缓慢,导致硝化反应较弱[10,24-25],进而使得3月13日土壤硝态氮含量显著小于其他阶段。而进入融化期以后(3月18日),日最低气温升到0 ℃以上,冻土融化,土壤通气性变好,硝化细菌逐渐恢复[25],可供硝化的土壤铵态氮含量较高(图4a),土壤中硝化作用加剧,硝态氮含量迅速升高。由于3月18日—3月23日期间又有一次降温过程,日平均气温降到0℃以下,使土壤经历了4次冻融循环,但冻结温度较低,因而相比3月18日,土壤硝态氮含量在3月23日又有显著的减小。
土壤冻结过程使各下垫面土壤中硝态氮含量变异系数增加了250%,而积雪融化(3月3日-3月13日)和积雪融化与冻土融化的叠加过程(3月13日-3月18日)则使其变异系数分别减少了65%和40%(从1.24到0.43,从0.43到0.6),但大部分阶段硝态氮含量变异系数要大于铵态氮(图4a和图6a),主要是因为硝化过程对冻融作用更敏感,且硝态氮受硝化、反硝化、淋溶等多种物理、化学作用的影响,且铵态氮是硝化作用氮素的来源,因此冻融作用对铵态氮造成的差异会进一步显现在对硝态氮造成的差异上。
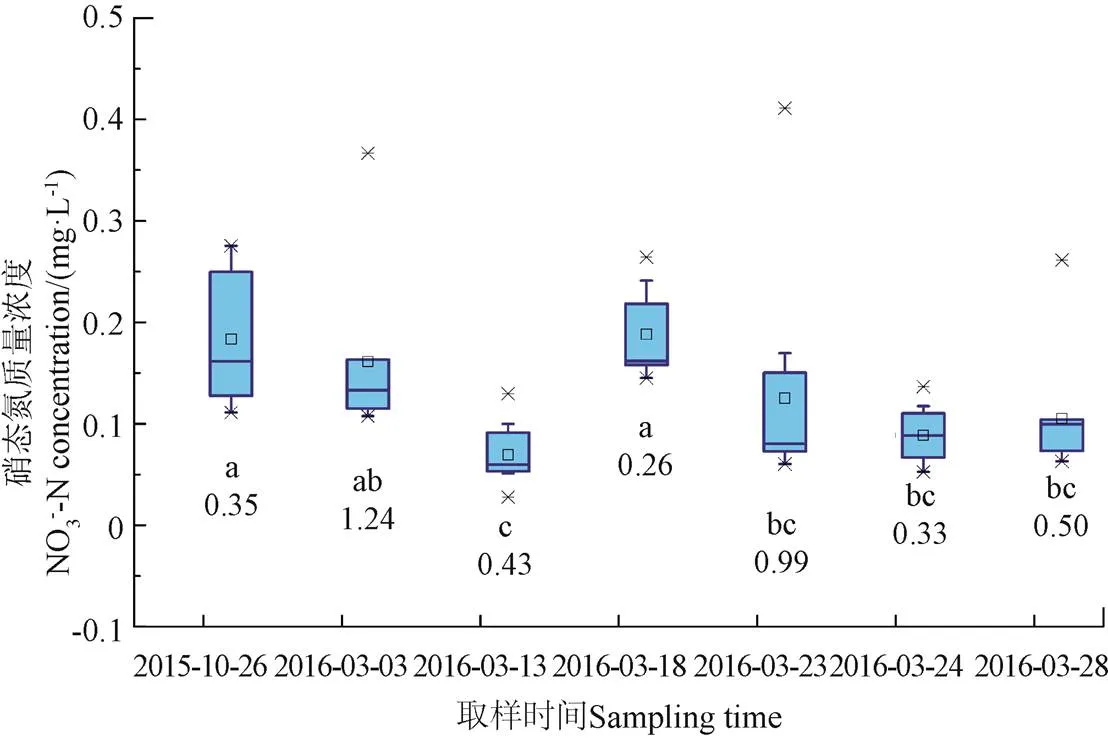
a.不同阶段表层土壤硝态氮浓度
a. NO3--N concentration in soil at different stages
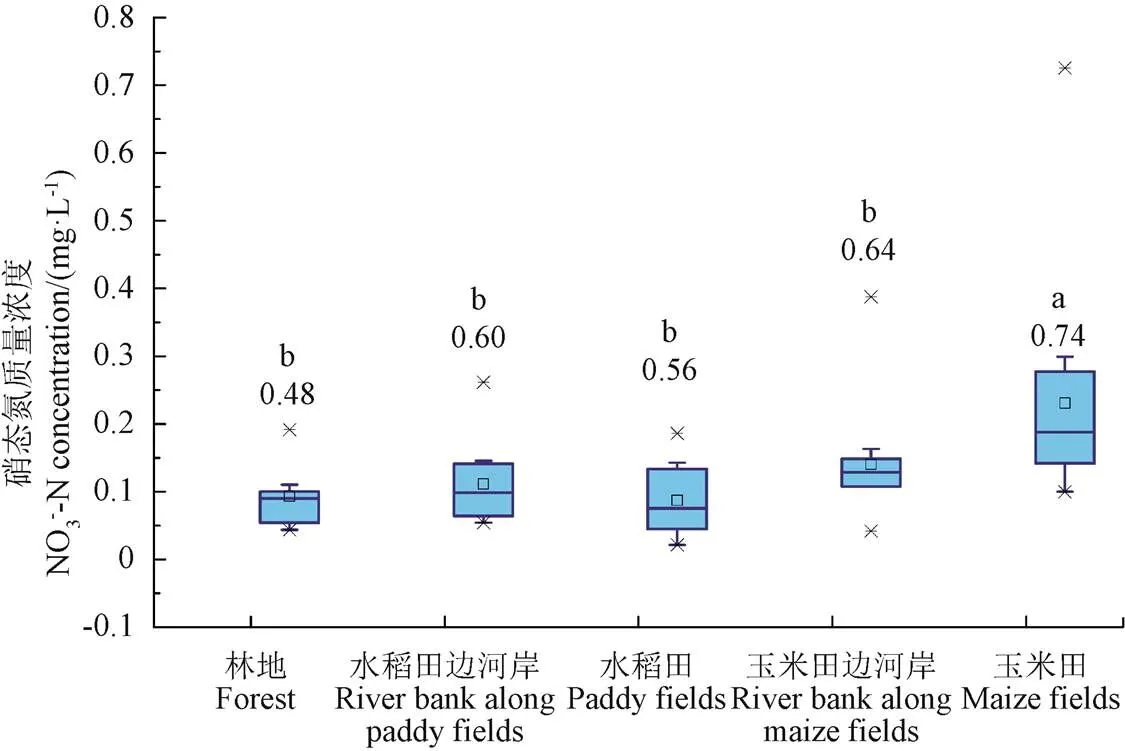
b.冻融期不同下垫面表层土壤硝态氮浓度
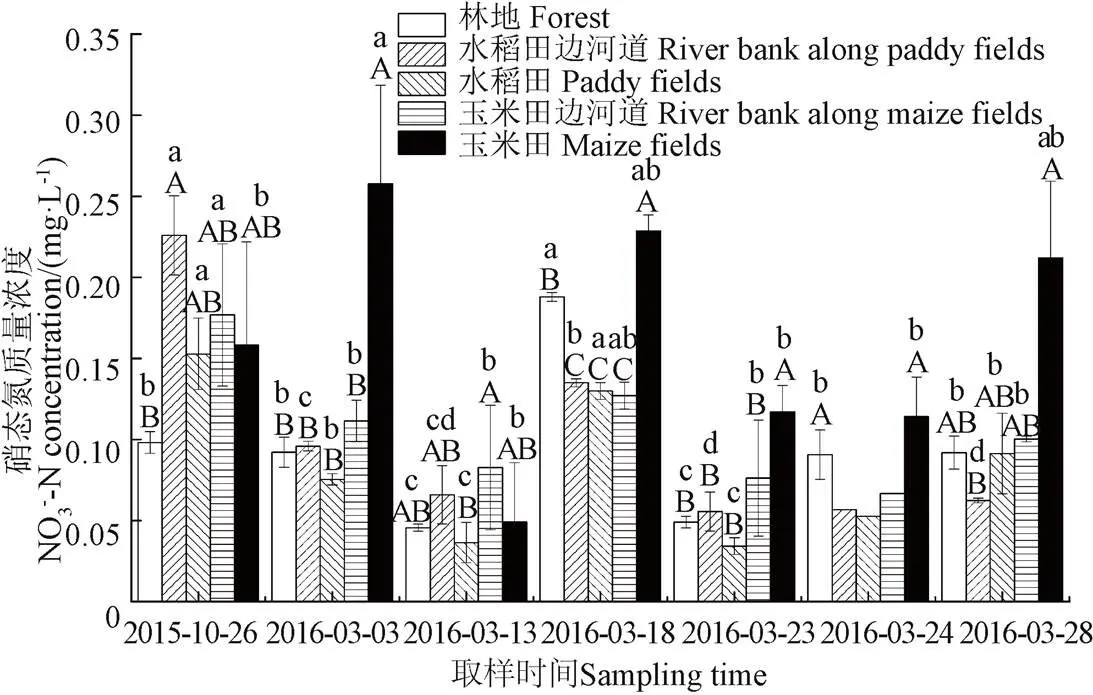
图7 不同下垫面及阶段土壤硝态氮含量
2.4 冻融期表层土壤无机氮变化规律分析
图8和图9为融化期流域不同阶段和不同下垫面表层土壤浸提液矿质氮含量统计图。由于土壤浸提液中铵态氮浓度远大于硝态氮浓度,因此图8和图9规律基本一致,即:2016年3月3日土壤矿质氮含量显著大于2015年10月26日,冻融过程显著增加了土壤的矿化速率,该结论与李源等的研究结论一致,即长期自然状态下的冻融会增加土壤的矿化速率[9],但土壤含水率的变化(3月23日与3月24日取样比较)对土壤矿化速率无显著影响。

a.不同阶段表层土壤矿质氮浓度
a. Mineral nitrogen concentration in soil at different stages
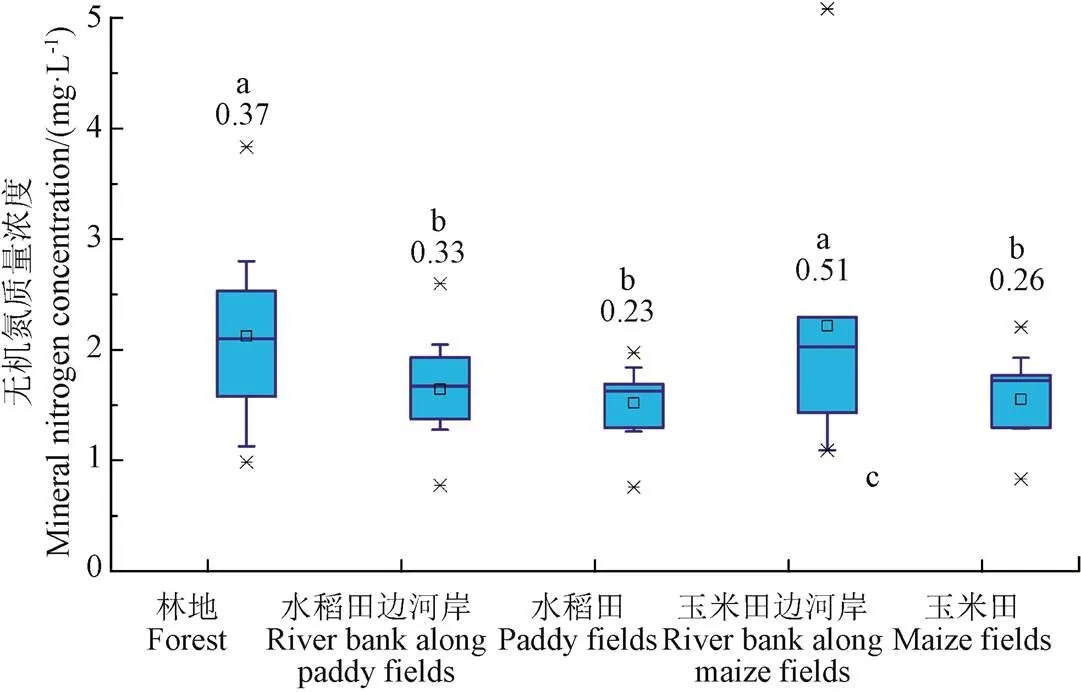
b.不同下垫面表层土壤矿质氮浓度
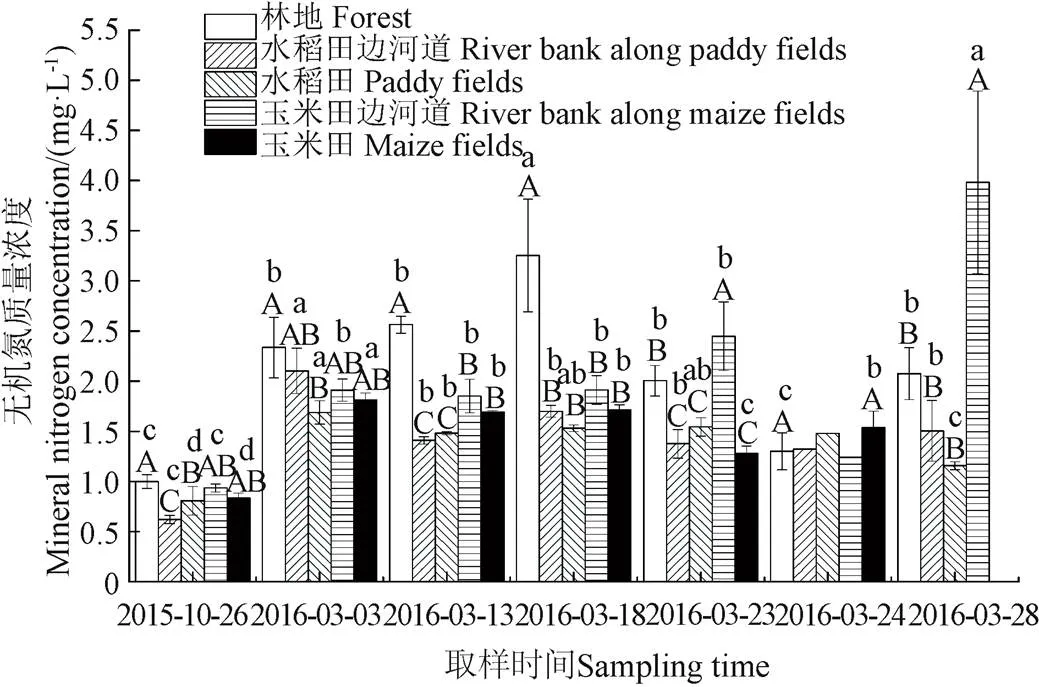
图9 不同下垫面和阶段土壤矿质氮含量
表1为不同阶段土壤浸提液中铵态氮和硝态氮占矿质氮的比例统计表。由表1可知,土壤中铵态氮是矿质氮的主要组成部分,土壤冻结前其所占比例为80.66%,由2.2和2.3节的分析可知,土壤冻结过程显著增加了土壤铵态氮含量并减小了硝态氮含量,因而使得冻土融化期铵态氮在矿质氮中的比例增加到了90%以上,这一结果与谢青琰等的研究结果一致[10]。由于土壤是带负电荷的胶体,铵态氮带正电荷更易于附着在土壤中,硝态氮带负电荷更容易淋失[26-27],因此该作用有利于减少融雪产流初期土壤中矿质氮的流失,增加土壤中矿质氮的有效性。

表1 不同取样阶段土壤铵态氮和硝态氮占矿质氮的比例
3 结 论
本章通过对季节性冻融农业区表层土壤的原位培养试验,探究了冻融过程对表层土壤矿质氮有效性的影响。研究结果表明:
1)冻结过程使各下垫面表层土壤中铵态氮含量增加了170%,硝态氮含量减少19%,进而增加了土壤矿质氮含量及铵态氮所占比例,同时使各下垫面之间土壤铵态氮含量变异系数减小36%,硝态氮含量变异系数增加了250%。
2)在冻土的融化过程中,土壤铵态氮含量无显著变化,硝态氮含量显著增加后趋于稳定。冻土融化初期,积雪融化和积雪融化与冻土融化的叠加过程使各下垫面土壤之间铵态氮含量变异系数分别增加了39%和48%,使硝态氮含量变异系数分别减小了65%和40%,但大部分阶段硝态氮变异系数大于铵态氮。
3)积雪融化显著增加了土壤含水率,但土壤含水率的增加对土壤中铵态氮和硝态氮变化均无显著影响。
[1] 仝利朋,赵京考,吴德亮. 不同氮源对土壤无机氮、玉米产量和氮利用效率的影响[J]. 中国农业科技导报,2019,21(6):101-109. Tong Lipeng, Zhao Jingkao, Wu Deliang. Effects of different nitrogen sources on soil inorganic nitrogen content, corn yield and nitrogen use efficiency[J]. Journal of Agricultural Science and Technology, 2019, 21(6):101-109. (in Chinese with English abstract)
[2] 范志平,李胜男,李法云,等. 冻融交替对河岸缓冲带土壤无机氮和土壤微生物量氮的影响[J]. 气象与环境学报,2013,29(4):106-111. Fan Zhiping, Li Shengnan, Li Fayun, et al. Effect of freezing-thawing on soil dissolved inorganic nitrogen and soil microbial biomass nitrogen in riparian zone[J]. Journal of Meteorology and Environment, 2013, 29(4): 106-111.(in Chinese with English abstract)
[3] 王丽芹,齐玉春,董云社,等. 冻融作用对陆地生态系统氮循环关键过程的影响效应及其机制[J]. 应用生态学报,2015(11):3532-3544. Wang Liqin, Qi Yuchun, Dong Yunshe, et al. Effects and mechanism of freeze-thawing cycles on key processes of nitrogen cycle in terrestrial ecosystem[J]. Chinese Journal of Applied Ecology, 2015(11): 3532-3544. (in Chinese with English abstract)
[4] 陈哲,杨世琦,张晴雯,等. 冻融对土壤氮素损失及有效性的影响[J]. 生态学报,2016(4):1083-1094. Chen Zhe, Yang Shiqi, Zhang Qingwen, et al. Effects of freeze-thaw cycles on soil nitrogen loss and availability[J]. Acta Ecologica Sinica, 2016(4): 1083-1094. (in Chinese with English abstract)
[5] 吕欣欣,孙海岩,汪景宽,等. 冻融交替对土壤氮素转化及相关微生物学特性的影响[J]. 土壤通报,2016(5):1265-1272. Lv Xinxin, Sun Haiyan, Wang Jingkuan, et al. Effects of freeze-thaw events on nitrogen transformation and microbiological characteristics in soils[J]. Chinese Journal of Soil Science, 2016(5): 1265-1272. (in Chinese with English abstract)
[6] Oztas Taskin, Fayetorbay Ferhan. Effect of freezing and thawing processes on soil aggregate stability[J]. Catena, 2003, 52(1): 1-8.
[7] Henry Hugh A L. Soil freeze–thaw cycle experiments: Trends, methodological weaknesses and suggested improvements[J]. Soil Biology & Biochemistry, 2007, 39(5): 977-986.
[8] Deluca T H, Keeney D R, Mccarty G W. Effect of freeze-thaw events on mineralization of soil nitrogen[J]. Biology & Fertility of Soils, 1992, 14(2): 116-120.
[9] 李源. 东北黑土氮素转化和酶活性对水热条件变化的响应[D]. 吉林:东北师范大学,2015. Li Yuan. The Influence of Hydrothermal Conditions Change on Nitrogen Transformation and Enzyme Activities in Black Soil in Northeast China[D]. Tilin: Northeast Normal University, 2015. (in Chinese with English abstract)
[10] 谢青琰,高永恒. 冻融对青藏高原高寒草甸土壤碳氮磷有效性的影响[J]. 水土保持学报,2015,29(1):137-142. Xie Qingyan, Gao Yongheng. The effects of freezing-thawing on soil carbon, nitrogen and phosphorus availabilities in alpine meadow on the Qinghai-Tibetan plateau[J]. Journal of Soil and Water Conservation, 2015, 29(1):137-142. (in Chinese with English abstract)
[11] 张迪龙,张海涛,韩旭,等. 冻融循环作用对不同深度土壤各形态氮磷释放的影响[J]. 节水灌溉,2015(1):36-42. Zhang Dilong, Zhang Haitao, Han Xu, et al. Effects of freeze-thaw cycles on the release of nitrogen and phosphorus in various depth of soil[J]. Water Saving Irrigation, 2015(1): 36-42. (in Chinese with English abstract)
[12] Teepe R, Brumme R, Beese F. Nitrous oxide emissions from soil during freezing and thawing periods[J]. Soil Biology & Biochemistry, 2001, 33(9): 1269-1275.
[13] Müller Dr C, Kammann C, Ottow J C G, et al. Nitrous oxide emission from frozen grassland soil and during thawing periods[J]. Journal of Plant Nutrition & Soil Science, 2003, 166(1): 46-53.
[14] 李源,祝惠,袁星. 冻融交替对黑土氮素转化及酶活性的影响[J]. 土壤学报,2014,51(5):1103-1109. Li Yuan, Zhu Hui, Yuan Xing. Influence of freezing and thawing cycles on net nitrogen transformation and enzyme activity in black soils[J]. Acta Pedologica Sinica, 2014, 51(5): 1103-1109. (in Chinese with English abstract)
[15] Masuko M, Iwasaki H, Sakurai T, et al. Effects of freezing on purified nitrite reductase from a denitrifier,NCIB 11015[J]. Journal of Biochemistry, 1985, 98(5): 1285-1291.
[16] Yanai Yosuke, Toyota Koki, Okazaki Masanori. Response of denitrifying communities to successive soil freeze–thaw cycles[J]. Biology & Fertility of Soils, 2007, 44(1): 113-119.
[17] Cleavitt N L, Fahey T J, Groffman P M, et al. Effects of soil freezing on fine roots in a northern hardwood forest[J]. Canadian Journal of Forest Research, 2008, 38(1):82--91.
[18] Tierney Geraldine L, Fahey Timothy J, Groffman Peter M, et al. Soil freezing alters fine root dynamics in a northern hardwood forest[J]. Biogeochemistry, 2001, 56(2): 175-190.
[19] Zhao Qiang, Chang Dan, Wang Kang, et al. Patterns of nitrogen export from a seasonal freezing agricultural watershed during the thawing period[J]. Science of the Total Environment, 2017, 599/600: 442-450.
[20] 赵强,王康,黄介生,等. 季节性冻土融化期小流域尺度面源污染物迁移规律[J]. 农业工程学报,2015,31(1):139-145. Zhao Qiang, Wang Kang, Huang Jiesheng, et al. Migration rule of non-point source pollutions from seasonal frozen soil in small watershed scale during thawing period[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(1): 139-145. (in Chinese with English abstract)
[21] 刘蕾. 中国玉米根系生物量及空间分布特征[D].北京:中国农业大学,2016. Liu Lei. Biomass estimation and spatial distribution of maize root in China[J]. Beijing: China Agricultural University, 2016. (in Chinese with English abstract)
[22] 张玉. 玉米和水稻根系的空间分布特性及栽培调控研究[D]. 南宁:广西大学,2014. Zhang Yu. Spatial Distribution Characteristics of Root of Rice and Maize and Cultivation Regulation[D]. Nanning: Guangxi University, 2014. (in Chinese with English abstract)
[23] Distefano J F, Gholz H L. A proposed use of ion exchange resins to measure nitrogen mineralization and nitrification in intact soil cores[J]. Communications in Soil Science and Plant Analysis, 1986, 17(9):989-998.
[24] 周旺明,王金达,刘景双,等. 冻融对湿地土壤可溶性碳、氮和氮矿化的影响[J]. 生态与农村环境学报,2008(3):1-6. Zhou Wangming, Wang Jinda, Liu Jingshuang, et al. Effects of freezing and thawing on dissolved organic carbon and nitrogen pool and nitrogen mineralization in typical wetland soils from sanjiang plain, Heilongjiang, China[J]. Journal of Ecology and Rural Environment, 2008(3): 1-6. (in Chinese with English abstract)
[25] Herrmann Anke, Witter Ernst. Sources of C and N contributing to the flush in mineralization upon freeze-thaw cycles in soils[J]. Soil Biology & Biochemistry, 2002, 34(10): 1495-1505.
[26] Jackson-Blake L, Helliwell R C, Britton A J, et al. Controls on soil solution nitrogen along an altitudinal gradient in the Scottish uplands[J]. Science of the Total Environment, 2012, 431(5): 100-108.
[27] MacDonald J A, Dise N B, Matzner E, et al. Nitrogen input together with ecosystem nitrogen enrichment predict nitrate leaching from European forests[J]. Global Change Biology, 2002, 8(10): 1028-1033
In situ experiment on change law of soil mineral nitrogen availability in seasonal freezing agricultural areas
Zhao Qiang1,2, Wu Conglin2, Wang Kang1, Chang Dan1,2, Huang Jiesheng1※
(1.,, 430072 China; 2.,,,, 430010 China)
Northeast China is one of the most important grain production regions in China. It is characterized by seasonal freezing and thawing that is a key driving force of nitrogen migration and transformation due to the associated changes in soil structure such as aggregation, hydrothermal environment, which in turn reshapes soil microbial community and their functions. That substantially alerts the bioavailability of mineral nitrogen. Most studies on effect of freezing-thawing on nitrogen cycle in soil were based either on column packed with homogeneous soil by controlling the freezing and thawing temperature with specified freezing-thawing period, or on watersheds in natural ecosystems such as forest and arctic alpine. There is paucity of work on nitrogen cycle in farmlands with periodic freezing and thawing despite its importance in helping improve fertilizer management. The purpose of this paper is to bridge this gap. In situ nitrogen cultivation experiment was conducted at five fields with different vegetation from 2015 to 2016 in a seasonal freezing-thawing region in northwest China. Modified resin core method was used to take six batches of soil samples before and during the freezing-thawing period for nitrogen analysis. Results show that freezing increased ammonium content in the surface soil by 170% while reducing nitrate content by 19%. In addition, freezing reduced the difference coefficient of ammonium content between different vegetation by 36% and increased the associated difference coefficient for nitrate content by 250%. Thawing did not significantly change the ammonium content, yet asymptotically increased the nitrate content. Snow melting and soil thawing increased the difference coefficient of ammonium content by 39% and 30% while reducing the difference coefficient of nitrate content by 65% and 40%, respectively, at early melting and thawing stage. The substantial increases in soil moisture following snow melting boosted ammonium production at the expense of nitrate nitrogen although at insignificant level.
soils; nitrogen; seasonal freezing; agricultural area; availability
2019-01-17
2019-5-10
国家自然科学基金(51379152,51179203);国家十二五重大科技专项(2012ZX07201-006)
赵强,博士,主要从事农田水环境方面研究。Email:zhaoqiangwhu@163.com
黄介生,教授,博士,主要从事农田排水与水环境以及节水灌溉理论方面研究。Email:410998129@qq.com
10.11975/j.issn.1002-6819.2019.17.017
TV 122
A
1002-6819(2019)-17-0140-07
赵 强,吴从林,王 康,常 丹,黄介生. 季节性冻融区农业土壤矿质氮有效性变化规律原位试验[J]. 农业工程学报,2019,35(17):140-146. doi:10.11975/j.issn.1002-6819.2019.17.017 http://www.tcsae.org
Zhao Qiang, Wu Conglin, Wang Kang, Chang Dan, Huang Jiesheng. In situ experiment on change law of soil mineral nitrogen availability in seasonal freezing agricultural areas[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(17): 140-146. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.17.017 http://www.tcsae.org
