高效液相-串联质谱法测定猪肉中7种青霉素残留量
2019-11-11
苏州出检验检疫综合技术中心/苏州华博检测技术有限公司 江苏苏州 215100
青霉素是含有β-内酰胺基母核结构的一种抗生素,是兽医临床重要的抗生素之一[1]。青霉素类药物的作用特点是通过抑制细菌黏肽转肽酶的活性,阻止细胞壁的合成,从而起到杀菌作用[2]。在动物饲养过程中,该药物主要用于治疗动物的尿道、胃肠道、呼吸道和生殖及皮肤病毒感染的治疗与预防,青霉素族药物在动物源性食品中的残留,会破坏人体肠道正常菌群环境,从而降低免疫力,给人的健康带来危害[3]。
目前,用于动物源性食品中青霉素族检测的方法,主要有微生物法及仪器测定法。微生物法是通过对特异微生物的生理机能、繁殖代谢的抑制作用实现对化合物的定性和定量,其缺点是专一性差,残留量误差也较大[4,5]。而以碳纳米管为电极的电化学免疫法[6,7],与酶联免疫法[8]的测定结果也是。液相色谱法仅仅适用于基质比较干净的样品,对于基质复杂的样品分析时,往往难于定量[9]。为此建立液相色谱-串联质谱法测定猪肉中的青霉素残留量,由于该方法具有良好的适用性、定性分析和定量计算功能及具有较高灵敏度,成为测定畜产品中7种青霉素类药物残留量的主要方法[10~12]。
1 试验部分
1.1 仪器与试剂
Agilent 6470液质联用仪、氮吹仪(Organomation N-EVAP)、涡旋混合器(IKA)、电子天平(METTLERAE100)、高速离心机(湖南湘仪H2050R)、Milli-Q超纯水器(Milli-Q,美国);Atlantis dC18色谱柱(2.1×150mm,3m)色谱柱、Waters Oasis HLB固相萃取柱(6cc/500mg)。
阿莫西林(Amoxicillin纯度98.70%)、氨苄西林(Ampicillin纯度99.00%)、萘夫西林(Nafcillin纯度99.9%)、苯唑西林(Oxacillin纯度98.50%)、双氯西林(Dicloxacillin纯度97.27%)、氯唑西林(Cloxacillin纯度98.96%)和青霉素V(PenicillinV纯度98.6%)。
1.2 溶液的配制
标准储备溶液(1.0mg/mL):准确称取10mg标准品物质,用乙腈水(3+7)溶解后定容至10mL,置于-18C冰箱冷藏保存。
1.3 试验方法
称取5g试样(精确到0.01g)置于50mL离心管中,加入10mL乙腈,均质30s,7 000r/min离心5min,取上清液至50mL离心管。再加入5mL乙腈再涡旋混合1min,离心,合并上清液,氮吹干,加入10mL 0.5%乙酸-50g/L钨酸钠的混合提取液,混匀器振荡混匀1min。以1mL/min的速度通过预处理的OasisHLB固相萃取柱(用5mL甲醇,5mL水活化)中,用5mL含体积分数5%甲醇淋洗,然后用5mL乙腈洗脱,收集洗脱液于样品管中,45C氮吹干,用2mL水溶解,供液相色谱-串联质谱仪测定。
1.4 高效液相色谱及质谱条件
1.4.1 色谱条件
流动相:0.1mol/L。
甲酸水溶液:0.1%甲酸乙腈=90∶10(v/v)。
梯度洗脱程序见表1。
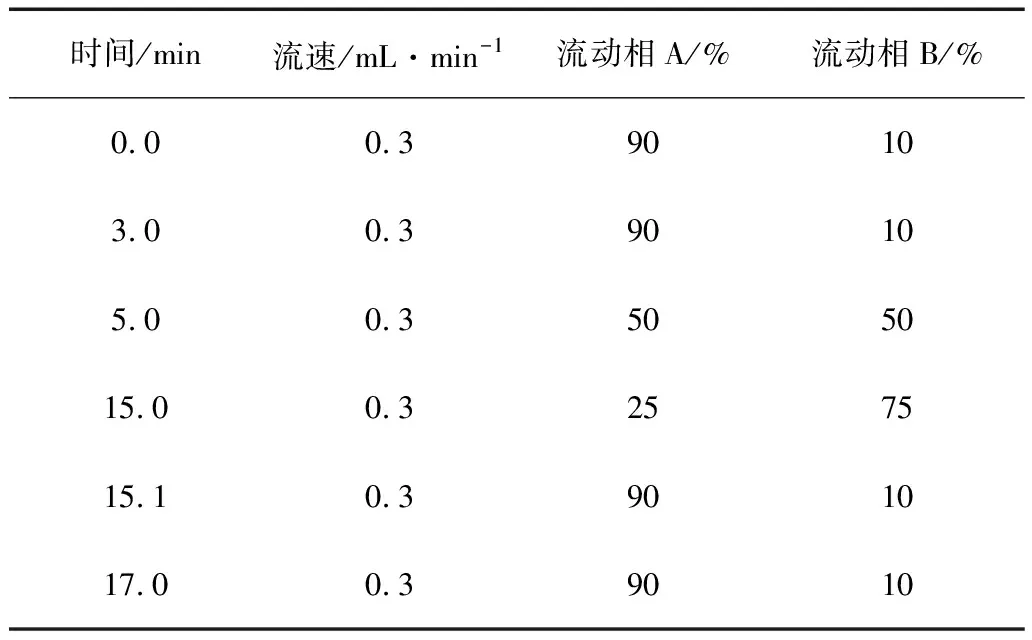
表1 梯度洗脱程序
1.4.2 质谱条件
电离源模式:电喷雾离子源(electrospray ionization, ESI)。
电离源极性:正模式(ESI+)。
检测方式:多反应监测(MRM)。
电喷雾电压:3 500V。
鞘气温度:350℃。
鞘气流速:11L/min。
干燥气流速11L/min。
干燥气温度:300℃。
其他质谱参数见表2。
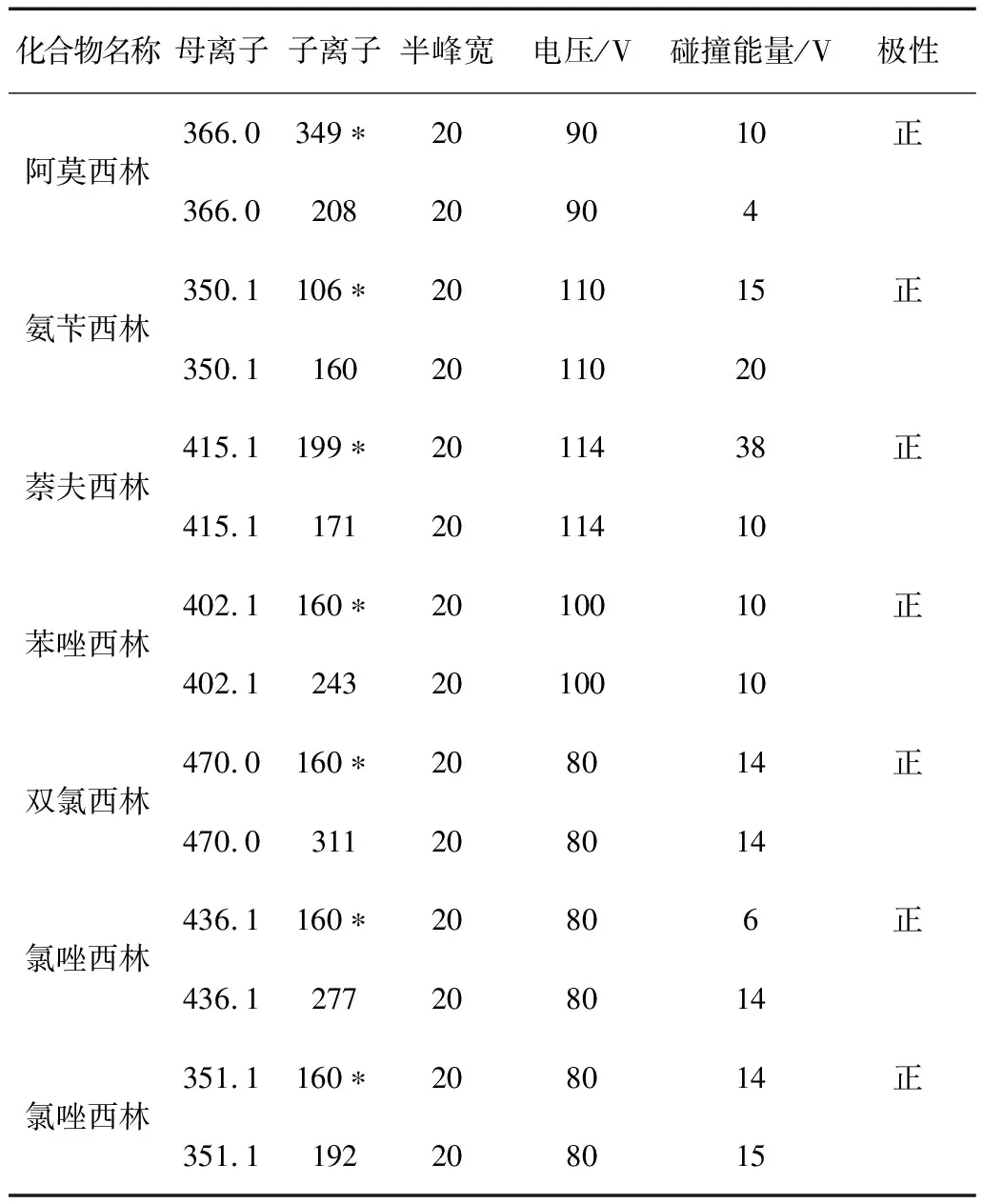
表2 7种化合物的质谱分析参数
注:*定量离子。
2 结果与讨论
2.1 前处理及检测条件的选择
2.1.1 流动相和色谱柱的选择
根据已有的有关青霉素标准,采用了几种不同流动相及不同的色谱柱进行实验。首先流动相分别选用了0.1mol/L甲酸水溶液+0.1%甲酸乙腈、0.3mol/L乙酸水溶液+0.3%乙酸乙腈。采用0.1mol/L甲酸水溶液+0.1%甲酸乙腈出峰时间稳定,7种青霉素的相应强度也很好;而采用0.3mol/L乙酸水溶液+0.3%乙酸乙腈出峰时间会偏移,且对个别青霉素的相应强度比较低。因此选用0.1mol/L甲酸水溶液+0.1%甲酸乙腈。色谱柱经过实验对比采用Atlantis dC18色谱柱(2.1150mm,3m),出峰时间合理,以MS采集数据,见图1。
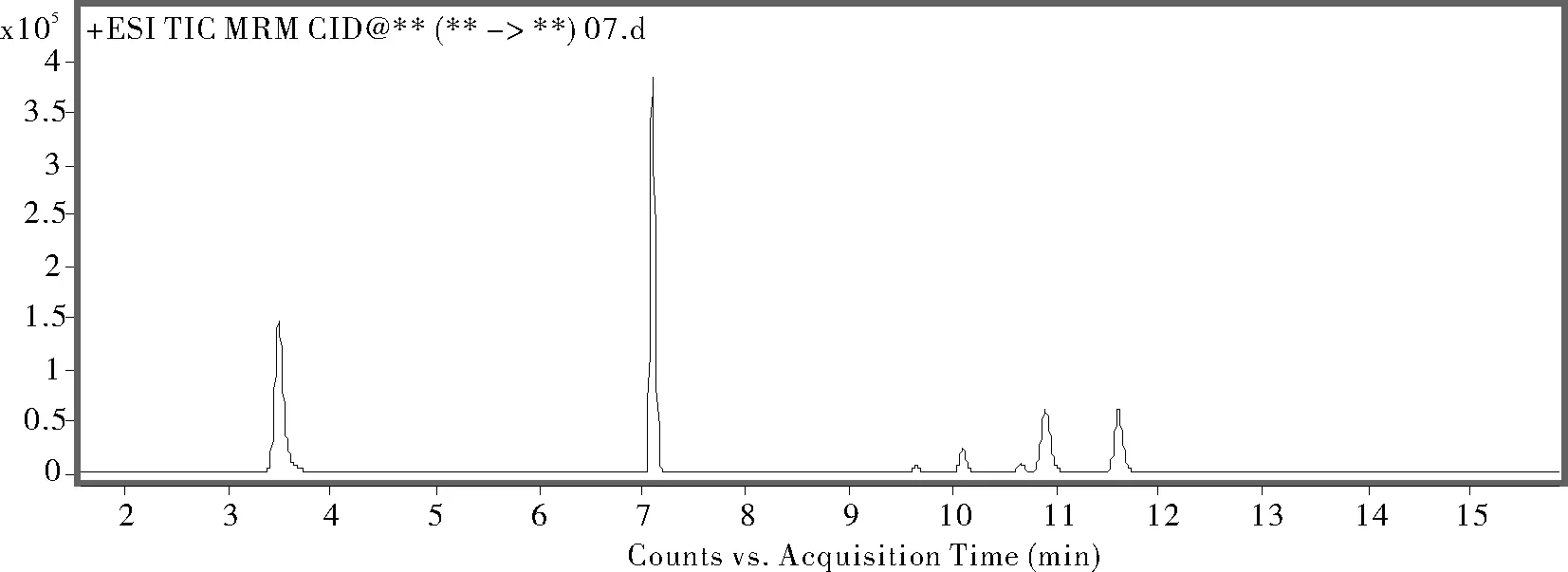
图1 7种青霉素标准溶液的总离子流图Figure 1 Total ion -current chromatogram of 7 penicillin Standards
在选用固相萃取柱方面,主要考察了2种小柱分别是Oasis C18固相萃取柱和Oasis HLB固相萃取柱。采用C18固相萃取柱时阿莫西林峰易干扰,总体回收率偏低,特别是对在低酸度和高酸度条件下会快速降解[13]。而选用Oasis HLB固相萃取柱时各种物质出峰都比较好,回收率满足试验要求。
2.2 线性响应试验结果
将7种青霉素标准溶液,按检出限用水稀释成相应浓度,以定量离子色谱图中各组分的峰面积定量。绘制物质标准曲线,7种目标化合物的线性回归方程和相关系数见表3。
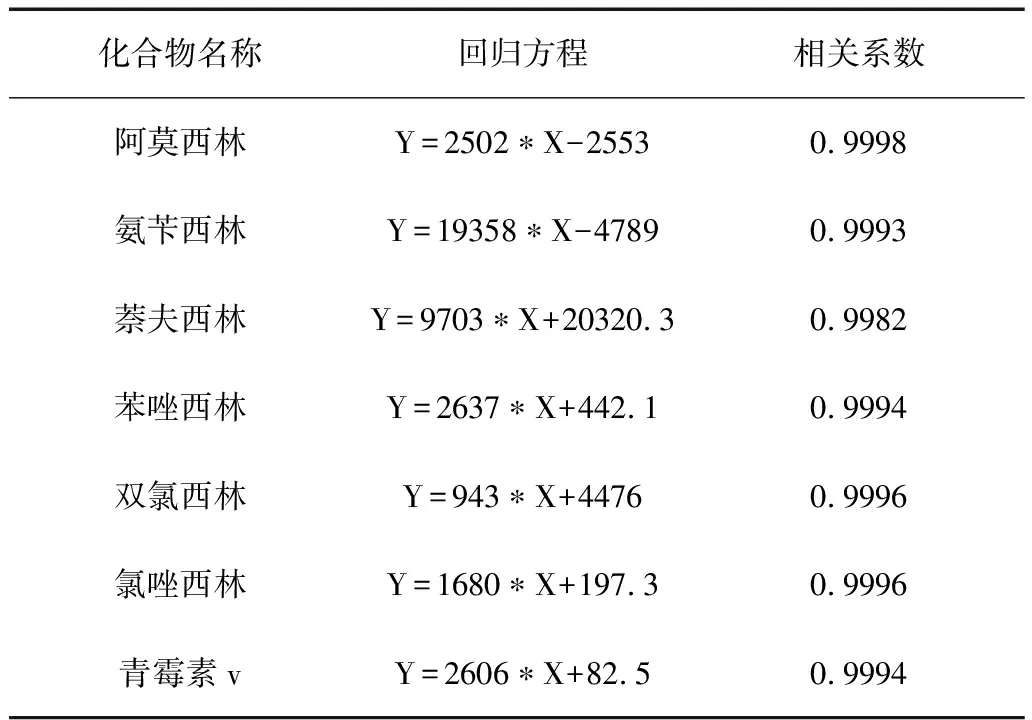
表3 7种化合物的回归方程
2.2.1 方法的回收率及精密度
向阴性的猪肉样品基质中分别添加检出限的1倍、2倍、10倍3个浓度水平的7种青霉素混合标准溶液,分别平行测定6次,计算各种化合物的回收率的算术平均值和相对标准偏差,结果见表4。
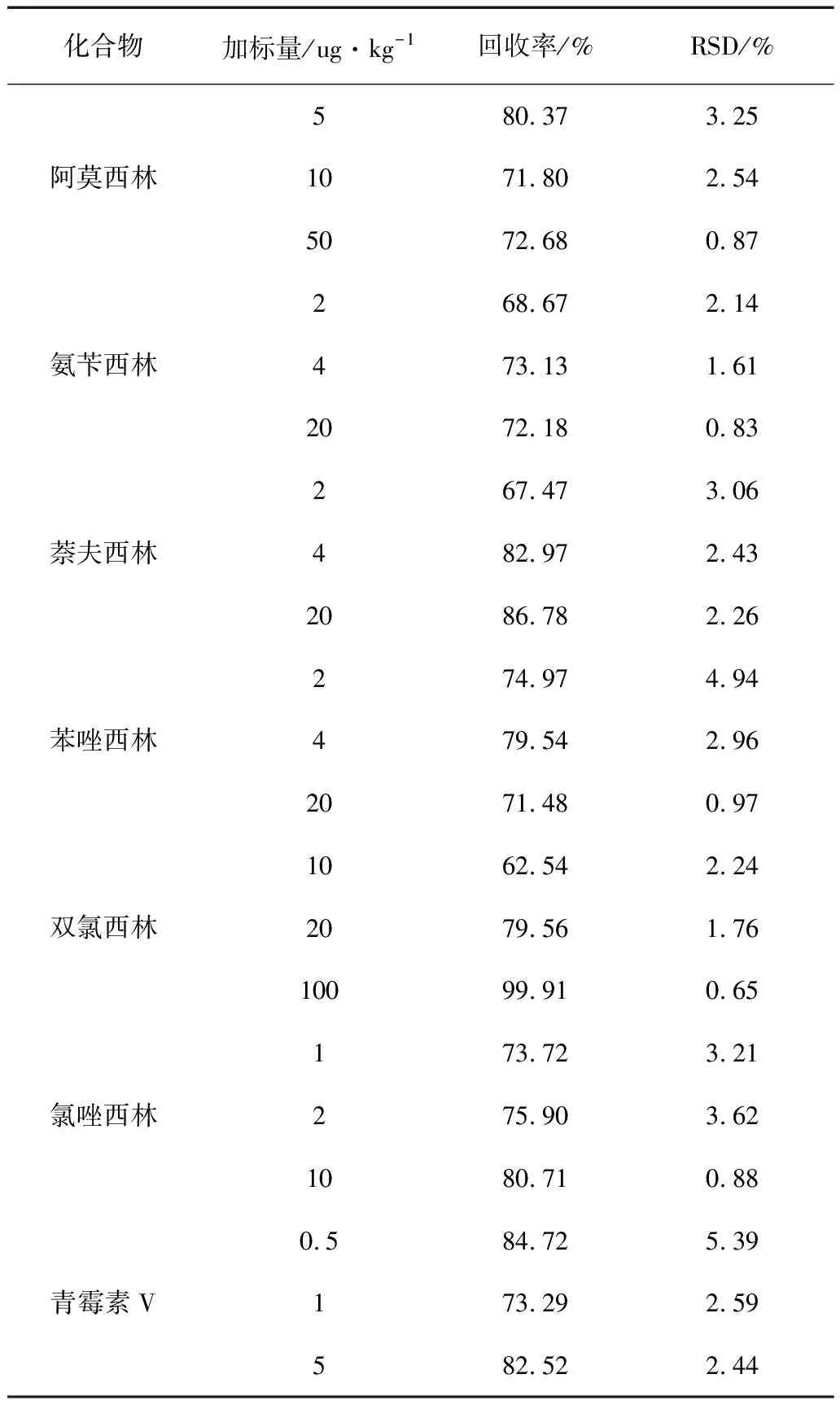
表4 精密度和回收试验结果(n=7)
2.3 质谱图分析
经过一系列条件的优化最终呈现7种青霉素的MRM峰型合理,相应强度也高,需要特别关注的是青霉素V的出峰位置有一个干扰峰是氨苄西林,氨苄西林的出峰时间为7.0min而青霉素V的出风时间在9.6min左右,其他6个目标峰处均无杂质峰干扰,分离度高,方法专属性良好,具体MRM图见图2。
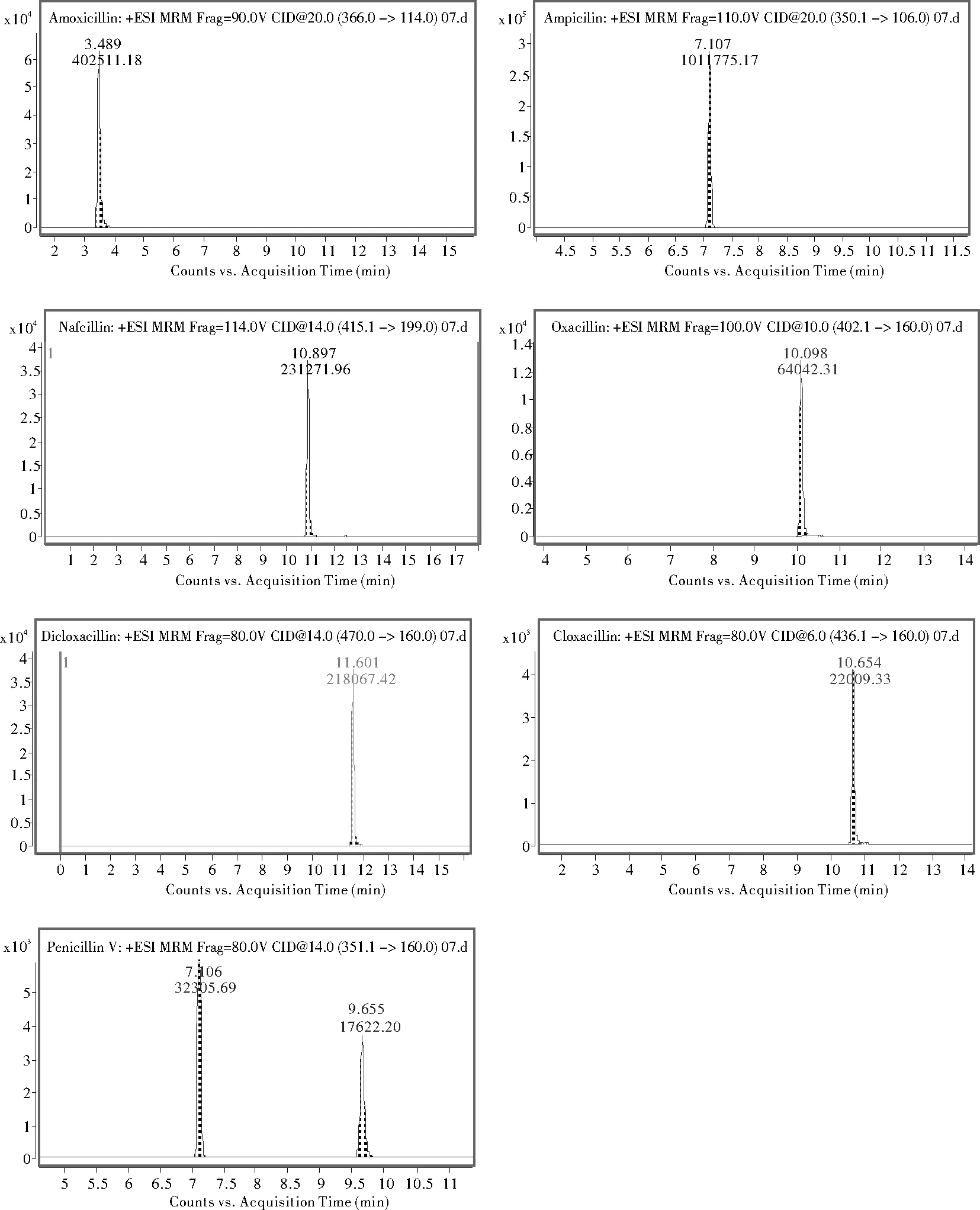
图2 7种青霉素的MRM质谱图Figure 2 MRM Spectrograms of 7 Penicillins
3 结论
3.1 提取液和固相萃取柱的选择
实验过程中采用了3种提取液分别选用了:(1)0.15mol/L的磷酸二氢钠缓冲盐[14];(2)乙腈水(15+2)和0.05mol/L磷酸氢二钾[15];(3)纯乙腈和0.5%乙酸-50g/L钨酸钠的混合提取液。
实验发现采用3.1(1)的提取液在过固相萃取柱时容易堵塞、信号相应低、基质效应大、在氨苄西林出峰的位置会有一个干扰峰,因此该提取液不适用;采用3.1(2)提取液提取时先用乙腈水提取在旋转蒸发,过程中一方面液体容易产生泡沫喷出来,再用0.05mol/L磷酸氢二钾溶解时回收率差只有20%~50%之间,样品平行性差不能满足实验要求;用3.1(3)提取液是乙腈能很好的提取样品中青霉素物质,在氮吹过程中也能克服起泡沫反喷的现象,用0.5%乙酸-50g/L钨酸钠溶解比较完全,回收率在65.10%~101.12%之间,样品平行性好,因此最终选用乙腈和0.5%乙酸-50g/L钨酸钠的混合提取液作为提取液。
3.2 固相萃取柱的洗脱剂和溶解液
试验考察了甲醇、乙腈水(1+1)、乙腈溶液作为固相萃取洗脱剂的效果。用甲醇时发现氯唑西林在甲醇中会快速降解,降解产物以酯类物质为主对质谱电喷雾离子化有影响[16];采用乙腈水(1+1)时氮吹太慢,最终定容比较困难;用乙腈是不仅缩短实验时间,对物质也能很好地保留。溶解液选用纯水和磷酸盐缓冲溶液,发现用纯水时物质相应比较高,基质比较低,峰型好看;采用磷酸盐缓冲溶液相应低,杂质峰多,峰型偏胖。
本试验采用了超高效液相色谱-串联质谱技术建立了动物源性食品中7种青霉素的高效液相-质谱检测方法。该方法前处理简便、线性良好、具有较高的平行性,可满足国家标准检测的要求,为相关部门风险监测提供了方法学依据。
