髓核间充质干细胞生物学特性与椎间盘Pfirrmann分级相关性研究
2019-11-09方世兵伍耀宏陈云生陈勤徐灿华潘其林
方世兵 伍耀宏 陈云生 陈勤 徐灿华 潘其林
[摘要] 目的 研究不同Pfirrmann分級椎间盘中髓核间充质干细胞(human nucleus pulposus mesenchymal stem cells,hNP-MSCs)的生物学特性,进一步明确hNP-MSCs在椎间盘退变(intervertebral disc degeneration,IVDD)中的作用及其相关性。 方法 选取2017年1月~2019年1月我院椎间盘髓核摘除术的患者,根据术前MRI按Pfirrmann分级标准(Ⅰ~Ⅴ级)分为5组,各组均为3例,共15例,评价hNP-MSCs在不同椎间盘退变中的生物学特性差异及其与椎间盘退变程度的相关性。 结果 PfirrmannⅠ~Ⅴ级5组共15例标本均分离获取到了hNP-MSCs原代细胞,贴壁时间及80%~90%融合率时间差异有统计学意义(P<0.05),Pfirrmann分级越高,细胞生长所需时间越长,细胞形态及增殖集落越不均一。酶标仪检测不同Pfirrmann分级的5组hNP-MSCs标本接种后第1、3天,不同组hNP-MSCs标本OD值差异无统计学意义(P>0.05),第5、7、9、11、13天,不同组hNP-MSCs标本OD值差异有统计学意义(P<0.05),Pfirrmann分级超高,OD值越低,提示增殖能力与Pfirrmann分级呈负相关性。不同Pfirrmann分级的5组hNP-MSCs标本P2代细胞流式细胞仪检测结果显示均为高表达CD44、CD73、CD90、CD105,低表达CD31、CD34、CD45,各组CD44、CD73、CD90、CD105阳性表达率差异有统计学意义(P<0.05),且随Pfirrmann分级的增加,阳性表达率下降,呈负相关性。 结论 hNP-MSCs的生物学特性与椎间盘Pfirrmann分级密切相关,椎间盘退变程度越重,hNP-MSCs的生物学表现越差。
[关键词] 髓核间充质干细胞;Pfirrmann分级;生物学特性;OD值;相关性
[中图分类号] R681.53 [文献标识码] A [文章编号] 1673-9701(2019)22-0039-05
[Abstract] Objective To study the biological characteristics of human nucleus pulposus mesenchymal stem cells (hNP-MSCs) in different Pfirrmann graded intervertebral discs, and to further clarify the role and relevance of hNP-MSCs in intervertebral disc degeneration (IVDD). Methods Patients who underwent nucleus pulposus removal from January 2017 to January 2019 in our hospital were divided into 5 groups according to the preoperative MRI according to the Pfirrmann grading standard(Ⅰ-Ⅴ grade), with 3 cases in each group and 15 cases totally. The differences in biological characteristics of hNP-MSCs in different intervertebral disc degeneration and their correlation with the degree of intervertebral disc degeneration. Results The primary cells of hNP-MSCs were isolated from 15 specimens of Pfirrmann Ⅰ-Ⅴ group. There were statistically significant differences in the time of adherence time and the time of 80%-90% fusion rate(P<0.05). The higher the Pfirrmann grade, the longer it took for cells to grow, and the more uniform the cell morphology and proliferation colonies. 5 groups of hNP-MSCs specimens from different Pfirrmann grades were detected by microplate reader on the first and third days after inoculation. The differences in OD values of hNP-MSCs in different groups were not statistically significant(P>0.05). On the 5th, 7th, 9th, 11th, and 13th day, the difference of OD values between different groups of hNP-MSCs was statistically significant (P<0.05). The higher Pfirrmann grade, the lower the OD value, indicating that the proliferation ability was negatively correlated with Pfirrmann classification. Flow cytometry results of P2 generation of hNP-MSCs samples in 5 groups from different Pfirrmann grades showed high expression of CD44, CD73, CD90 and CD105, low expression of CD31, CD34 and CD45. The difference in positive expression rate of CD44, CD73, CD90, CD105 in each group was statistically significant (P<0.05). And with the increase in Pfirrmann grading, the positive expression rate decreased and was negatively correlated. Conclusion The biological characteristics of hNP-MSCs are closely related to the Pfirrmann classification of the intervertebral disc. The more severe the degeneration of the intervertebral disc, the worse the biological performance of hNP-MSCs.
[Key words] Nucleus pulposus mesenchymal stem cells; Pfirrmann classification; Biological characteristics; OD value; Correlation
椎间盘退变(intervertebral disc degeneration,IVDD)是引起颈肩腰腿痛的主要原因。近年来,细胞治疗干预早期IVDD是当前的热点研究。然而,IVDD的机制尚不明确,这对IVDD生物治疗的时机及治疗方法提出了挑战。椎间盘干细胞的修复作用在IVDD中起着至关重要的作用,其中以髓核间充质干细胞(human nucleus pulposus mesenchymal stem cells,hNP-MSCs)作用最为明显。虽然目前已证明了hNP-MSCs退变是引起IVDD的重要因素,但并未对退变椎间盘进行分级。IVDD是一个漫长的过程,不同退变程度椎间盘表现出不同的生物学活性及特征,所以基于当前hNP-MSCs与椎间盘退变的所有研究,无法明确椎间盘退变过程中hNP-MSCs的生物学功能差异。因此,研究不同Pfirrmann分级椎间盘中hNP-MSCs的功能差异,对进一步阐明hNP-MSCs在椎间盘退变中的作用具有重要指导意义,为进一步阐述椎间盘干细胞在椎间盘退变过程中的作用机制提供了新方法。
1 材料与方法
1.1 一般材料
选择2017年1月~2019年1月赣州市人民医院脊柱外科接受椎间盘髓核摘除术的患者,根据术前MRI按Pfirrmann分级标准(Ⅰ~Ⅴ级)分为5组,各组均为3例,共15例。其中男9例、女6例,年龄16~51岁,平均38.5岁;颈椎椎间盘5例,胸椎2例,腰椎8例;病种为颈椎骨折2例、颈椎病3例、结构性脊椎侧弯畸形2例、腰椎间盘突出症及腰椎滑脱8例。基于核磁共振检查结果的Pfirrmann分级主观评价差异大,为去除主观差异,需要经过3个不同的影像科医师进行评分分级,经过2个医师同意即可作为该样本最终分级。Ⅰ级的椎间盘见于健康的青少年,本研究中采用颈椎骨折1例(23岁)及脊柱侧弯畸形2例(16~21岁)的变异节段的椎间盘作为代替,Ⅱ、Ⅲ、Ⅳ、Ⅴ级取自接受椎间盘切除融合手术的患者,本实验患者知情同意并获医院伦理委员会的批准,所有受试者均签署知情同意书,未成年者由监护人签署。
1.2 仪器及试剂
流式细胞仪(Millipore 美国),Moflo高速流式细胞分选仪(Dako cytomation 美国),离心机(Hereaus德国),细胞计数试剂盒(CCK-8日本),细胞培养板(Corning 美国),磷酸盐缓冲液PBS(Sigma 美国),倒置显微镜(Olympus日本),胰蛋白酶(Solaibo美国),Ⅱ型胶原酶(Gibico美国),胎牛血清(Hyclone美国),DMEM低糖培养基(Cyagen Biosciences中国),青霉素-链霉素(Hyclone 美国),荧光单克隆抗体CD90-APC、CD73-APC、CD105-APC、CD44-APC、CD31-APC、CD34-APC、CD45-APC(Abcam 美国)。
1.3 分离培养获取hNP-MSCs
将手术中切下的椎间盘组织(术前按Pfirrmann分级分组)立即送中心实验室处理,无菌条件下超净台上生理盐水清洗血块等表面杂质,眼科剪剔除椎间盘的纤维环及软骨终板组织,仔细分离髓核组织,PBS清洗2遍,剪碎至1.0 mm×1.0 mm×1.0 mm大小,置于0.02 mg/mL的Ⅱ型胶原酶溶液中,5%CO2、37℃培养箱中消化过夜,次日取出并用200 μm无菌钢丝网过滤组织碎片。1500转/min离心4 min,弃上清液,收集细胞,加至含10%FBS、1%青霉素-链霉素的DMEM低糖培养基中,吹打混匀,置入5%CO2、37℃培养箱培养,贴壁后每2~3天换液1次,待细胞融合至80%~90%时进行传代培养,0.25%胰酶、0.02%EDTA消化3 min,按照5×103个细胞/cm2重新接种于培养瓶进行传代培养,取P2代细胞至80%~90%融合時,提取hNP-MSCs进行实验研究。
1.4 细胞形态学观察
在hNP-MSCs分离培养过程中,利用倒置显微镜,每天对细胞形态及细胞融合率进行观察,拍照并记录形态学及集落形成特征。
1.5 hNP-MSCs增殖能力的检测
细胞增殖能力用CCK-8进行检测,将不同分组的P2代hNP-MSCs,胰蛋白酶消化,调整细胞悬液密度,按照每孔5×104个细胞/mL、200 μL培养基接种于96孔板,每组6个复孔,以不含细胞的培养液为空白对照组。将96孔板放置于温度为37℃、体积分数为5%的CO2培养箱中培养,分别于接种后第1、3、5、7、9、11、13天检测细胞增殖情况,在各组每孔添加10 μL CCK-8溶液(包含空白对照组),作用4 h后用检测波长为450 nm酶标仪测定光密度(OD)值,将各细胞培养孔所得OD值减去阴性空白对照OD值后,计算不同组别培养基组hNP-MSCs的平均OD值,比较细胞增殖活力,并绘制细胞增殖曲线。
1.6 免疫表型的检测
各组取P2代细胞,消化制备细胞悬液,调整浓度为1×105/mL,每管取细胞1 mL,PBS清洗后,分别加入荧光单克隆抗体CD90-APC、CD73-APC、CD105-APC、CD44-APC、CD31-APC、CD34-APC、CD45-APC,每管共100 μL细胞悬液,根据同型对照的荧光强度设阴性对照组(不加任何抗体)。将每管标本与抗体混匀后室温避光孵育,20 min后用2 mL PBS清洗后弃上清,重悬于400 μL PBS(含1%多聚甲醛)FC500流式细胞仪上检测,观察各组hNP-MSCs每种单抗的阳性细胞表达率,Cellquest软件分析结果。
1.7 统计学方法
采用SPSS 14.0统计软件进行数据统计学分析,计量资料结果以(x±s)表示,对不同组hNP-MSCs不同培养天数的细胞OD值,CD90、CD73、CD105、CD44、 CD31、CD34、CD45的阳性表达率进行方差齐性检验后,采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
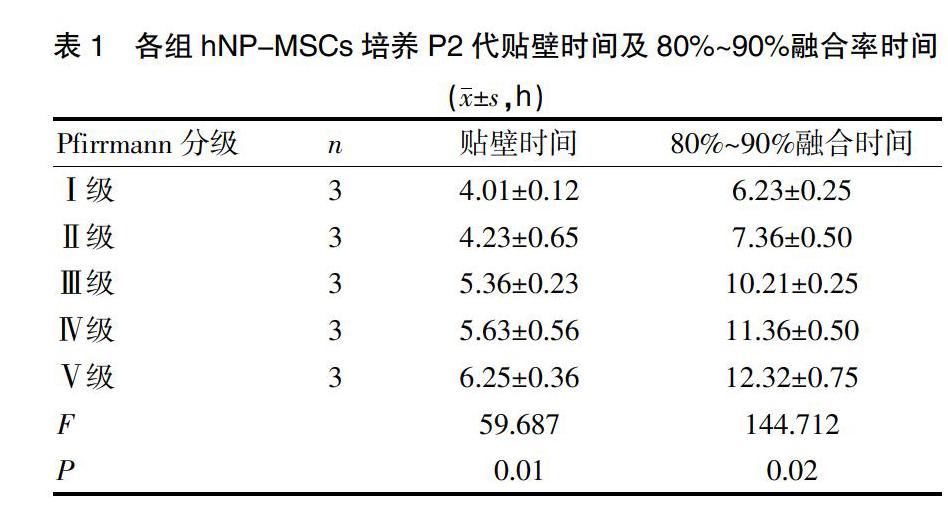
2.1 各组hNP-MSCs培养P2代贴壁时间(h)及80%~90%融合率时间
PfirrmannⅠ~Ⅴ级5组共15例标本均分离获取到了hNP-MSCs原代细胞,各组在接种后不同时间出现贴壁,P0代细胞形态多为长短不一的短梭纺锤形,为散在不规则贴壁生长(封三图4),约12~19 d细胞融合率可达80%~90%。P1代细胞生长较P0代明显增快,贴壁时间更短,细胞排列紧密、形态更均一,呈螺旋状(封三图5),接种后约10~17 d细胞达80%~90%融合。P2代细胞形态基本保持一致,贴壁快、约4~6 h,呈典型的长梭形,排列更加紧密、整齐,呈漩涡状排列生长(封三图6),约6~12 d细胞融合率即可达80%~90%。5组标本P2代贴壁生长时间、80%~90%细胞融合率时间(表1),差异有统计学意义(P<0.05),Pfirrmann分级越高,细胞生长所需时间越长,细胞形态及增殖集落越不均一。
2.2 不同Pfirrmann分组hNP-MSCs不同培养时间的OD值
酶标仪检测不同Pfirrmann分级的5组hNP-MSCs标本接种后第1、3、5、7、9、11、13天的OD值结果见表2。细胞增殖结果显示,培养第1、3天,不同组的hNP-MSCs标本OD值差异无统计学意义(P>0.05),第5、7、9、11、13天,不同组的hNP-MSCs标本OD值差异有统计学意义(P<0.05),Pfirrmann分级越高,OD值越低,提示增殖能力与Pfirrmann分级呈负相关性。
2.3 各组hNP-MSCs标本P2代细胞表面标志物表达率
不同Pfirrmann分级的5组hNP-MSCs标本P2代细胞流式细胞仪检测结果显示均为高表达CD44、CD73、CD90、CD105,低表达CD31、CD34、CD45(表达率见表3),各组CD44、CD73、CD90、CD105阳性表达率差异有统计学意义(P<0.05),且随Pfirrmann分级的增加,阳性表达率下降,呈负相关性。
3 讨论
大量研究已证实,IVDD是脊柱相关疾病的主要原因之一,机制主要为椎间盘退变致膨出及突出,出现神经根压迫及炎性病变的发生,从而出現疼痛等相应临床表现,严重影响了人们的生活质量[1]。椎间盘主要由终板软骨、纤维环和髓核组织3部分组成,主要构成为胶原蛋白和蛋白糖类[2],营养主要来自椎体软骨终板的毛细血管床[3]。IVDD的机制为尚不明确,研究报道多种因素可引起椎间盘退变,过程复杂[4-5],Stemple DL[6]认为髓核细胞形态改变,凋亡率和死亡率增加,细胞外基质(蛋白多糖、Ⅱ型胶原等)合成减少是IVDD主要原因。目前尚无一种切实有效的治疗或阻止椎间盘退变的方法。髓核组织中存在hNP-MSCs[7],其可通过调节分泌作用,刺激退变的椎间盘进行内在修复[8]。近年来,干细胞移植成为IVDD生物学治疗的研究热点,有研究发现,自体hNP-MSCs植入退变椎间盘组织内能明显延缓IVDD的发展进程[9],然而,自体hNP-MSC并不容易获取足量细胞,且在获取细胞时往往引也正常椎间盘退变或原来退变加重,反而加重患者病情,成为自体干细胞移植应用临床最大的障碍。有学者尝试采用不同方法激活已退变椎间盘内的hNP-MSCs来阻止或逆转IVDD,查相关的文献报道尚少,本课题受此启发,研究不同退变程度的椎间盘组织内hNP-MSCs生物活性,进一步阐明hNP-MSCs在椎间盘退变中的作用和机制,明确两者相关性,为生物治疗椎间盘退变提供合适的治疗时机与合理的治疗方法。
椎间盘退变程度评估的方法有很多,最常用的有X线片、CT片、椎间盘造影、MRI检查及术中实体观察等。其中以MRI应用最多,Pfirrmann分级是通过MRI对椎间盘退变进行评估的一种方法,依据MR T2WI图像判断椎间盘退变的程度,它从解剖学角度清楚地描述了椎间盘退变的形态学改变,可以较好地反映椎间盘早期的退行性改变,为无创、有效、准确及可行性强等特点,已广泛应用于临床与科研[10-11]。Pfirrmann分级法是依据T2WI信号强度、信号是否均质、髓核与纤维环的分界是否清晰和椎间盘的高度等指标建立了腰椎间盘退变的MRI分级体系,分为Ⅰ~Ⅴ级。本研究采用Pfirrmann分级法对椎间盘退变进行评估,按Ⅰ~Ⅴ级分为5组,各组均取3个标本,共15个。Ⅰ、Ⅱ级见于正常青少年的椎间盘组织,其中Ⅰ为健康的青少年,临床上行椎间盘摘除手术相对较少,取材资源少,本课题3例标本来源于少年先天性脊椎侧弯畸形手术,在行椎体截骨取出下椎间盘组织。Ⅱ级3例标本来源于颈椎骨折青年患者,椎间盘信号呈均匀白色,髓核与纤维环的分界清晰,在行前路稳定手术(颈椎融合)中切取的椎间盘组织。Ⅲ级椎间盘髓核T2WI信号呈灰色、不均匀,髓核与纤维环的分界模糊,椎间椎高度轻度降低,标本1个取自颈椎病、2个取自腰椎间盘突出患者。Ⅳ级髓核T2WI信号呈灰色或黑色,与纤维环的分界消失,高度中度降低,3例标本取腰椎间盘突出。Ⅴ级髓核信号比Ⅳ级更黑,伴有椎间高度塌陷,因退变严重,实验中分离髓核相对困难,标本取自重型颈椎病及腰椎滑脱患者。实验过程中,各级标本均分离培养到了符合标准的hNP-MSCs,能满足实验要求。
椎间盘退变时,髓核组织退变最明显,对于椎间盘退变有重要影响[12],其进程为不可逆性,既往研究认为椎间盘本身不具备修复能力[13]。随着对椎间盘组织及细胞生化研究的广泛深入开展,Risbud首次报道了椎间盘髓核组织中存在hNP-MSCs,该细胞特征性表达一系列间充质干细胞(MSCs)表面蛋白分子、可完成三系诱导分化,符合国际细胞治疗学会(International Society for Cellular Therapry,ISCT)有关MSCs 的界定标准[14],MSCs是体内一类特殊的细胞群体, 其具有自我更新及多向分化能力[15-17]。通过激活hNP-MSCs的生物活性来治疗IVDD,现已成为热点,并有大量的相关基础研究报道[18-20]。退变对hNP-MSCs的生物活性的影响及相关性的研究比较少见,我们选取需切除椎间盘的患者,年龄16~51岁,排除肿瘤、结核等疾病,术前根据MRI结果明确Pfirrmann分级,按不同分级进行分组纳入实验研究。手术中获取椎间盘髓核组织标本,酶消化法分离髓核间充质干细胞,比较不同分级髓核间充质干细胞的形态、增殖、集落形成、干细胞免疫表型,评价髓核间充质干细胞在不同椎间盘退变中的生物学特性差异及其与椎间盘退变程度的相关性。均数采用(x±s)表示,对不同组hNP-MSCs不同培养天数的细胞OD值,CD90、CD73、CD105、CD44、CD31、CD34、CD45的阳性表达率进行方差齐性检验后,采用独立样本t检验。基于核磁共振检查结果的Pfirrmann分级主观评价差异大,为去除主观差异,需要经过3个不同的影像科医师进行评分分级,经过2个医师同意即可作为该样本最终分级。本研究结果显示不同Pfirrmann分级的hNP-MSCs形态不同,分级越高,细胞越不规则,而且贴壁时间与80%~90%细胞融合率时间也随退变的加重而延长。增殖能力及免疫表型检测显示,椎间盘退变越重,其增殖能力越差、细胞免疫标志物的阳性率也明显减低。本研究在不同退变程度的椎间盘内均可培养出hNP-MSCs,但实验结果充分证明了随着椎间盘退变程度的加重,hNP-MSCs生物活性变差。本实验首次研究Pfirrmann退变程度与髓核间充质干细胞生物学特性的相关性,为进一步阐述椎间盘干细胞在椎间盘退变过程中的作用机制提供了新方法。
[參考文献]
[1] Bhojwani N,Szpakowski P,Partovi S,et al. Diffusion-weighted imaging in musculoskeletal radiology-clinical applications and future directions[J]. Quantitative Imaging in Medicine and Surgery,2015,5(5):740-753.
[2] Wang W,Qin W,Hao N,et al. Diffusion tensor imaging in spinal cord compression[J]. Acta Radiologica,2012,53(8):921-928.
[3] Reinhold M,Ederer C,Henninger B,et al. Diffusion-weighted magnetic resonance imaging for the diagnosis of patients with lumbar nerve root entrapment syndromes:results from a pilot study[J]. European Spine Journal,2014, 6(3):149-153.
[4] Wang F,Cai F,Shi R,et al. Aging and age related stresses:a senescence mechanism of intervertebral disc degeneration[J]. Osteoarthritis Cartilage,2016,24(3):398-408.
[5] Samartzis D,Borthakur A,Belfer I,et al.Novel diagnostic and prognostic methods for disc degeneration and low back pain[J].Spine J,2015,15(9):1919-1932.
[6] Stemple DL. Structure and function of the notochord:an essential organ for chordate development[J]. Development,2005,132(11):2503-2512.
[7] Risbud MV,Guttapalli A,Tsai TT,et al.Evidence for skeletal progenitor cells in the degenerate human intervertebral disc[J]. Spine,2007,32(23):2537-2544.
[8] Brisby H,Papadimitriou N,Brantsing C,et al.The presence of local mesenchymal progenitor cells in human degenerated intervertebral discs and possibilities to influence these in vitro:A descriptive study in humans[J]. Stem Cells Dev,2013,22(5):804-814.
[9] Gruber HE,Johnson TL,Leslie K,et al. Autologous intervertebral disc cell implantation:A model using Psammomys obesus,the sand rat[J]. Spine,2002,27(15):1626-1633.
[10] Pfirrmann CW,Metzdorf A,Zanetti M,et al. Magnetic resonance classification of lumbar intervertebral disc degeneration[J]. Spine(Phila Pa 1976),2001,26(17):1873-1878.
[11] Dang L,Liu Z. A review of current treatment for lumbar disc herniation in children and adolescents[J]. Eur Spine J,2010,19(2): 205-214.
[12] Adams MA,Roughley PJ. What is intervertebral disc degeneration,and what causes it[J]. Spine,2006,31(18):2151-2161.
[13] Smith JW,Walmsley R. Experimental incision of the intervertebral disc[J]. J Bone Joint Surg Br,1951,33(4):612-625.
[14] Dominici M,Le Blanc K,Mueller I,et al. Minimal criteria for defining multipotent mesenchymal stromal cells:the International Society for Cellular Therapy Position Statement[J]. Cytotherapy,2006,8(4):315-317.
[15] Sensebe L,Fleury-Cappellesso S. Biodistribution of mesenchymal stem/stromal cells in a preclinical setting[J]. Stem Cells Int,2013,2013:678063.
[16] Lazzarini R,Guarnieri S,Fulgenzi G,et al. Mesenchymal Stem Cells from Nucleus Pulposus and Neural Differentiation Potential:A Continuous Challenge[J]. J Mol Neurosci,2019,67(1):111-124.
[17] Migliorini F,Rath B,Tingart M,et al. Autogenic mesenchymal stem cells for intervertebral disc regeneration[J].Int Orthop,2019,43(4):1027-1036.
[18] Xia K,Gong Z,Zhu J,et al. Differentiation of Pluripotent Stem Cells into Nucleus Pulposus Progenitor Cells for Intervertebral Disc Regeneration[J]. Curr Stem Cell Res Ther,2019,14(1):57-64.
[19] Wu H,Shang Y,Yu J,et al. Regenerative potential of human nucleus pulposus resident stem/progenitor cells declines with ageing and intervertebral disc degeneration[J].Int J Mol Med,2018,42(4): 2193-2202.
[20] Lehmann TP,Jakub G,Harasymczuk J,et al. Transforming growth factor β mediates communication of co-cultured human nucleus pulposus cells and mesenchymal stem cells[J]. J Orthop Res,2018,36(11):3023-3032.
(收稿日期:2019-04-16)
