从Nogo-A-NgR信号通路探讨MCAO大鼠皮脊髓束重塑的启动及复健片干预机制
2019-11-09英振昊张国丽
刘 维, 英振昊, 张国丽, 刘 伟
由于缺血性脑卒中后的神经功能修复机制尚未明确,导致其机制性研究成为了近年来现代医学亟待解决的问题之一。皮质脊髓束(Corticospinal tract,CST)重塑对其有着一定的促进作用。复健片对卒中病后受损神经功能的修复有显著地促进作用[1],可以促进皮质脊髓束重塑[2,3]。脑卒中发生后,失神经支配侧的脊髓灰质部位出现CST重塑,且其重塑对瘫痪肢体运动功能的恢复有一定促进作用[4],这高度提示了局灶性脑梗死后脊髓可能参与了缺损神经功能的修复。研究表明,Nogo-A与其受体NgR结合可抑制轴突再生[5~7],而生长相关蛋白43(GAP-43)是轴突生长和可塑性的示踪因子。故本研究采纳大脑中动脉闭塞(MACO)模型,分析复健片干预下脑梗死后颈髓GAP-43表达以及Nogo-A-NgR信号通路的表达变化,以期揭示局灶性脑梗死后CST重塑的可能启动机制及药物干预机制。
1 实验材料
1.1 实验动物 健康雄性Sprague-Dawley(SD)大鼠12周龄,55只,体重维持在250~300 g,实验大鼠均购自于济南朋悦实验动物繁育有限公司,其合格证号为:SCXK(鲁)20140007。大鼠实验经山东中医药大学实验室动物管理和使用委员会批准同意。
1.2 主要仪器 脑立体定位仪(第二军医大学,上海),微量天平(Mono Bloc AB204-S),台式恒温振荡器(上海跃进医疗器械THZ-92B),超声波细胞粉碎机(西安德派公司),垂直板蛋白电泳仪(上海天能公司),化学发光多色荧光成像系统(法国Vilber Fusion FX7),聚合酶链式反应(PCR)仪(美国安捷伦MX3000P实时荧光定量PCR仪),偏光荧光显微镜(日本尼康公司)。
1.3 主要试剂 神经示踪剂生物素葡聚糖胺(BDA)试剂盒购于Molecular Probes公司,大鼠环磷酸腺苷(cAMP)酶联免疫分析(ELISA)试剂盒购于武汉基因美科技有限公司,lightCyler480 SYBR Green I Master、lightCyler480 Multiwell plate 96试剂盒均购于Roche公司,反转录试剂盒购于Takara公司,即用型正常山羊血清购于武汉博士德生物工程有限公司,兔抗大鼠GAP-43单抗购于Abcam公司,羊抗兔IgA二抗、Nogo-A抗体、NgR抗体购于北京博奥森生物技术有限公司,羊抗兔荧光二抗购于Invitrogen公司。
2 实验方法
2.1 动物模型制备及分组 按Tamura[8]改良法对造模组制备右侧近端大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。待大鼠麻醉醒后,对大鼠进行测试,其中造模成功的大鼠须符合以下标准(至少符合一项):(1)对大鼠左侧肢体对疼痛刺激无收缩反应;(2)大鼠在平面上自由爬行会向患侧转圈或倾倒;(3)大鼠被提尾悬挂空中时左上肢屈曲、内收。随机选取45只造模成功的MCAO大鼠作为未BDA组(术后1 w和术后2 w组)和BDA组(术后2 w组),其中未BDA组包括药物组和模型组各8只;BDA组包括药物组和模型组各5只。另随机选取13只健康大鼠,除不闭塞大脑中动脉,其它操作与造模组相同,其中8只作为未BDA组的假手术组;5只作为BDA组的假手术组。
2.2 给药方法 每组大鼠同时于术后1 w末进行灌胃,药物组大鼠给予复健片浓缩液(由山东中医药大学药剂教研室制作),按照5.9 ml/kg剂量灌胃,其余大鼠灌胃等量的生理盐水,一日一次。自由饮水、饮食。复健片浓缩液生产批号:20161012,其中生药浓度为1.53 g/ml。
2.3 BWT评分 分别于MCAO术后1 w末、2 w末,采用Feeney等[9]走横木试验(BWT)对各组大鼠进行运动功能评分并记录(2人同时观测,其中1人不知分组情况)。
2.4 BDA(biotin dextran amine BDA)顺行示踪 术后1 w末对BDA组的3组大鼠的左侧大脑皮质注射生物素葡聚糖胺(Biotin dextran amine,BDA)。将大鼠以4%水合氯醛(0.7 ml/100 g体重)进行腹腔注射麻醉,待麻醉成功后用剃毛器对头顶部皮肤备皮,将大鼠固定在脑立体定位仪上,切开头皮,剥离骨膜,充分暴露前囟及左侧感觉运动区。注射点为:以前囟为标准,分别于前囟中点后1 mm、2 mm;左侧旁开3.5 mm、4.5 mm处,即(-1 mm,3.5 mm)、(-1 mm,4.5 mm)、(-2 mm,3.5 mm)、(-2 mm,4.5 mm)4个部位注射BDA。用微型电钻钻孔至硬脑膜,10 μl微量注射器注射,每个注射点注入0.2 μl 10%BDA溶液,注射深度为皮质下1.5 mm~1.7 mm。注射结束后,将针头停留2 min,拔出针头,将脑表面用薄层明胶海绵覆盖,进行头皮缝合。
2.5 取材及指标检测 将各组大鼠在相应时间点麻醉处死,并取出大脑和颈髓(C4-C6),颈髓长度约1.5 cm。其中用于TTC染色的大脑置于-20 ℃冰箱,备用;用于BDA染色显影的颈髓组织置于4%多聚甲醛固定,备用;用于Western blot、免疫荧光、PT-PCR法检测的颈髓组织置于液氮冷冻后保存于-80 ℃冰箱,备用。
2.5.1 免疫组织化学方法观测颈髓BDA染色显影 BDA注射1 w后将大鼠麻醉处死,取出颈髓组织 C4-C6节段,并放于4%多聚甲醛中,过夜固定,然后放于10%、20%、30%蔗糖中剃度脱水。待组织块沉入容器底后,取出,OCT包埋,用冰冻切片机对包埋后的颈髓组织作连续冠状切片,每片厚约40 μm。组织切片先在0.5%H2O2中反应15 min;TBS漂洗3次,每次5 min;将切片于含0.3%Trition X-100的TBS(pH7.5)中,4 ℃孵育6 h;TBS漂洗3次,每次5 min;将切片于辣根-HRP(浓度为0.8 μg/ml)中,常温过夜。TBS漂洗3次,每次5 min;将切片于DAB溶液中(浓度为0.05%,内含0.5 mol/ml pH7.6 Tris-HCl,0.1%H2O2)显色15 min;TBS终止反应。裱片,风干;75%乙醇中脱水2 min,95%、95%、100%、100%乙醇中各脱水5 min,二甲苯1、二甲苯2中各脱水5 min;脱水完毕后用中性树胶封片,于普通光镜下观察BDA阳性的皮质脊髓束的走行分布,并采集图像。
2.5.2 荧光定量PCR检测大鼠左侧颈髓(C4-C6)GAP-43 mRNA表达 将颈髓组织取出后立即置于液氮中研磨,采用TRIzol试剂(Thermo Fisher Scientific,Inc.)抽提RNA,并按照Takara逆转录试剂盒说明书进行逆转录操作。将每组的cDNA取出一部分,等比例混匀,稀释,此即为荧光定量PCR的模板。其他步骤按照Roche公司SYBR Green试剂盒说明书操作。
2.5.3 Western blot检测大鼠颈髓(C4-C6)GAP-43蛋白表达 取出颈髓,对组织进行研磨,并加入裂解液,对研磨后的组织匀浆进行超声粉碎20 min,离心,取上清液,进行蛋白浓度测定;灌胶;进行蛋白上样,并加入预染的蛋白Marker,进行10% SDS-PAGE电泳。电泳结束后转移至PVDF膜上;用5%脱脂奶粉封闭1 h,室温;加入一抗(GAP-43按1∶20000稀释),室温环境中孵育2 h,置于4 ℃冰箱,孵育,过夜;复温1 h,条带用TBST漂洗4次,每次8 min;加入二抗(羊抗兔IgG,1∶3000稀释),室温,孵育1 h;TBST漂洗4次,每次8 min;TBS漂洗两次,每次5 min。DAB显色反应后,使用FUsion软件拍照,并用Bio1D分析每个条带的灰度值,以样本灰度值/β-actin灰度值得到的比值作为最终结果。
2.5.4 免疫荧光法检测大鼠颈髓水平Nogo-A、NgR蛋白表达变化 将各组颈髓组织取出并包埋,冰冻切片,每片厚6 μm;将切片置于丙酮中浸泡15 min;0.01 mmol/L PBS漂洗3次,每次5 min,切片置于湿盒;滴加10%山羊血清(即用型山羊血清,0.01 mmol/L PBS配制)溶液室温孵育1 h;将多余的封闭液甩掉,将切片置于湿盒,滴加含0.01 mmol/L PBS的一抗-兔单克隆抗体至Nogo-A(1∶200);兔单克隆抗体至NgR(1∶200);置于4 ℃冰箱孵育过夜,阴性对照采用0.01 mmol/L PBS代替一抗;次日将湿盒于室温下复温30 min;0.01 mmol/L PBS漂洗3次,每次5 min,切片置于湿盒;滴加Alexa 594偶联驴抗小鼠IgG(H+L)抗体(1∶400,由抗体稀释液稀释),室温避光孵育2 h;0.01 mmol/L PBS漂洗3次,每次5 min,切片置于湿盒;滴加DAPI溶液(1∶1000,双蒸水稀释)室温孵育20 min;0.01 mmol/L PBS漂洗3次,每次5 min,切片置于湿盒;滴加少量50%甘油盖玻片封片;荧光显微镜观察,并拍照。
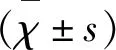
3 实验结果
3.1 各组大鼠不同时间点BWT评分 术后1 w、2 w末,较之假手术组,模型组和药物组评分均低(P<0.05);且药物组于术后2 w末表达高于模型组(P<0.05)(见表1)。
3.2 梗死对侧及梗死侧颈髓CST神经纤维数 在梗死对侧的颈髓后索可见排列整齐的致密的梭形纤维束,梗死侧颈髓后索可见少量的条索状的BDA阳性纤维(见图1)。各组大鼠术后2 w末梗死对侧颈髓BDA阳性CST纤维总计数差异无统计学意义(P>0.05);但梗死侧颈髓后索中模型组和药物组BDA阳性纤维总数明显多于假手术组(P<0.05)(见表2)。
3.3 各组大鼠术后1 w、2 w末颈髓GAP-43 mRNA及蛋白表达 术后1 w末,模型组与假手术组颈髓GAP-43蛋白、mRNA表达均无统计学差异(P>0.05);术后2 w末,药物组和模型组大鼠颈髓水平 GAP-43蛋白和mRNA表达较之假术组均有明显提升(P<0.05)(见图2、图3)。
3.4 各组大鼠术后1 w、2 w末颈髓Nogo-A、NgR蛋白表达 术后2 w末模型组和药物组大鼠梗死侧颈髓水平的Nogo-A、NgR阳性蛋白数量均比同期的假手术组表达减少,其中药物组表达低于模型组(见图4)。

表1 各组大鼠BWT评分情况
与同期假手术相比▲P>0.05,无统计学意义,*P﹤0.05;与同期模型组相比★P﹤0.05

表2 梗死对侧及梗死侧皮质脊髓束BDA阳性纤维总数
与同期假手术组比较*P>0.05,无统计学意义,#P<0.05;与模型组比较△P<0.05
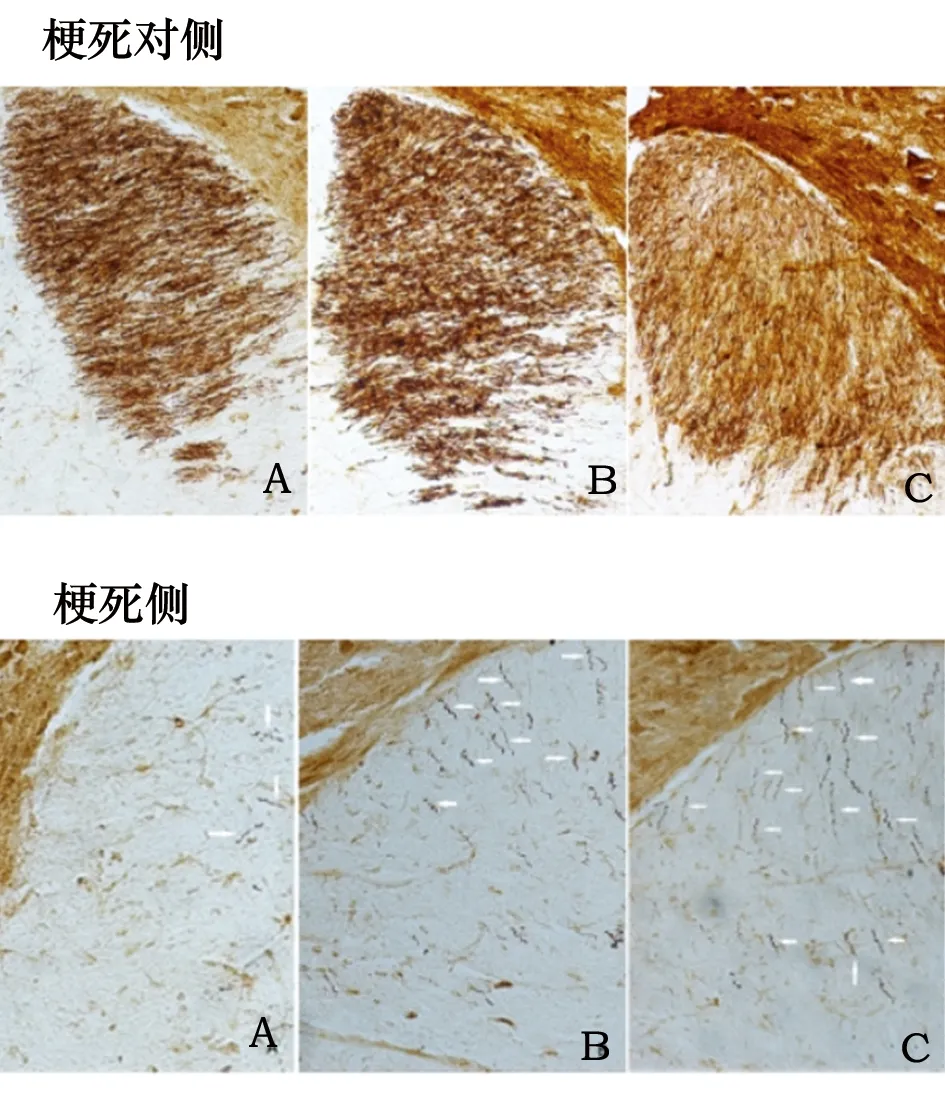
图1 颈髓平面后索区域BDA 阳性CST纤维(200倍镜)。箭头所示为由梗死对侧CST跨越至梗死侧脊髓后索的BDA阳性纤维(A:术后2 w假手术组;B:术后2 w模型组;C:术后2 w药物组)

图2 各组大鼠术后1、2 w末颈髓(C4-C6)GAP-43 mRNA表达。与同期的假手术组相比较*P>0.05,无统计学意义,#P<0.05;与同期的模型组相比较▲P>0.05,无统计学意义(1 w:术后1 w末;2 w:术后2 w末)

图3 各组大鼠术后1 w、2 w末颈髓(C4-C6)GAP-43蛋白灰度比值。与同期的假手术组相比较*P>0.05,无统计学意义,#P<0.05;与同期的模型组相比较▲P>0.05,无统计学意义(1 w:术后1 w末;2 w:术后2 w末。S:假手术组;M:模型组;A:药物组)

图4 术后2 w末大鼠左侧颈髓Nogo-A、NgR蛋白表达。Alexa Fluor488标记的NgR蛋白呈绿色荧光,DAPI 标记细胞核呈蓝色荧光×200(S1:术后1 w假手术组;M1:术后1 w模型组;S2:术后2 w假手术组;M2:术后2 w模型组;A2:术后2 w药物组)
4 讨 论
4.1 西医对缺血性卒中及CST重塑的认识 缺血性卒中,又称脑梗死,该病是临床常见的缺血性脑血管病,常见于老年人[10]。目前,绝大多数卒中患者没有有效的治疗方法,部分原因是大脑修复和神经元可塑性的机制以及它们与行为和功能恢复的关系还不完全清楚。研究表明CST重塑能促进偏瘫肢体的运动功能恢复[11]。脑卒中发生后,发生在脊髓失神经侧的CST重塑可促进缺损运动功能的恢复[12]。这提示,局灶性脑梗死后脊髓可能参与了神经功能修复。
BDA是一种神经纤维示踪剂,可以良好地评价CST的微观结构。通过BDA神经顺行示踪技术,并经过BDA染色显影后,可观察到约99%的CST在锥体交叉后走行于对侧的脊髓白质后索[13]。故本研究使用BDA顺行追踪健侧CST,发现各组大鼠健侧颈髓后索均可见致密的梭形纤维束,其CST纤维总计数于各组大鼠之间并无差异,说明各组大鼠未发生变异,在此前提下,比较梗死侧颈髓BDA阳性CST纤维总计数更具有科学性。正常情况下,少数的颈髓CST会交叉至对侧进行双侧支配,本研究亦发现,术后2 w末,假手术组大鼠的梗死侧颈髓后索中,可见少量的条索状的BDA阳性CST纤维。而模型组和药物组大鼠梗死侧颈髓后索中BDA阳性CST纤维总数明显多于假手术组。而前面已述及各组大鼠梗死对侧的CST纤维总数并未发生明显变化,故模型组、药物组大鼠梗死侧明显增多的CST阳性纤维,极可能是脑梗死后对侧CST纤维芽生并跨越至梗死侧的新生纤维。
GAP-43是一种神经特异性的轴突膜蛋白,参与神经细胞外生长及轴突发育和神经细胞再生,主要表达于轴突的生长锥末端。在神经元的发育及再生过程中,GAP-43可伴随着轴突的生长大量合成,可作为轴突生长的示踪因子。成熟哺乳动物中,GAP-43的表达往往较低,其表达的升高则意味着轴突的再生长。本实验结果表明,术后2 w末,药物组和模型组大鼠梗死侧颈髓GAP-43蛋白表达较之假手术组均有明显提升,这一结果与BDA染色显影结果相吻合,这表明,脑梗死后,健侧CST可发生侧支发芽,并跨越中线至对侧。但我们发现术后1 w末,模型组与假手术组梗死侧颈髓GAP-43蛋白表达并无明显差异,这说明术后1 w末梗死侧颈髓水平CST重塑可能尚未出现,这高度提示局灶性脑梗死发生后,健侧大脑皮质发出的CST中线跨越启动时间可能发生在术后1 w末至术后2 w末之间,故观测术后1 w末、2 w末颈髓层面重要神经生长相关因子的表达,可有助于揭示皮质脊髓束重塑的启动机制。
Nogo-A是一种髓磷脂蛋白,脑梗死后少突胶质细胞过度分泌的Nogo-A是抑制轴突生长的主要因素[14]。Lindau等[15]研究证实,缺血性脑梗死后,Nogo-A蛋白可抑制CST结构及功能的恢复,但通过抗Nogo-A治疗后,跨越中线交叉至去神经脊髓半侧的纤维增加至之前的2~3倍,有效地促进了神经功能的恢复。
NgR是Nogo-A的受体,一种位于神经元表面的糖基醇磷脂结合蛋白。研究证实NgR的拮抗剂亦有助于轴突再生[16]。有研究证实,使用NgR1的拮抗剂治疗后,可通过抑制缺血脑中的细胞凋亡,减少大脑梗死面积,来保护大脑免缺血/再灌注损伤,从而改善缺血诱导的神经缺损情况[17,18]。另有研究表明,Nogo-A与其受体NGR结合后,通过其功能部件激活胞内下游靶基因,抑制轴突再生[19~21]。这些研究结果均说明Nogo-A与其受体NgR不论作为独立因子发生作用还是结合后共同作用,均可对轴突的生长产生一定的抑制作用。
4.2 中医对缺血性卒中的认识 缺血性卒中大多数属中医“中风”范畴,中医认为其病位在脑,精亏髓空是中风病的病机基础。“诸髓者,皆属于脑”,脑髓的充盈与否决定了机体感觉运动功能是否正常。“肾藏精,精生髓”,故肾中精气充盈,脑髓得以充养;肾精亏虚,不能上承于脑,脑髓无以充养,大脑调控机体运动功能失常,可发为中风。因此,临床对卒中病后期恢复的治疗应重视益精填髓法的运用。
本研究选用的复健片即为益精填髓之方药,由制何首乌、桑寄生、淫羊藿、海马、草决明组成。方中何首乌善补肝肾、益精血,填真阴,为君药;淫羊藿性温润,温补肾阳的同时又无伤髓耗髓之弊,与制何首乌同用以达阴阳双补之功;桑寄生补肝肾、益精气,同时又可豁痰熄风,平降气血;草决明益肾水、清肝导滞。此外,方中海马,乃为血肉有情之品,温阳补肾,调气活血,以达阳中求阴之功。由此可见,由诸多填髓中药组成的复健片可综合调理髓的功能,促进卒中病的后期恢复。研究表明,复健片对中风病后受损神经功能的修复有着显著地促进作用[1],可以促进皮质脊髓束重塑[2,3]。而且,复健片对未损伤侧大脑的下调脑区有一定的激活作用[22],还可以上调未损伤侧大脑GAP-43的表达[23]。
4.3 结果与结论 本研究发现,术后1 w、2 w末,模型组梗死侧颈髓的Nogo-A和NgR表达低于同期的假手术组,其中药物组低于同期模型组。而前面已证实,术后2 w末模型组和药物组梗死侧颈髓水平GAP-43蛋白的表达较同期假手术组显著增强,其运动功能评分亦均高于假手术组。再者,我们的前期研究已证实,术后1 w、2 w末,模型组和药物组大鼠梗死侧颈髓层面的cAMP、PKA-C表达均高于同期的假手术组,且药物组表达高于同期模型组[1]。故结合本文的相关研究结果,提示局灶性脑梗死后,支配前肢运动的颈髓由于失神经支配而短时间激活cAMP-PKA通路,抑制Nogo-A-NgR信号通路的传导,从而有助于健侧大脑皮质发出的皮质脊髓束重新跨越中线,自发性地完成一定程度的皮质脊髓束重塑;而复健片可以进一步上调脑梗死后颈髓水平cAMP、PKA-C含量,抑制Nogo-A、NgR表达,最大程度地实现功能性的CST重塑,从而促进缺损神经功能的恢复,这可能是脑梗死后CST重塑的启动机制及复健片干预机制。
本研究突破了以脑为核心的脑梗死后神经功能恢复机制的研究思路,从形态学、分子学和行为学上动态观测了复健片干预下局灶性脑梗死后颈髓层面神经纤维重塑状态变化,为系统地揭示局灶性脑梗死的神经修复机制研究提供了坚实的实验基础。但本研究亦存在不足之处:(1)样本量过少;(2)本研究中涉及的各个因子之间是如何相互影响的,其中间的共同因子尚未涉及,完整的神经通路有待深入研究。
