循环JNK通路相关磷酸酶可以预测肿瘤坏死因子抑制剂治疗银屑病的临床应答
2019-11-08叶颖
叶颖

[摘要] 目的 该研究旨在评估血浆JNK(C-Jun N-terminal Kinase)通路相关磷酸酶(JNK pathway-associated phosphatase,JKAP)与银屑病患病风险、疾病严重程度的关联,以及JKAP对肿瘤坏死因子抑制剂(tumor necrosis factor inhibitors,TNFi)治疗银屑病疗效的预测作用。 方法 该研究连续方便选取98例于2014年5月—2016年4月期间接受TNFi治疗的中重度斑块型银屑病患者,同期纳入100名健康志愿者(health controls,HCs)作为对照。采用酶联免疫吸附方法测定受试者血浆JKAP表达水平。银屑病患者均接受依那西普治疗(etanercept,ETN)6个月,分别在治疗开始后的第1个月(M1)、第3个月(M3)和第6个月(M6)进行银屑病皮损面积及严重度指数(psoriasis area and severity index,PASI)评估,并计算PASI 75和PASI 90应答率。 结果 血浆JKAP在银屑病患者中的表达水平显著低于其在HCs中的表达水平(P<0.001),且其可以很好地预测银屑病患病风险(AUC=0.726)。同时,血浆JKAP水平与银屑病患者的PASI评分显著负相关(P=0.012)。治疗6个月后,65.3%的银屑病患者达到PASI 75,33.7%的患者达到PASI 90,同时,PASI 75(M6)应答者其血浆JKAP表达水平显著低于无PASI 75(M6)应答者(P=0.002),且血浆JKAP表达水平对PASI 75(M6)应答有预测价值(AUC=0.695),而对PASI 90(M6)应答无预测价值。多元逻辑回归模型分析表明,更高的血浆JKAP表达水平可以作为患者更不容易达到PASI 75(M6)应答的独立预测因素(P=0.009)。 结论 循环JKAP表达水平对于银屑病具有诊断价值,并且可以用来预测TNFi治疗银屑病患者的临床应答。
[關键词] JKAP;银屑病;TNFi;PASI;临床应答
[中图分类号] R725 [文献标识码] A [文章编号] 1674-0742(2019)08(b)-0004-07
[Abstract] Objective This study was designed to assess the association of plasma JNK pathway-associated phosphatase (JKAP) with the risk of psoriasis, disease severity, and JKAP for tumor necrosis factor inhibitors, TNFi) predictive effect of the treatment of psoriasis. Methods Convenient selected a total of 98 patients with moderate to severe plaque psoriasis who underwent TNFi therapy between May 2014 and April 2016 were enrolled in the study. 100 healthy controls (HCs) were included as control group. The plasma JKAP expression level of the subjects was determined by enzyme-linked immunosorbent assay. Patients with psoriasis received etanercept (ETN) for 6 months, and the area and severity index of psoriasis lesions (psoriasis) were performed in the first month (M1), the third month(M3), and the sixth month(M6) after the start of treatment of psoriasis area and severity index (PASI) was evaluated and PASI 75 and PASI 90 response rates were calculated. Results The expression level of plasma JKAP in patients with psoriasis was significantly lower than that in HCs(P<0.001), and it was a good predictor of the risk of psoriasis (AUC = 0.726). At the same time, plasma JKAP levels were significantly negatively correlated with PASI scores in patients with psoriasis(P=0.012). After 6 months of treatment, 65.3% of patients with psoriasis achieved PASI 75, 33.7% of patients achieved PASI 90, and PASI 75 (M6) responders had significantly lower plasma JKAP expression levels than those without PASI 75 (M6) responders (P=0.002), and plasma JKAP expression levels have predictive value for PASI 75 (M6) response (AUC = 0.695), while there is no predictive value for PASI 90 (M6) response. Multiple logistic regression analysis showed that higher plasma JKAP expression levels were an independent predictor of PASI 75 (M6) response in patients (P=0.009). Conclusion Circulating JKAP expression levels have diagnostic value for psoriasis and can be used to predict the clinical response of TNFi in patients with psoriasis.
[Key words] JKAP; Psoriasis; TNFi; PASI; Clinical response
银屑病(psoriasis)又称牛皮癣,是一种表现为头面部及四肢躯干皮肤红斑和鳞屑的慢性炎症性皮肤病,全球成人发病率约为0.08%~0.23%,而成人患病率达到0.91%~8.5%[1]。银屑病发病机制复杂,被认为与免疫、遗传、内分泌和精神等有关,按照临床表现可以分为寻常型银屑病、关节炎型银屑病、脓疱型银屑病和红皮病型银屑病等[2]。银屑病容易反复发作,甚至会出现心血管疾病等并发症,给患者带来极大的身体、精神负担[3]。糖皮质激素、局部治疗、物理治疗和系统性非生物制剂等作为银屑病传统治疗方法对广大银屑病患者有很好的治疗效果,然而相当一部分患者使用这些治疗方法并不能控制病情或者不能耐受不良反应[4-5]。因此对于以上治疗方法效果不佳或者不良反应明显的患者,临床上一般使用肿瘤坏死因子抑制剂(tumor necrosis factor inhibitors, TNFi)治疗[6-7]。TNFi如阿达木单抗(adalimumab)、英夫利昔单抗(infliximab)及依那西普(etanercept,ETN)对常规治疗无效或者不耐受的银屑患者具有很好的疗效[8-9]。但是高昂的治疗费用,可能出现的治疗应答缺乏以及长期治疗带来的潜在不良反应如肿瘤和感染一直困扰着使用TNFi治疗的银屑病患者。因此寻找能够预测TNFi治疗银屑病疗效的标志物,从而指导临床用药具有非常重要的意义。
JNK通路相关磷酸酶(JNK pathway-associated phosphatase,JKAP)又称为双特异性磷酸酶22(dual-specificity phosphatases 22,DUSP22),是一種能够激活JNK(c-Jun N-terminal kinase)激酶的双特异性磷酸酶[10-12]。JKAP广泛存在于哺乳动物细胞中,并通过调节T细胞的信号转导从而参与某些免疫性疾病的发生发展[13-15]。研究表明JKAP基因敲除的小鼠对于实验性自身免疫性脑脊髓炎的易感性高于野生小鼠[16],此外,JKAP在肠黏膜中的表达水平与炎症性肠炎的严重程度负相关,且其可以用来预测英夫利昔治疗克罗恩病(Crohns disease,CD)的临床应答,据此推测JKAP或许可以作为预测TNFi治疗银屑病临床应答的生物标志物[17],然而目前并没有相关文献报道。因此该研究连续方便选取98例于2014年5月—2016年4月期间接受TNFi治疗的中重度斑块型银屑病患者,然后评估其血浆JKAP水平与银屑病患病风险、疾病严重程度的关联,以及它对于TNFi治疗银屑病疗效的预测作用。
1 资料与方法
1.1 一般资料
研究连续方便选取在成都市妇女儿童中心医院医院接受TNF抑制剂治疗的中重度斑块型银屑病患者。纳入标准包括:(1)依据病史和临床检查,确诊为斑块型银屑病;②严重度为中重度,定义为受累体表面积(body surface area,BSA)≥10%,银屑病皮损面积及严重度指数(psoriasis area and severity index,PASI)评分≥8分;③年龄大于18周岁;④3个月内未接受过TNF抑制剂或其它生物制剂治疗,且准备接受ETN治疗;⑤可定期随访的患者。排除标准:①有ETN使用禁忌证的患者;②红皮病型银屑病、脓疱型银屑病或药物诱发或加重的银屑病患者;③有其他活动性皮肤病或皮肤感染患者;④存在主要器官(心脏、肝脏和肾脏)功能障碍的患者;⑤有严重感染史、肿瘤史或恶性血液疾病史患者;⑥孕妇或哺乳期妇女。研究同期纳入100名在成都市妇女儿童中心医院医院进行健康体检且年龄、性别和身体质量指数(body mass index,BMI)与入组患者相匹配的健康志愿者(health controls,HCs)作为对照。所有HCs的主要器官功能正常且均无感染史、肿瘤史、自身性免疫疾病史或恶性血液疾病史。该研究已获得所在医院伦理委员会批准,纳入研究之前所有参与者都已签署知情同意书。
1.2 患者信息收集
基线期收集所有入组患者的基本信息,包括年龄、性别、BMI、病程、受累BSA、PASI评分和疾病治疗史,并从体检记录中获得HCs相应的年龄、性别和BMI信息。
1.3 血液样本采集和处理
开始治疗前,使用抗凝管采集所有患者血液样本,然后4℃下1 600 g离心 15 min,取上清血浆至预先准备的无菌离心管中,再次以4℃、16 000 g 离心 10 min。随后将两次离心处理后的血浆标本于-80℃超低温保存待进一步检测。HCs血液样本以同样方式处理保存待后续检测。
1.4 JKAP检测
采用商业化JKAP酶联免疫吸附检测试剂盒(武汉菲恩生物科技有限公司,中国)检测患者和HCs血浆样本中JKAP浓度。依据试剂盒使用说明书,准备试剂、样品和标准品,然后依照说明书中的操作程序加入准备好的样品和标准品,37℃反应90 min,洗板2次,后加入生物素化抗体工作液,37℃反应60 min,洗板3次,再加入辣根过氧化物酶标记的亲和素,37℃反应30 min,洗板5次,随后加入TMB显色液,37℃反应,最后加入终止液终止反应,并在30 min内使用酶标仪在 450 nm 波长下测定吸光度,通过标准曲线计算样品中JKAP浓度。
1.5 治疗和评估
所有患者根据个人意愿和病情需要接受ETN连续治疗6个月,给药方式为:25 mg每周2次皮下注射。治疗期间患者如需联合其他治疗,则详细记录治疗方式及用药情况。研究随访期为6个月,分别在ETN治疗开始后的第1个月(M1)、第3个月(M3)和第6个月(M6)进行PASI评估,并计算PASI 75和PASI 90应答率。PASI 75和PASI 90应答定义为与治疗前相比治疗后PASI评分分别下降75%和90%。随访期间失访或退出研究的患者,以最后一次PASI评分作为后续评分纳入分析。
1.6 统计方法
使用SPSS 22.0统计学软件(IBM,USA)和GraphPad Prism 6.0软件(GraphPad, USA)处理数据。计数资料以频次或频次(百分比)的形式描述,计量资料以均值±标准差或中位值(1/4~3/4分位值)的形式展现。计数资料两组间比较采用χ2检验;连续正态分布的计量资料组间比较采用t检验。采用Wilcoxon 秩和检验和Spearman等级相关检验进行关联性分析,使用受试者工作特征曲线 (receiver operating characteristic curve,ROC曲线)评估JKAP表达水平对于CAD的诊断价值以及对于治疗应答的预测价值,并用逻辑回归模型分析影响PASI 75和PASI 90应答的因素。P <0.05为差异有统计学意义。
2 结果
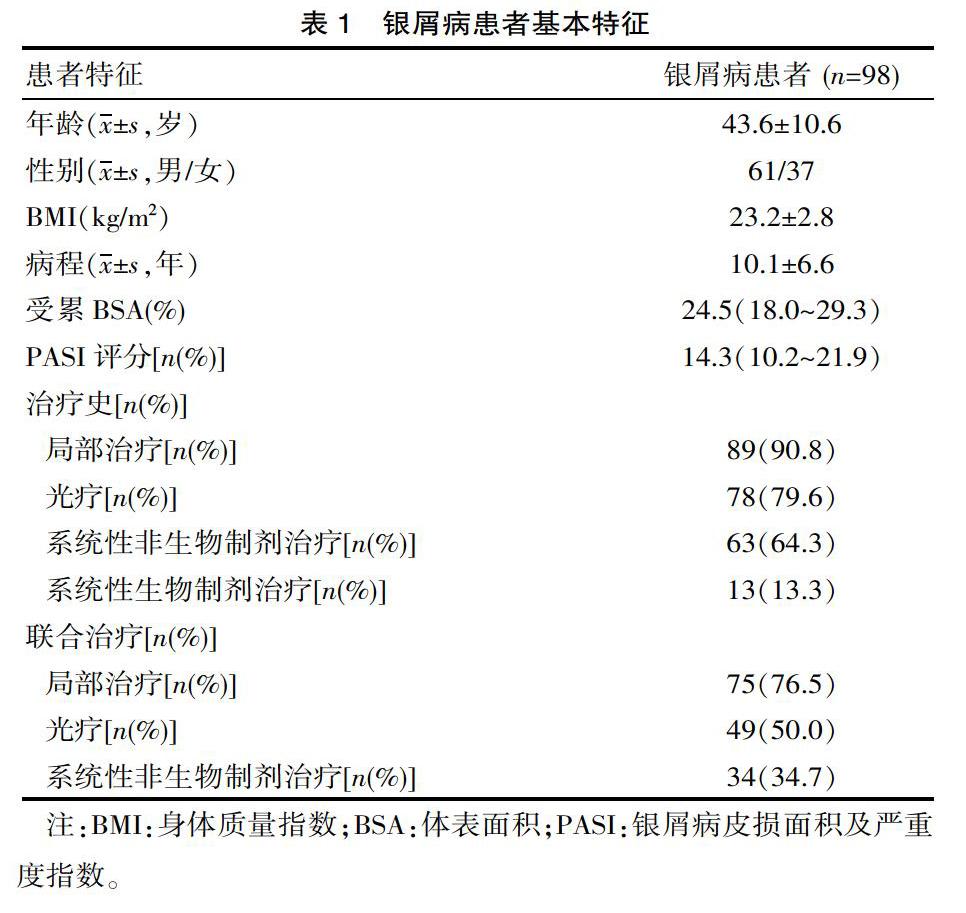
2.1 患者基线信息
98例银屑病患者中男性患者和女性患者人数分别为61例和37例,患者平均年龄为(43.6±10.6)岁,平均BMI为(23.2±2.8)kg/m2。同时,患者的平均病程为(10.1±6.6)年,受累BSA比例和PASI评分的中位值分别为24.5(18.0~29.3)%和14.3(10.2~21.9)。此外,有89例(90.8%)患者有局部治疗史,78例(79.6%)患者有光疗史,63例(64.3%)患者有系统性非生物制剂治疗史,13例(13.3%)患者有系统系生物制剂治疗史。在患者使用ETN治疗过程中,有75例(76.5%)患者同时联合局部治疗,49例(50.0%)患者同时联合光疗,还有34例(34.7%)患者同时联合系统性非生物制剂治疗。见表1。100名HCs中男性67名,女性33名,且100名HCs的平均年龄为(43.0±10.7)岁,平均BMI为(22.7±2.5)kg/m2,HCs与银屑病患者的性别(P=0.484),年龄(P=0.572)和BMI差异无统计学意义(P=0.190>0.05)。
2.2 血浆JKAP对银屑病患病风险的预测作用
血浆JKAP在银屑病患者中的表达水平为28.50(19.75~47.5)pg/mL,显著低于其在HCs中的表达水平64.50(28.50~124.25)pg/mL(P<0.001),见图1A。ROC曲线结果显示血浆JKAP可以很好地区分银屑病患者和HCs(AUC=0.726,95%CI:0.655~0.798),且其在最佳切割点的敏感度达到80.6%,特异度达到64.0%。最佳切割点定义为在这点血浆JKAP表达水平对银屑病患病风险预测作用的敏感度加上特异度的和最大,见图1B。
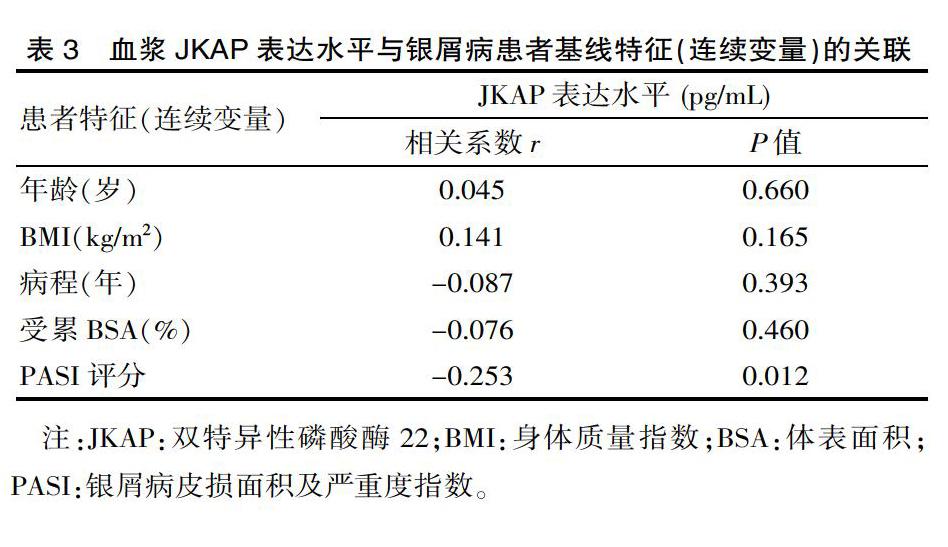
2.3 血浆JKAP表达水平与银屑病患者基线特征的关联
血浆JKAP表达水平与分类变量的基线特征差异无统计学意义(P>0.05),见表2。同时,血浆JKAP表达水平与连续变量的基线特征如年龄(r=0.045,P=0.660),BMI(r=0.141,P=0.165),病程(r=-0.087,P=0.393)和受累BSA比例(r=-0.076,P=0.460)均无关,但是与患者的PASI评分显著负相关(r=-0.253,P=0.012),见表3。
数据采用中位值(1/3~3/4分位值)进行描述。分层比较采用Wilcoxon 秩和检验。P <0.05为差异有统计学意义。JKAP:双特异性磷酸酶22。
采用Spearman等级相关检验。P<0.05为差异有统计学意义。
2.4 患者接受ETN治疗后的临床应答
患者在接受ETN治疗后PASI 75的应答率在各个随访期分别为7.1%(M1),32.7%(M3)和65.3%(M6),同時,PASI 90的应答率在各个随访期分别为1.0%(M1),17.3%(M3),33.7%(M6),见图2。
2.5 血浆JKAP与治疗应答的关联
PASI 75(M6)应答者的血浆JKAP表达水平显著低于无PASI 75(M6)应答者(P=0.002),见图3A,且ROC曲线表明血浆JKAP表达水平可以区分PASI 75(M6)应答者和无PASI 75(M6)应答者(AUC=0.695,95%CI:0.581~0.809),其在最佳切割点的灵敏度和特异度分别达到90.6%和44.1%。最佳切割点定义为在这点血浆JKAP表达水平对PASI 75(M6)应答者预测作用的敏感度加上特异度的和最大,见图3B。然而,循环JKAP表达水平在PASI 90(M6)应答者和无PASI 90(M6)应答者中并没有显著差异(P=0.338,见图3C。JKAP表达水平对PASI 90(M6)也没有预测作用(AUC=0.559,95%CI:0.445~0.674),见图3D。
2.6 影响PASI 75(M6)和PASI 90(M6)应答因素的逻辑回归分析
单元逻辑回归模型结果表明更高的血浆JKAP表达水平(P=0.008),男性(P=0.013),系统性生物制剂治疗史(P=0.009)的患者更不容易达到PASI 75(M6)应答,而联合系统性非生物制剂治疗(P=0.036)的患者则更容易达到PASI 75(M6)应答,见表4。对所有因素进行多元逻辑回归模型分析,结果显示更高的血浆JKAP表达水平(P=0.009),更高的BMI(P=0.025)和系统性生物制剂治疗史(P=0.005)可以作为患者更不容易达到PASI 75(M6)应答的独立预测因素,而联合系统性非生物制剂治疗(P=0.044)可以作为患者更易达到PASI 75(M6)应答的独立预测因素。此外,单元逻辑回归显示没有因素与PASI 90(M6)相关(均P>0.05),多元逻辑回归结果表明系统性生物制剂治疗史可以作为患者更不容易达到PASI 90(M6)应答的独立预测因素(P=0.037),见表5。
3 討论
该研究发现:①血浆JKAP在银屑病患者中的表达水平显著低于其在HCs中的表达水平,且其可以很好地预测银屑病患病风险,此外,血浆JKAP的表达水平与患者PASI评分显著负相关。②血浆JKAP表达水平对PASI 75(M6)应答有预测作用,同时,更高的血浆JKAP表达水平可以作为患者更不容易达到PASI 75(M6)应答的独立预测因素。
JKAP作为双特异性磷酸酶家族中的一员,可以通过去磷酸化来广泛地调节生理病理活动[13,18-19]。有文献报道活动性狼疮性肾炎患者T细胞JKAP的表达水平显著低于非活动性狼疮性肾炎患者(AUC=0.939),同时,JKAP表达水平可以很好地区分活动性狼疮性肾炎患者与非活动性狼疮性肾炎患者且诊断效能高于传统诊断标志物如补体C3(AUC=0.717)和补体C4(AUC=0.628),进一步研究发现JKAP表达与系统性红斑狼疮疾病活动度呈负相关,表明JKAP可以用来评估系统性红斑狼疮的疾病严重程度。此外,另一个研究纳入18例活动CD患者和19例活动UC患者,发现JKAP在活动CD患者和溃疡性结肠炎(ulcerative colitis,UC)患者肠黏膜中的表达水平同样低于HCs,且JKAP可以预测CD(AUC=0.764)和UC(AUC=0.775)的患病风险,同时,JKAP表达水平与CD和UC疾病活动度指标克罗恩病疾病活动指数和Mayo指数显著负相关[20]。这些研究表明JKAP在炎症性疾病患者中低表达且具有诊断意义,同时也可以用来评估这些疾病的严重程度。然而目前JKAP与银屑病患病风险和疾病严重程度的关联尚未见报道。因此,该研究纳入98例接受TNFi治疗的中重度斑块型银屑病患者,评估其血浆JKAP表达水平与银屑病患病风险和疾病严重程度的关联。结果表明血浆JKAP在银屑病患者(28.50(19.75~47.5)pg/mL,中的表达低于HCs(64.50(28.50~124.25)pg/mL)且具有诊断意义(AUC=0.726),同时其表达水平与疾病严重程度PASI评分负相关。可能的原因是JKAP作为一种抗炎基因可以通过抑制T细胞活动来降低免疫炎症介质的表达,因此JKAP在多种免疫性疾病中显著低表达且可以预测疾病患病风险,并且与疾病活动度指标负相关。
至于JKAP在炎症性疾病中的疗效预测作用,目前仅有一篇小样本研究表明JKAP高表达与TNFi治疗CD患者的临床应答负相关,然而,尚无文献报道JKAP对TNFi治疗银屑病临床应答的预测作用[20]。该研究发现PASI 75(M6)应答的患者血浆JKAP表达水平显著低于无PASI 75(M6)应答的患者,且更高的血浆JKAP水平可以作为患者更不容易达到PASI 75(M6)应答的独立预测因素(P=0.009,OR=0.971)。可能的解释是JKAP表达水平与疾病活动度呈反比,所以更低的血浆JKAP表达水平预示着更高的疾病活动度,而具有更高疾病活动度的患者使用TNFi更容易取得PASI 75应答[17, 20]。因此PASI 75(M6)应答的患者其血浆JKAP表达水平显著低于无PASI 75(M6)应答的患者,且更低的血浆JKAP水平可以作为患者更易达到PASI 75(M6)应答的独立预测因素。
该研究尚有一些不足:①该研究是单中心的研究,纳入的银屑病患者都来自于华东地区,因此可能会导致选择偏倚。②该研究纳入的银屑病患者都只评估了6个月的临床应答,因此血浆JKAP对于患者长期使用TNFi的疗效是否有预测作用尚不清楚。③该研究样本量较小,降低了统计效能。
综上所述,循环JKAP表达水平对于银屑病具有诊断价值,并且可以用来预测TNFi治疗银屑病患者的临床应答。
[参考文献]
[1] Parisi R.Global Epidemiology of Psoriasis: A Systematic Review of Incidence and Prevalence[J].Journal of Investigative Dermatology,2013,133(2):377-385.
[2] Larsen MH.Shared Decision Making in Psoriasis: A Systematic Review of Quantitative and Qualitative Studies[J].American Journal of Clinical Dermatology,2019,20(1):13-29.
[3] Singh S,D.pradhan,P.puri,et al.Genomic alterations driving psoriasis pathogen esis[J].Gene,2018(9):42.
[4] Kaushik SB,MG Lebwohl,Psoriasis: Which therapy for which patient: Focus on special populations and chronic infections[J].Journal of the American Academy of Dermatol ogy,2019,80(1):43-53.
[5] Boehncke W-H,NC Brembilla. Unmet Needs in the Field of Psoriasis: Pathogenesis and Treatment[J].Clinical Reviews in Allergy & Immunology,2018,55(3):295-311.
[6] Kim HJ,MG Lebwohl. Biologics and Psoriasis: The Beat Goes On[J]. Dermatologic Clinics,2019.37(1):29-36.
[7] Glines KR.Current pharmacological treatment guidelines for psoriasis and psoriatic arthritis AU-Stiff, Katherine M[J].Expert Review of Clinical Pharmacology, 2018,11(12):1209-1218.
[8] Strober B.Systematic review of the real-world evidence of adalimumab safety in psoriasis registries[J].Journal of the European Academy of Dermatology and Venereology,2018, 32(12):2126-2133.
[9] Yosipovitch G.Impact of Ixekizumab Treatment on Itch and Psoriasis Area and Severity Index in Patients with Mod erate-to-Severe Plaque Psoriasis: An Integrated Analysis of Two Phase III Randomized Studies[J].Dermato logy and therapy,2018,8(4):621-637.
[10] Ju A.Scaffold Role of DUSP22 in ASK1-MKK7-JNK Signaling Pathway[J].PLoS One,2016,11(10): e0164259.
[11] Sanchez-Mut JV.Promoter hypermethylation of the phosph atase DUSP22 mediates PKA-dependent TAU phosphoryl ation and CREB activation in Alzheimer's disease[J].Hippocampus,2014,24(4):363-368.
[12] SekineY.DUSP22/LMW-DSP2 regulates estrogen receptor-α-mediated signaling through dephosphorylation of Ser-118[J].Oncogene,2007,26(41): 6038-6049.
[13] Arruga,F.Mutations in NOTCH1 PEST domain orchestrate CCL19-driven homing of chronic lymphocytic leukemia cells by modulating the tumor suppressor gene DUSP22[J].Leukemia,2017,31(9):1882-1893.
[14] Chapman J FVega.Indolent ALK-negative anaplastic large-cell lymphoma, DUSP22 rearranged, with an unusual immunophenotype in a human immunodef iciency virus patient[J].Histopathology,2017,70(7):1173-1175.
[15] Csikesz CR.Primary Cutaneous CD30-Positive T-Cell Lymp hoproliferative Disorders with Biallelic Rearrang ements of DUSP22[J].Journal of Investigative Dermatology,2013,133(6):1680-1682.
[16] LiJ-P.The phosphatase JKAP/DUSP22 inhibits T-cell rece ptor signalling and autoimmunity by inactivating Lck[J].Nature Communications,2014,5(9):3618.
[17] Chuang H-C. Downregulation of the phosphatase JKAP/DUSP22 in T cells as a potential new biomarker of systemic lupus erythematosus nephritis[J].Oncotarget,2016, 7(36): 57593-57605.
[18] Mélard P.Molecular alterations and tumor suppressive function of the DUSP22 (Dual Specificity Phosphatase 22) gene in peripheral T-cell lymphoma subtypes[J].Oncotarget,2016,7(42):68734-68748.
[19] King RL.Morphologic Features of ALK-negative Anaplastic Large Cell Lymphomas With DUSP22 Rearrang ements[J].The American journal of surgical pathology,2016,40(1):36-43.
[20] Zhou, R.JNK Pathway-Associated Phosphatase/DUSP22 Suppresses CD4(+) T-Cell Activation and Th1/Th17-Cell Differentiation and Negatively Correlates with Clinical Activity in Inflammatory Bowel Disease[J].Frontiers in Immunology,2017(8):781.
(收稿日期:2019-05-16)
