睡眠剥夺对抑郁症模型大鼠海马、前额叶皮质脑源性神经营养因子表达的影响
2019-11-08赵颖琳许崇涛
赵颖琳 许崇涛
(汕头大学精神卫生中心心身医学科,广东 汕头 515061)
抑郁症是全球性的社会问题,是最常见的精神障碍之一,世界卫生组织现已将其列为医疗负担最重的疾病〔1〕。多种抗抑郁药物的研制与使用已帮助抑郁症患者症状大大改善,但这些抗抑郁药物的使用存在明显起效迟缓现象,多数患者需要长时间用药并有各种副作用产生,这不仅降低了患者依从性,还提高了抑郁症自杀率,使药物治疗的安全性与有效性备受质疑〔2,3〕。睡眠剥夺是已知的起效最快的抗抑郁治疗手段之一,可在24 h内发挥抗抑郁效果,相较于其他任何有效的抗抑郁药物,其起效时间显著缩短,且无明显副反应与禁忌证,安全性好〔4〕。有研究报道,40%~60%的抑郁症患者在接受睡眠剥夺治疗后,抑郁状态得到快速缓解〔5〕。尽管睡眠剥夺产生的抗抑郁效果短暂,限制了其在临床上的应用,但因其为无法耐受抗抑郁药物毒副作用的抑郁症患者提供了有效的替代治疗,并提高了难治性抑郁症治疗效果,对推动抑郁症治疗的进展有着重要意义〔6,7〕。本研究旨在对比分析抑郁症大鼠与正常大鼠脑区脑源性神经营养因子(BDNF)水平表达的差异,明确BDNF与抑郁症发病间联系,为抑郁症的早期诊断与合理治疗提供可靠的生物学指标。
1 材料与方法
1.1动物 由中山大学动物中心购入35只成年雄性Sprague Dawley(SD)大鼠,均为清洁级。在实验开始前将大鼠放在汕头大学精神卫生中心动物房内进行为期1 w的合笼饲养,5只/笼,鼠笼的体积为70 cm×60 cm×60 cm,对每只大鼠每日进行1次触摸,每次触摸时间约为2 min,确保大鼠对实验人员的操作适应。饲养1 w后开始进行试验,确保动物房内通风良好,室温调整为22℃,保证大鼠的自由光照、进食及饮水。
1.2动物分组 随机分为正常对照组与应激造模组,测试每只大鼠的自发活动行为。正常对照组纳入5只大鼠,除了开场实验、蔗糖水消耗实验与垫料定期更换外,不给予其他外在的刺激。应激造模组大鼠在慢性轻度且不可预见性应激刺激后按照自发行为实验的结果,选择活动量减少至少30%的具有明显抑郁行为的大鼠纳入后序实验;采用随机法再将其分为抑郁模型组、睡眠剥夺组(抑郁模型+72 h快眼动睡眠剥夺,使用小平台水环境法保证抑郁模型大鼠无法进入自主睡眠状态)及水环境对照组。抑郁模型结合大平台对照组,使用大平台水环境法设置作为睡眠剥夺环境对照组,装置与小水平台水环境法基本一致,但平台直径确保为18 cm,以保证抑郁模型大鼠能够自主睡眠。3组各10只大鼠。
1.3实验流程 在动物房适应性饲养结束后开始第一次开场实验与蔗糖水消耗实验,将实验大鼠分组后,给予应激造模组大鼠连续3 w的慢性轻度不可预见性应激,随后正常对照组与应激造模组均接受第二次开场实验与蔗糖水消耗实验,并根据开场实验与蔗糖水消耗实验所得的结果,选择有明显抑郁样行为的大鼠作为成功模型纳入后续实验,随机分组后,将正常对照组与抑郁模型组大鼠在第二场开场实验及蔗糖水消耗实验后即刻断头取出脑组织,其他2组大鼠继续接受72 h快眼动睡眠剥夺,72 h后对这两大鼠展开第三次开场试验,实验结束后即刻断头并将脑组织取出,使用Western印迹法测定并对比各组大鼠海马区、前额叶皮质BDNF表达水平。慢性轻度不可预见性应激模型建立主要步骤:大鼠行为束缚限制120 min,在4℃的冰水里游泳5 min,禁食1 d,禁水1 d,夹尾1 min,明暗颠倒1 d,倾斜鼠笼45°1 d,潮湿垫料10 h,空瓶放置5 h及40℃高温下震荡10 min,随机安排上述刺激,实验持续21 d,每天给予1种刺激,在实验中每种刺激至少出现2次,但不可连续出现,以确保大鼠无法预料刺激发生。开场实验步骤:使用上海吉良公司提供的DigBehv动物自发活动行为视频跟踪分析系统检测,保证房间内隔音、隔光,有空调,保证室温在所需范围内,每只大鼠观察5 min,将敞箱彻底清洁后再观察下一只大鼠情况。蔗糖水消耗实验步骤:在进行实验前首先训练大鼠的适应与蔗糖水偏爱,实验前1个24 h内,同时将2个装有蔗糖水的瓶子放于饲养笼内,确保大鼠饮用;第2个24 h将饲养笼内放置一瓶1%蔗糖水,一瓶纯净水,让大鼠自行饮水;在实验第3个24 h内先禁食禁水21 h,然后同时给予大鼠一瓶蔗糖水、一瓶纯净水,在3 h后将水瓶取走并称重,计算液体消耗量、蔗糖消耗量与蔗糖水比例。
1.4相关指标检测 实验结束后将各组大鼠断头处死,开颅,取脑,迅速游离出前额叶皮质与左侧海马,置于-80℃保存待检,采用Western印迹方法测定各组大鼠海马和前额叶皮质脑区BDNF表达水平。(1)主要仪器与试剂:常州国华电器有限公司提供的SHZ-82型恒温震荡器、澳大利亚Tencan公司提供的GENIOS型多功能酶标仪、美国Bio-RAD公司提供的电泳槽、转移槽及影像扫描仪、Cell Signaling BDNF抗体试剂盒、上海碧云天生物技术公司提供β-actin抗体、国产分析纯、裂解液蛋白浓度检测试剂盒等。(2)蛋白样品制备:将低温冰箱内海马与前额叶皮质取出置于离心管内,根据1∶10体积比加入裂解液匀浆后置于冰上,重复碾压碾碎裂解30 min,高速离心取上清液。取蛋白标准配置液充分溶解配置蛋白标准溶液,然后取适量溶液使用0.9%氯化钠稀释,根据样品数量配置工作液,混匀后按照不同比例分别加入标准品孔内,同时补充0.9%氯化钠至一定量,适当加入样品并稀释,60℃静置半小时,使用多功能酶标仪观察吸光度值,取各组数据并制作曲线保存,计算蛋白浓度。(3)电泳条件:按照样品浓度计算溶液体积上样,取上样样品离心后加入上样缓冲液,上样前煮沸确保蛋白变性,电泳条件:80 V 15 min,100 V 40 min。(4)转膜:蛋白样品分离后转移至聚偏氟乙烯(PVDF)膜上,加入转移缓冲液后降温,冰浴转膜,转移60 min,300 mA电流,转移完成后转染,并使用清水将未染色染液冲洗干净以观察膜上蛋白。上述步骤结束后进行免疫反应、化学发光、显影、定影及凝胶成像分析。
1.5观察指标 (1)对比正常大鼠与应激造模组大鼠应激前及应激后的自发活动情况,包括总路程、中央路程、周边路程;(2)抑郁模型大鼠建立成功后,记录并比较睡眠剥夺前、睡眠剥夺后各组大鼠自发活动情况,包括总路程、中央路程及周边路程;(3)分别于应激前、应激后记录并对比正常对照组与应激造模组大鼠蔗糖水消耗情况,包括消耗量与消耗百分比;(4)对比各组大鼠海马与前额叶皮质BDNF表达水平。
1.6统计学方法 应用SPSS20.0软件进行单因素方差分析及LSD-t检验。
2 结 果
2.1自发活动比较 应激后,应激造模组总路程、中央路程、周边路程均明显小于正常对照组,差异有统计学意义(P<0.05)。见表1。睡眠剥夺后,睡眠剥夺组总路程、中央路程、周边路程均明显高于水环境对照组,差异有统计学意义(P<0.05)。见表2。
2.2正常对照组与应激造模组蔗糖水消耗情况比较 应激后,应激造模组大鼠蔗糖水消耗量、蔗糖水消耗百分比均少于正常对照组大鼠,差异有统计学意义(P<0.05)。见表3。
2.3各组大鼠海马、前额叶皮质BDNF表达水平比较 4组中,睡眠剥夺组海马、前额叶皮质BDNF表达水平最高,然后由高至低依次为水环境对照组、抑郁模型组、正常对照组,其中,正常对照组与抑郁模型组比较无显著差异(P>0.05),抑郁模型组与水环境对照组比较无显著差异(P>0.05),其他组间比较差异有统计学意义(P<0.05)。见表4。
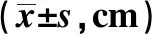
表1 正常对照组大鼠与应激造模组大鼠应激前后自发活动比较
与应激前比较:1)P<0.05;表2、3同
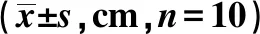
表2 睡眠剥夺组与水环境对照组大鼠睡眠剥夺前后自发活动比较
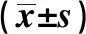
表3 正常对照组与应激造模组大鼠蔗糖水消耗情况比较
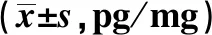
表4 各组大鼠海马、前额叶皮质BDNF表达水平比较
与正常对照组比较:1)P<0.05;与抑郁模型组比较:2)P<0.05;与睡眠剥夺组比较:3)P<0.05
3 讨 论
抑郁症带来的精神残疾不仅给患者带来沉重负担,同时还会加重家庭与社会负担,而患者在疾病支配下出现的自杀、自残、扩大性自杀等暴力行为,更危及社会公共安全〔8,9〕。一直以来,临床未停止对抑郁症患病机制的研究,但该病明确的病理机制仍未有较多收获,主要认为低水平、慢性的、长时间的应激源可能是诱发抑郁或导致抑郁病情加重的主要因素,但该应激源存在不可预见性与多变性,故在抑郁症的预防与治疗方面仍无明显突破〔10〕。
不可预见的慢性轻度应激抑郁模型是现有的动物实验中讨论抑郁症发病机制及治疗应用广泛的动物模型,本研究采用该模型进行实验,造成的动物抑郁状态能够维持几个月,建模高效,与抑郁模型建立要求相符〔11〕。自发活动是动物活动度及其对新鲜环境好奇程度的直观反映,蔗糖水消耗量及消耗比例则是用于快感缺乏评价的客观指标,上述结果均提示大鼠模型在接受21 d慢性不可预见应激后已经出现明显的抑郁样行为,对周围环境的兴趣丧失且缺乏快感,这与抑郁症患者表现出的兴趣缺乏、心境低落、乐趣丧失等核心症状极其相似,可见以该方式创建的抑郁模型有着相当高度的有效率。睡眠剥夺能有效改善抑郁情绪,起效迅速是其主要特点,但值得注意的是,该治疗方案在结束后的恢复性睡眠将会对睡眠剥夺抗抑郁效应产生逆转〔12,13〕。一般来说,睡眠剥夺治疗时间多为24 h,但为减少因恢复性睡眠带来的抗抑郁逆转效应,本研究结果显示,睡眠剥夺组大鼠自发活动显著增加,有接近70%的大鼠其抑郁行为得到显著改善,提示排除活动限制、应激、平台环境等因素造成的影响,睡眠剥夺本身可通过延长剥夺时间逆转大鼠抑郁样行为。
海马还是成年大脑内细胞增生与分化的主要脑区,随着人们对情感障碍研究的深入,抑郁症患病机制及治疗机制的研究重点现已聚集到脑区重要组织〔14〕。近年学者认为抑郁症的发生发展可能与因神经营养因子水平表达下降引起神经元萎缩,导致海马神经出现胶质细胞缺失引起,而抗抑郁药物的使用能够逆转或阻断神经营养因子缺失,进而产生逆转细胞萎缩与缺失的效果,进一步改善抑郁相关行为〔15,16〕。在神经元网络的形成及可塑性中,神经营养因子起到关键作用,BDNF作为重要的神经营养因子家族成员之一,是目前抑郁症神经营养因子假说研究的焦点,其可经与高亲和力受体相结合,对下游磷脂酰肌醇-3激酶-Akt、Ras-分裂原活化蛋白激酶及其他相关信号通路产生激活之效,不仅能加速未成熟神经元生长及发育,还能够对成年脑神经元的可塑性及结构产生调节之效〔16~18〕。本研究结果,与王建〔19〕的报道基本一致,提示抑郁症的产生可能不是BDNF信号通路单独损伤导致,还可能与其他通路损伤有关,但受研究条件的限制,本此研究并未对此进行分析,还应在未来展开相关的研究加以验证。本研究结果提示抑郁模型大鼠海马、前额叶皮质BDNF水平升高可能参加了睡眠剥夺迅速抗抑郁的发生,究其原因,BDNF对细胞长期存活有重要作用,对调节神经递质的释放与突触可塑性均有理想的急性效应。上述结果也从侧面反映了提高抑郁症患者可塑性相关蛋白表达,能够产生快速抗抑郁之效。本研究结果提示,抑郁模型大鼠脑内BDNF与抑郁症发生间并非简单因果联系, BDNF表达可能参与了睡眠剥夺快速抗抑郁机制,但该结果的真实性及其发生的具体机制仍需要在未来展开相关研究加以验证。
综上所述,睡眠剥夺可能通过提高抑郁模型大鼠脑内BDNF表达来促进抑郁模型大鼠行为的改善,调节脑内BDNF表达在未来可能成为抑郁症治疗的新思路及新靶点。
