CYP2C19基因多态性与缺血性脑卒中发病及预后的相关性
2019-11-08严骏翁方中戴伟周瑞祥胡朝梁
严骏 翁方中 戴伟 周瑞祥 胡朝梁
(武汉市第一医院重症医学科,湖北 武汉 430022)
缺血性脑卒中(ISS)是一组以脑组织缺血性损伤为主要临床表现的急性脑血管疾病,具有发病率高、致残率高、死亡率高及复发率高的特点。据统计,我国每年约有200万新发脑卒中病例,其中ISS占70%~80%〔1〕。ISS的发病受饮食、环境、遗传等多种因素交互影响近年对ISS遗传易感基因的研究成为热点。细胞色素P450 药物代谢酶(CYP)2C19活性存在较大的种族及个体差异,这种差异主要由遗传多态性导致。G681A、G636A是CYP2C19基因的主要突变体,有研究发现,CYP2C19 G681A、G636A单核苷酸多态性可增加心血管事件的发生率,并与心血管不良预后相关〔2〕,但其与ISS发生的关系目前少有报道。抗血小板聚集是ISS治疗的主要手段,国内外脑卒中防治指南中均将阿司匹林和(或)氯吡格雷推荐为ISS的一、二级防治药物。但是阿司匹林与氯吡格雷对于血小板活性的抑制作用存在较大的个体差异。有研究报道,分别有15%~48%、17%~39%的ISS患者存在阿司匹林与氯吡格雷抵抗现象〔3〕。抗血小板聚集药物的代谢受CYP2C19活性的影响。有研究发现,CYP2C19基因多态性导致不同人群及个体对抗血小板药物的代谢能力不同,进而出现不同的治疗效果〔4〕。本研究检测120例老年ISS患者与120例健康体检者CYP2C19基因表达情况,分析CYP2C19基因多态性与ISS发生、抗血小板药物代谢及预后的相关性。
1 资料与方法
1.1临床资料 将2014年1月至2016年6月本武汉市第一医收治的老年ISS患者120例作为ISS组,男69例,女51例;年龄60~76〔平均(64.56±3.21)〕岁。纳入标准:①符合《中国急性缺血性脑卒中诊治指南2014》中ISS诊断标准〔5〕,并经头颅计算机断层扫描(CT)或磁共振成像(MRI)检查确诊;②首次发病,且发病时间在12 h内入院;③年龄>60岁。排除标准:①凝血功能障碍,血小板计数<100×109/L或>450×109/L;②脑肿瘤、脑出血、颅内感染、脑梗死后合并出血、短暂性脑缺血发作;③严重心、肝、肾疾病,恶性肿瘤、免疫系统疾病;④近2 w内使用其他抗血小板聚集药物、抗凝药物、溶栓类药物或其他非甾体类抗炎药、质子泵抑制剂者;④对本研究所使用药物过敏者。另选取同期健康体检者120例作为对照组,男70例,女50例;年龄60~78〔平均(65.02±4.02)〕岁,两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,患者均签署知情同意书。
1.2主要试剂与仪器 人血细胞基因组DNA提取试剂盒、2倍Taq预混液10 μl为上海百奥生物科技公司生产,限制性内切酶SmaⅠ、BamHI为北京纽英伦生物技术有限公司生产,琼脂糖为上海博亚生物技术有限公司生产。Roche LightCycler®480Ⅱ实时荧光定量PCR扩增仪为美国Roche公司生产,Bio-Rad Power PAC300电泳仪为美国Bio-Rad公司生产,UVPGDS-8000凝胶成像分析仪为美国UVP公司生产。
1.3治疗方法 ISS组患者入组后均依据《中国急性缺血性脑卒中诊治指南2014》对症治疗,并给予氯吡格雷〔赛诺菲(杭州)制药有限公司生产,国药准字J20080090,规格:75 mg/片,7片/盒〕75 mg/d口服,持续治疗12个月。
1.4观察指标
1.4.1基线资料 收集ISS组人口学特征(性别、年龄、体重指数、吸烟史、饮酒史等),既往史(高血压、糖尿病、心肌梗死、高脂血症等),脑卒中TOAST分型(大动脉粥样硬化型、心源性脑栓塞型、小动脉闭塞型、其他),药物治疗(降压药、降糖药、他汀类药物、其他抗血小板聚集药物),入院时治疗美国国立卫生研究院脑卒中量表(NIHSS)评分。
1.4.2血小板聚集抑制率检测 ISS组治疗第7天采集空腹静脉血4 ml,分别装于肝素抗凝管和柠檬酸抗凝管,2 h内采用TEG5000血栓弹力图仪(美国Haemoscope公司生产)检测二磷酸腺苷诱导的血小板聚集抑制率。血小板聚集抑制率>40%为氯吡格雷敏感,≤40%为氯吡格雷抵抗。
1.4.3预后 治疗6个月后采用改良Rankin量表(mRS)〔6〕评价神经功能恢复情况,mRS评分0~6分,0分为完全没有症状,6分为死亡。mRS≤2分为预后良好,mRS≥3分为预后不良。
1.4.4CYP2C19基因型检测 采用聚合酶链式反应-限制性片段长度多态性法(PCR-RFLP)进行CYP2C19基因型检测。受试者采集肘正中静脉血2 ml,置于EDTA真空抗凝管中,-20℃保存,待测。按照人血细胞基因组DNA提取试剂盒说明提取DNA。根据美国Sequenom公司报道的序列合成CYP2C19基因引物,基因型为G681A、G636A,由华大基因公司合成,引物序列见表1。PCR扩增反应体系(25 μl):2倍预混合液10 μl,上、下游引物各0.5 μl,DNA模板3 μl,蒸馏水6 μl,Taq酶0.25 μl。反应条件:94℃预变性5 min,94℃变性30 s;60℃退火30 s,72℃延伸30 s,共循环35次,72℃ 终末延伸10 min。取PCR扩增产物5 μl进行SmaⅠ、BamHI限制性内切酶酶切后,进行1.2%琼脂糖凝胶电泳,凝胶成像分析仪下观察结果,主要检测基因分型为野生型(GG)、突变杂合型(AG)和突变纯合型(AA),携带野生型(GG)基因者为快代谢型,突变杂合型(AG)为中间代谢型,突变纯合型(AA)为慢代谢型。PCR产物送华大基因公司合成进行双向测序,测序结果与美国Sequenom公司的序列进行对比分析。

表1 CYP2C19基因 G681A型、G636A型引物序列
1.5统计学方法 采用SPSS20.0软件进行t、χ2或Fisher确切概率法检验,各基因型频率进行Hardy-Weinberg平衡验证,对预后的影响因素进行非条件多元Logistic回归分析。
2 结 果
2.1Hardy-Weinberg平衡定律检验 CYP2C19 G681A和G636A在ISS组(χ2=1.380、1.290,P=0.240、0.256)、对照组(χ2=0.265、0.405,P=0.607、0.525)中的分布均符合Hardy-Weinberg 平衡定律,具有群体代表性,见表2。

表2 ISS组与对照组CYP2C19 基因分布〔n(%),n=120〕
2.2CYP2C19基因多态性分析 CYP2C19 G681A的PCR产物长度192 bp,CYP2C19 G636A的PCR产物长度为234 bp。 CYP2C19 G681A经SmaⅠ酶切后,GG型2条带(111 bp、81 bp),AG型3条带(192 bp、111 bp、81 bp),AA型1条带(192 bp),见图1。CYP2C19 G636A经BamHI酶切后,GG型2条带(135 bp、99 bp),AG型3条带(234 bp、135 bp、99 bp),AA型1条带(234 bp),见图2。

M:DL 2000 Marker;2:AA,5、6:GG,1、3、4:AG图1 PCR-SmaⅠ酶切的CYP2C19基因G681A位点基因分型
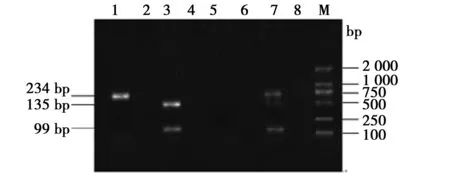
M:DL 2000 Marker;1、3、4、7:AG,2:AA,5、6、8:GG图2 PCR-BamHI酶切的CYP2C19 G636A位点基因分型
2.3CYP2C19 G681A和G636A位点基因分型频数分布 ISS组CYP2C19 G681A位点AA型基因、G636A位点AA型、AG型基因频率显著高于对照组,差异有统计学意义(P<0.05),见表2。
2.4CYP2C19基因多态性与氯吡格雷抵抗的相关性 ISS组中检出氯吡格雷敏感82例,氯吡格雷抵抗38例。氯吡格雷抵抗组CYP2C19 基因G681A位点AG型、AA型频率显著高于敏感组,差异有统计学意义(P<0.05),见表3。
2.5影响预后的单因素分析 ISS组经治疗后预后良好79例,预后不良41例,预后不良组吸烟、高血压、糖尿病、氯吡格雷抵抗比例及CYP2C19 基因G681A位点AG型、AA型频率显著高于预后良好组,差异有统计学意义(P<0.05),见表4。
2.6影响预后的多因素Logistic回归分析 将预后不良作为因变量,上述单因素分析有统计学意义的指标为自变量,进行多因素Logistic回归分析,结果显示糖尿病、氯吡格雷抵抗、携带CYP2C19 基因G681A位点AA型是不良预后发生的独立危险因素,见表5。

表3 CYP2C19 基因多态性与氯吡格雷抵抗的相关性〔n(%)〕
表4 预后良好组与预后不良组一般资料比较

表5 不良预后的多因素Logistic回归分析
3 讨 论
CYP2C19是CYP450家族中重要的药物代谢酶,参与临床2%左右的药物代谢〔7〕。目前已有研究表明,CYP2C19 GG型与冠心病、冠脉综合征等的发生有关〔8,9〕。Bykov等〔10〕研究发现,CYP2C19 G636A 位点AG型基因使动脉粥样硬化的风险增加3.8倍。Daniel〔11〕对急性冠脉综合征患者的研究发现,携带CYP2C19 AA、AG型基因的患者发生脑卒中的风险较未携带者明显增加。本研究提示CYP2C19 G681A位点AA型基因、CYP2C19 G636A位点AA型和AG型基因与ISS的发病有关,推测CYP2C19 A等位基因可能与脑动脉粥样硬化形成有关,进而引发ISS,但其具体机制有待研究。
CYP2C19在抗血小板聚集药物的代谢中发挥重要作用。阿司匹林、氯吡格雷等作为前体药物,需经CYP2C19酶代谢为活性产物方能发挥抗血小板聚集作用。近年研究发现,心脑血管疾病患者服用阿司匹林、氯吡格雷后出现药物抵抗现象存在较大的个体差异,这可能与CYP2C19基因多态性有关〔12,13〕。刘志勤等〔14〕研究报道,携带CYP2C19 AA型、AG型、GG型基因的脑卒中患者在服用氯吡格雷后血小板聚集抑制率分别为(67.5±21.6)%、(57.6±23.4)%、(31.4±15.1)%,携带CYP2C19 AA型、AG型基因是氯吡格雷抵抗的独立危险因素。Rosafio等〔15〕研究也得到相似结论,携带CYP2C19 G681A 和G636A位点A等位基因的患者口服氯吡格雷后起效时间较携带G等位基因的患者慢,达到峰值的时间为24~48 h,而携带G等位基因的峰值短于24 h。本研究证实携带CYP2C19 G681A位点AG型、AA型基因与氯吡格雷抵抗有关。但氯吡格雷抵抗与CYP2C19 G636A基因无明显相关性,这与Cavallari等〔16〕报道相符。Cavallari等〔16〕研究发现,脑卒中患者携带CYP2C19 G681A位点A等位基因与二磷酸腺苷诱导的血小板聚集呈正相关,而患者CYP2C19 G636A基因与二磷酸腺苷诱导的血小板聚集无明显相关性。
目前关于CYP2C19基因多态性对ISS预后的影响研究主要集中在CYP2C19基因对氯吡格雷抵抗的影响上。冯芹等〔17〕研究报道,携带有CYP2C19慢代谢型功能缺失等位基因(AA、AG)的患者更易发生氯吡格雷抵抗,进而导致抗血小板聚集治疗失败,是临床治疗不良预后的独立危险因素。郭朝群等〔18〕研究报道,携带有CYP2C19慢代谢型功能缺失等位基因(AA、AG)是患者不良预后及终点事件发生的独立危险因素。本研究结果显示氯吡格雷抵抗、携带CYP2C19 G681A位点AA型基因是不良预后发生的独立危险因素,与上述报道相符。此外,本研究显示糖尿病也是ISS患者不良预后发生的独立危险因素。Ferlini等〔19〕研究发现,糖尿病患者体内发生的血管内皮损伤、氧化应激等可导致血小板活性增强,进而影响氯吡格雷的药效,增加临床不良终点事件发生的风险。由此提示,对于伴有糖尿病的ISS患者应积极控制血糖或调整氯吡格雷治疗方案,减少糖尿病对预后的影响。
综上所述,CYP2C19 G681A位点AA型基因及 G636A位点AA型、AG型基因是ISS发病的易感基因,而CYP2C19 G681A位点AG型、AA型基因与氯吡格雷抵抗密切相关。此外,G681A位点AA型基因是ISS不良预后的独立危险因素,临床应加强对ISS患者CYP2C19 基因多态性的检测,对于携带A等位基因的患者,及早给予药物干预或调整抗血小板药物治疗方案,改善患者预后。
