不同提取方法对检测单头白背飞虱携带SRBSDV灵敏度的影响
2019-11-07崔丽贤李战彪谢慧婷秦碧霞蔡健和
崔丽贤, 李战彪, 谢慧婷, 秦碧霞, 蔡健和
(广西农业科学院 植物保护研究所/广西作物病虫害生物学重点实验室, 广西 南宁 530007)
南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)是由迁飞性害虫白背飞虱〔Sogatellafurcifera(Horváth)〕进行持久性传播的一种病毒[1-3]。我国广大稻区南方水稻黑条矮缩病毒病的初侵染源主要是春季带毒迁入的白背飞虱,初侵染源在早稻或其他寄主植物上扩繁后,再经白背飞虱传播至中稻或晚稻上[4]。广西毗邻白背飞虱境外虫源地之一的越南,也是境外白背飞虱迁飞至我国东北部稻区的重要途经地[5-6]。2017年广西中晚稻南方水稻黑条矮缩病发生严重,全区绝收面积高达3 133 hm2,造成严重的经济损失,病害发生同时监测到白背飞虱的虫源比率较大[7]。因此,掌握白背飞虱种群带毒情况,对SRBSDV的早期监测及进行科学防控具有重要意义。筛选出灵敏度高、操作简便、经济、快速的检测方法,对检测境外虫源的带毒率和田间初期病苗的快速鉴定有重要的实际意义。对于研究白背飞虱体内病毒的检测,常用Trizol试剂进行RNA提取,RT-PCR的方法进行检测[8]。白背飞虱个体较小,携带RNA量少,提取其总RNA较为困难。目前市场上针对昆虫开发的RNA提取试剂很少,而且多数采用Trizol等氧化性较强的试剂,且价格昂贵,难以应用到大规模的单头虫体检测中。目前,尚未见关于比较白背飞虱体内RNA提取方法的相关报道。因此,采用不同方法提取单头虫体的总RNA,并比较分析其RNA用于RT-PCR检测SRBSDV的灵敏度,以期能找到较好的白背飞虱RNA提取方法用于大规模带毒率检测,为SRBSDV早期检测及科学防控提供指导。
1材料与方法
1.1供试材料
将健康水稻秧苗饲养的白背飞虱转到感染SRBSDV的病株上饲养,待虫体发育为成虫,度过循回期,作为带毒介体备用。将单头白背飞虱成虫转入1.5 mL离心管,并置于-20℃冰箱保存备用。
1.2RT-PCR扩增引物
从Genebank下载已报道的SRBSDV S10片段序列,通过Vector NTI进行序列比对后进行引物设计,引物委托生工生物工程(上海)股份有限公司合成,目的片段长度为920 bp,引物序列如下:SRBSDV-S10-F,5′-CCACATCGCGTCATCTCAAACTAC-3′;SRBSDV-S10-R,5′-CGGTCTTACGCAACGATGAA
CC-3′。
1.3总RNA提取
1.3.1Trizol试剂盒法参照试剂盒试验方法进行。
1.3.2改良Trizol法将单头白背飞虱置于1.5 mL离心管中,加入少量液氮并用烧钝蓝色枪头小心研磨,之后加入50 μL Trizol提取液,继续研磨至虫体裂解完全;向EP管中再次加入600 μL Trizol提取液,剧烈震荡15 s,室温静置5 min;加入400 μL的酚/氯仿/异戊醇(体积比为25∶24∶1),剧烈震荡15 s,室温静置5 min,4℃12 000 r/min离心10 min;取上清液至新的1.5 mL离心管中,加入200 μL的氯仿,剧烈震荡15 s,4℃ 12 000 r/min离心10 min;取上清液至新离心管,加入0.6倍体积的异丙醇,上下颠倒轻轻混匀,-20℃下放置15~20 min;4℃ 12 000 r/min离心10 min,弃上清;加入300 μL 75%乙醇(DEPC水配制)洗涤沉淀,4℃ 6 000 r/min离心4 min,洗涤2次;室温下静置5 min晾干,加20 μL DEPC水溶解沉淀。RNA溶液置于-20℃冰箱(短期)或-80℃冰箱(长期)备用。
1.3.3改良CTAB-LiCl法CTAB提取液提前放入65℃水浴锅内预热30 min;将单头白背飞虱置于1.5 mL的离心管中,加入100 μL CTAB提取液(65℃预热)并用烧钝蓝色枪头研磨后,再加入500 μL CTAB提取液(65℃预热),震荡混匀后置于65℃水浴10~15 min,期间颠倒混匀3~5次;取出离心管冷却至室温,加入500 μL的氯仿/异戊醇(体积比为24∶1),剧烈震荡15 s,4℃静置 20 min,4℃ 12 000 r/min离心15 min;取上清至新的1.5 mL离心管中,加入0.6倍体积的异丙醇,颠倒混匀,-20℃放置40 min,4℃ 12 000 r/min离心15 min;弃上清液,加入300 μL 75%乙醇(DEPC水配制)洗涤沉淀,4℃ 6 000 r/min离心4 min;沉淀晾干后加入120 μL DEPC水重新溶解沉淀,室温静置10 min,加入1/3体积8 mol/L的LiCl溶液,混匀,4℃放置过夜;4℃ 12 000 r/min离心15 min,弃上清;加入300 μL 75%乙醇(用DEPC水配制)洗涤沉淀,4℃ 6 000 r/min离心4 min;室温下静置5 min晾干,加20 μL DEPC水溶解沉淀,RNA溶液置于-20℃冰箱(短期)或-80℃冰箱(长期)备用。
1.3.4改良异硫氰酸胍法将单头白背飞虱置于1.5 mL的离心管中,加入少量液氮并用烧钝蓝色枪头小心研磨后,加入50 μL 异硫氰酸胍提取液,继续研磨至虫体裂解完全;再次加入600 μL异硫氰酸胍提取液,剧烈震荡15 s,室温静置5 min;加入3 mol/L的CH3COONa 40 μL,水饱和酚600 μL,氯仿/异戊醇(体积比为24∶1)120 μL,每加入一种试剂后均颠倒混匀,4℃静置15 min,4℃ 12 000 r/min离心15 min;取上清液,加入0.6倍体积的异丙醇,上下颠倒混匀,-20℃下放置15~20 min;4℃12 000 r/min离心10 min,弃上清;加入300 μL 75%乙醇(DEPC水配制)洗涤沉淀,4℃ 6 000 r/min离心4 min,洗涤2次;室温下静置5 min晾干,加20 μL DEPC水溶解沉淀。RNA溶液置于-20℃冰箱(短期)或-80℃冰箱(长期)备用。
1.3.5NaOH 粗提法将单头白背飞虱置于1.5 mL离心管中,加入20 μL 0.5 mol/L的NaOH溶液(DEPC水处理)并用烧钝蓝色枪头小心研磨,尽量将虫体捣碎,研磨时间约2 min,3 000 r/min离心3 min,取上清液用0.1 mol/L的Tris-HCl缓冲液稀释20倍,置-20℃冰箱(短期)或-80℃冰箱(长期)备用。
1.4RNA电泳检测
将1.3获得的RNA各2.5 μL(除NaOH 粗提法所得的RNA外)于1%琼脂糖凝胶进行电泳分析(120 V,30 min),检测RNA完整性。
1.5RT-PCR扩增灵敏性检测
将1.3获得的RNA提取液0.5 μL及各提取液的10倍梯度稀释液作模板进行一步法RT-PCR,扩增产物约920 bp。反应体系(10 μL):10×RT-PCR Buffer为1 μL,dNTP混合液0.4 μL,5×RT-PCR增强因子2 μL,RNA酶抑制剂0.1 μL,HotmasterTaq聚合酶0.5 μL,Quant RTase 0.1 μL,上下游引物各0.6 μL,RNA模板0.5~0.7 μL,补充ddH2O至10 μL。反应程序:45℃反转录30 min;94℃预变性2 min;94℃变性30 s,58℃退火30 s,75℃延伸45 s,循环35次;75℃继续延伸10 min;反应产物各取2.5 μL经1%琼脂糖凝胶电泳(120 V,30 min)检测后紫外灯下观察结果。
2结果与分析
2.1不同提取方法总RNA的完整性
Trizol试剂盒法、改良Trizol法、改良CTAB-LiCl法和改良异硫氰酸胍法4种方法均可提取到较为完整的RNA,且所提取的RNA条带明亮,边缘整齐,除Trizol试剂盒法和改良异硫氰酸胍法在加样孔附近有污染外,其余2种方法泳道均较干净(图1)。NaOH法提取RNA为粗提取,未进行RNA电泳。
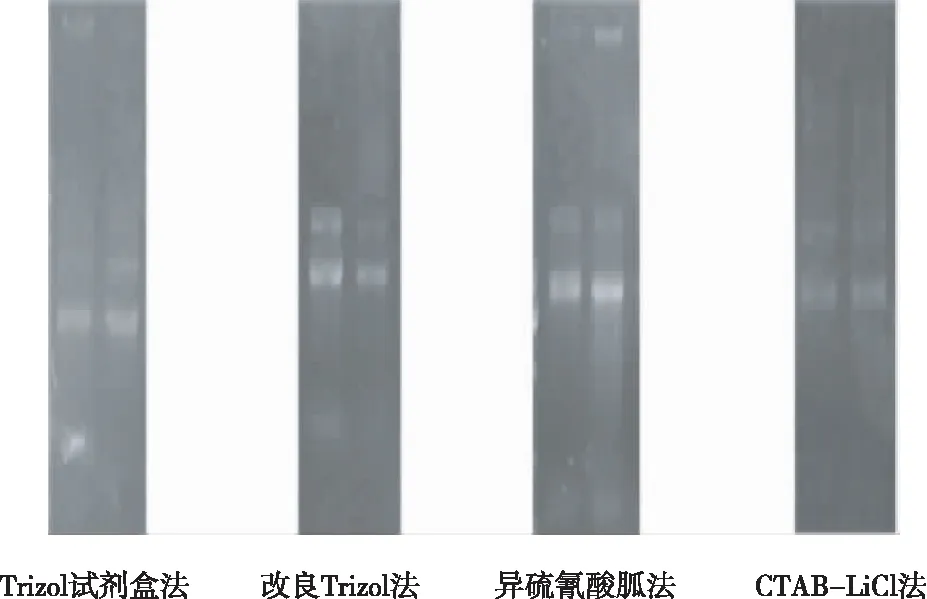
图1不同方法提取的白背飞虱总RNA电泳图谱
Fig.1 Electrophoretogram of total RNA extracted by different methods
2.2不同提取方法获得的RNA纯度及产量
由表1可见,前4种方法提取的RNA OD260/OD280在1.94~2.11,纯度较好,NaOH法最差。由OD260/OD230可以看出,各提取方法所得RNA均脱盐未完全,应加75%乙醇多次洗涤沉淀。质量浓度方面,改良Trizol法最高,为222.43 ng/μL;改良异硫氰酸胍与Trizol试剂盒法适中;改良CTAB-LiCl与NaOH法均较低。
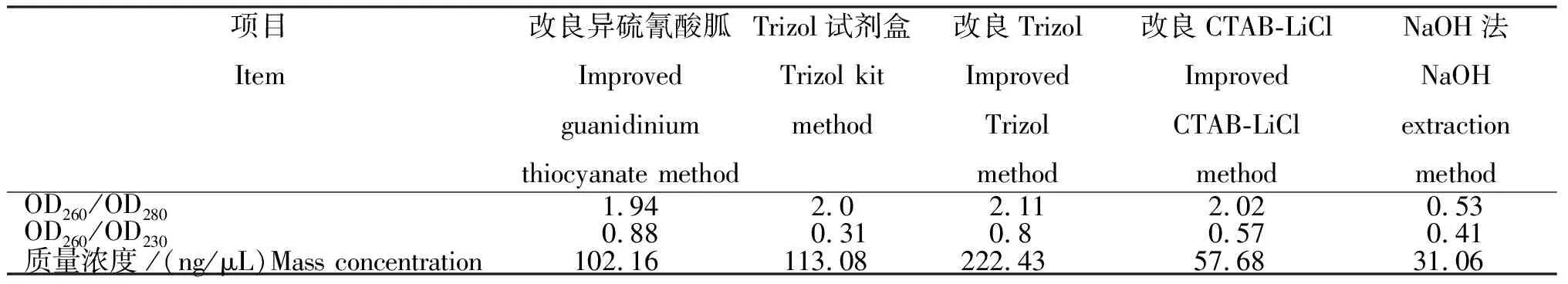
表1不同提取方法获得RNA质量
2.3RT-PCR琼脂糖凝胶电泳
如图2所示,5种方法均能扩增出预期的条带,除NaOH法扩增较差外,其余几种方法无明显差异。
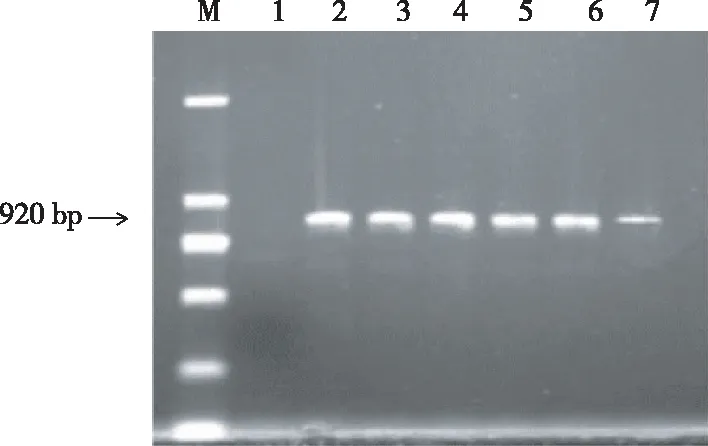
注:M,Mark DL2000;1,健康对照;2,阳性对照;3,Trizol试剂盒法;4,改良Trizol法;5,改良异硫氰酸胍法;6,改良CTAB-LiCl法;7,NaOH法。
Note: M, Mark DL2000; 1, healthy control; 2, positive control; 3, Trizol kit method; 4, improved Trizol method; 5, improved guanidinium thiocyanate method; 6, improved CTAB-LiCl method; 7, NaOH extraction method.
图25种方法获得RNA的RT-PCR产物电泳图谱
Fig.2 RT-PCR product electrophoresis of RNA by five methods
2.4不同提取方法检测SRBSDV的灵敏度
由图3可见,将不同提取方法获得的RNA经DEPC水梯度稀释后(10-1~10-5)进行RT-PCR灵敏性检测,改良Trizol法RT-PCR扩增的灵敏性最高,可以达到10-4,NaOH较差仅10-1,其余3种方法均为10-3。

图3不同RNA提取方法检测SRBSDV的灵敏性
Fig.3 SRBSDV sensitivity of different RNA extraction methods
2.5不同提取方法的耗时
NaOH法粗提耗时最短,5~10 min即可完成RNA粗提;改良CTAB-LiCl法耗时最长,需9.5 h才能完成,操作步骤较多,易造成RNA的降解。而改良异硫氰酸胍法、Trizol试剂盒法、改良Trizol法提取分别需2 h、1 h和1.5 h。
3结论与讨论
由于白背飞虱虫体较小,RNA含量相对更少,在提取过程中不易操作,特别是在研磨、加入裂解液及控制温浴时间等操作上均需小心细致,避免RNA污染降解。试验对比Trizol试剂盒法、改良Trizol法、改良CTAB-LiCl法、改良异硫氰酸胍法和NaOH粗提法5种不同方法对单头白背飞虱RNA的提取效果及对检测灵敏度的影响。结果表明,5种方法均可提取到RNA,除NaOH法外其余4种方法提取的RNA条带均明亮整齐;改良CTAB-LiCl法在破碎虫体时效果不佳,提取的RNA得率较少;改良Trizol法能够提取出较完整虫体RNA,RT-PCR进行病毒检测过程中产物量大,扩增效果稳定,NaOH法仅粗提取虫体的总RNA,用于RT-PCR检测SRBSDV中较其余几种方法灵敏度茶差,但由于其操作简便,费时较短,适用于大量样品的检测。对于昆虫体内RNA的提取最常用的是Trizol法,该方法提取的RNA质量好,可用于后续RT-qPCR等的相关研究[9],试验还说明,Trizol法能够提取高质量的RNA,但该方法不适用于检测大量材料。NaOH粗提法在植物组织DNA提取中有大量应用,较少应用于昆虫RNA的提取,对检测材料数量较多时,具有耗时少,经济实惠的特点,适用于检测白背飞虱携带SRBSDV情况,其检测灵敏性有待进一步研究提高。
