胶原凝胶复合骨髓间充质干细胞对小鼠急性肝衰竭的疗效与机制研究
2019-11-07陈笑艳王经琳施晓雷
陈笑艳,王经琳,施晓雷
(1.南京医科大学 鼓楼临床医学院,江苏 南京 210005;2.东南大学医院 普通外科,江苏 南京 210008;3.南京鼓楼医院 肝胆研究所,江苏 南京 210008)
急性肝功能衰竭(acute liver failure,ALF)是由多种因素引起的突发和严重的肝损伤,伴有大量肝细胞坏死,进而导致严重的肝性脑病、凝血功能障碍、黄疸和进行性多器官功能衰竭。急、慢性肝功能衰竭患者病情险、进展急、预后差,内科药物治疗病死率高达50%~80%[1]。目前肝移植是治疗ALF最有效的方法,但其应用受到了供体短缺、手术费用高昂、术后需要长期服用免疫抑制剂等原因的限制,临床上仅有极少患者可以及时进行肝移植治疗[2]。近年来,骨髓间充质干细胞(mesenchymal stem cells,MSCs)移植作为一种新兴细胞移植疗法,已成为治疗ALF的研究热点[3]。现阶段MSCs移植采用静脉输注的方式,但研究发现只有少量细胞募集到受损组织,并且细胞移植后的较低存活率显著制约其治疗效果[4]。胶原蛋白作为天然细胞外基质,具有良好的生物相容性,因此是理想的生物材料。采用胶原凝胶作为生物支架材料,利用其友好的生物相容性和特有的拓扑三维结构,既可为细胞的靶向递送提供载体,也可提供细胞生长所需的三维环境,进而维持并提高MSCs的功能与存活[5]。在本研究中,建立了由D-氨基半乳糖(D-Gal)诱导的小鼠急性肝衰竭模型,探究胶原凝胶对MSCs分化和增殖等生物学效应的影响,通过检测胶原凝胶复合MSCs移植治疗小鼠急性肝衰竭中取得的疗效,为胶原凝胶复合MSCs应用于临床治疗急性肝功能衰竭提供实验基础和依据。
1 材料和方法
1.1 实验动物
C57BL/6小鼠,SPF级,雄性,6~8周龄,由南京大学医学院附属鼓楼医院动物实验中心提供,实验动物使用许可证SYXK(苏)2014-0052。
1.2 试剂与仪器
1.2.1 实验试剂:胎牛血清(美国Gibco公司)、LDMEM培养基(美国Hyclone公司)、胰酶(美国Gibco公司)、磷酸盐缓冲液(PBS,美国Hyclone公司)、DGal(美国sigma公司)、胶原凝胶(中科院北京遗传发育研究所)、RIPA全蛋白提取试剂盒(南京凯基生物公司)、逆转录试剂盒(日本Takara公司)。GAPDH、AKT、p-AKT、Ki-67、PARP、cleaved-Caspase 3和PI3K一抗(美国Abcam公司)、羊抗兔二抗(美国Abcam公司)。
1.2.2 实验仪器:低温离心机(德国 Eppendorf 公司)、生物安全柜(美国Thermo公司)、精密电子天平(德国Heraeus公司)、显微镜(德国Leica公司)、流式细胞仪(美国Bee ton Dickinson公司)。
1.3 实验方法
1.3.1 小鼠MSCs的分离、培养扩增及鉴定:使用颈椎脱臼法处死4~6周龄的C57BL/6小鼠,无菌条件下剪取小鼠的股骨和胫骨,并清除周围的软组织,用PBS清洗后剪去股骨和胫骨的骨端,用L-DMEM培养基冲洗分离出小鼠骨髓,并置于4 ℃离心机,1 200 rpm离心5 min,弃去上清液,用L-DMEM吹打重悬,并接种到25 T的培养瓶中,培养基为90%的L-DMEM,10%胎牛血清,在含5% CO2的37 ℃的培养箱中培养,24 h后换液去除未黏附细胞,每3天换液,用传至3~6代的MSCs进行实验。流式细胞仪鉴定MSCs,抗体为CD29、CD34、CD44、CD45、CD90小鼠抗体(美国BD、Biosciences公司)。
1.3.2 扫描电镜观察:在超净台内将胶原凝胶与MSCs(1×106/mL)等体积比充分混合,经过戊二醛固定,乙醇脱水后,将其暴露在空气中以逐渐蒸发脱水剂,直至脱水剂挥发干燥,并使用扫描电镜观察。
1.3.3 小鼠ALF模型构建与分组:将105只雄性C57BL/6小鼠随机分为5组,每组21只:对照组、ALF组、ALF+胶原凝胶组、MSCs组和胶原凝胶-MSCs组。ALF组、ALF+胶原凝胶组、MSCs组和胶原凝胶-MSCs组中腹腔注射800 mg/kg D-Gal,12 h后分别于肝脏多点注射200 μL PBS、200 μL胶原凝胶、1×106MSCs和1×106胶原凝胶-MSCs,连续7 d观察小鼠存活率。
1.3.4 肝功能检测:采集小鼠第1~7 d的血液,使用全自动生化分析仪检测血谷丙转氨酶(ALT)和谷草转氨酶(AST)水平。
1.3.5 组织病理学检查:取小鼠第1、3、7天肝脏,4%多聚甲醛固定后常规石蜡包埋、切片,行苏木精-伊红(hematoxylin-eosin,HE)染色及Ki-67、cleaved-Caspase3免疫组化检测,光学显微镜观察并采集图像。
1.3.6 蛋白免疫印迹(Western blotting)检测:使用RIPA全蛋白提取试剂盒在4 ℃下提取肝组织中的蛋白。通过BCA蛋白定量法测定蛋白浓度。等量的蛋白经12% SDS-PAGE电泳分离,湿转法将蛋白转移到PVDF膜上,用5%脱脂奶粉封闭2 h,一抗孵育过夜。在孵育二抗2 h后,用增强化学发光试剂压片曝光显示免疫反应条带。
1.3.7 RT-qPCR检测:Trizol法提取小鼠肝组织中RNA。使用逆转录试剂盒将RNA逆转录为cDNA,以β-actin作为内参,实时荧光定量PCR检测肝组织中iNOS、IL-1β、IL-6、TNF-α、CCl2表达水平,引物序列见表1。
1.3.8 小动物活体成像:ALF诱导12 h后,将经荧光预处理的1×106MSCs、包含1×106MSCs的胶原凝胶复合MSCs肝脏多点注入ALF小鼠的肝脏,进行小动物活体成像检测,并采集图像。
1.4 统计学分析
2 结果
2.1 MSCs的培养和鉴定
小鼠骨髓来源的MSCs表现为纺锤状、梭型,流式细胞显示间质标志物CD29、CD44、CD90表达阳性,而造血标志物CD34、CD45表达较少,这表明培养至第三代后的MSCs的纯度较高(图1A)。
2.2 胶原凝胶促进MSCs肝脏定植
为了评价胶原凝胶是否能为MSCs生长提供三维环境,维持和提高MSCs的功能与存活,我们将胶原凝胶与MSCs混合制备。在扫描电镜下观察,可见MSCs黏附于胶原凝胶构建的三维空间中,表明胶原凝胶有良好的生物相容性,能为MSCs细胞生长提供三维环境,提供移植细胞所需的生存空间(图1B)。接下来我们继续探究胶原凝胶复合MSCs是否能够更好的定植于ALF小鼠肝脏。小鼠腹腔注射DGal 12 h后,分别对ALF小鼠肝脏多点注射经荧光处理后的MSCs和胶原凝胶复合MSCs,动物活体成像可见几乎所有信号均集中于肝脏,脾脏位置无信号,说明MSCs主要分布于肝脏,其他脏器无定植,移植胶原凝胶复合MSCs的信号强于单独移植MSCs的ALF小鼠(图1C)。因此,采用胶原凝胶复合MSCs能够提高MSCs在肝脏的定植。

表1 引物序列
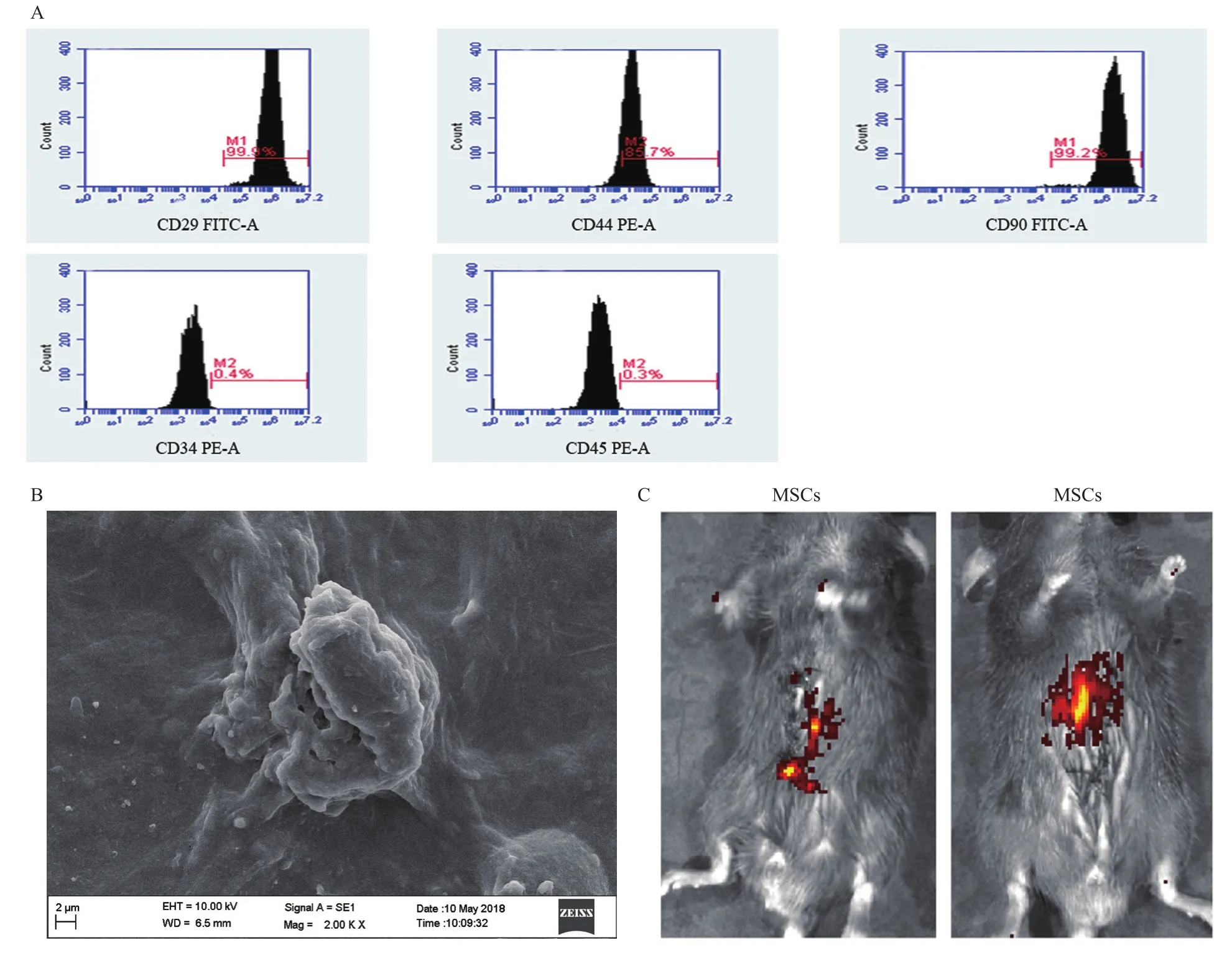
图1 胶原凝胶复合MSCs肝脏定植情况评估
2.3 胶原凝胶复合MSCs移植能有效减轻小鼠ALF
为确定胶原凝胶复合MSCs对ALF小鼠的疗效,我们统计ALF小鼠生存率,结果显示ALF组和ALF+胶原凝胶组小鼠3 d生存率不足15%,二者无统计学差异(P>0.05),MSCs组小鼠7 d生存率为43%,胶原凝胶-MSCs组小鼠生存率显著高于MSCs组(7 d生存率76%)(P<0.05)( 图2A)。各组ALF小鼠的血清ALT、AST均在第3天达到峰值,HE染色也显示ALF组和ALF+胶原凝胶组第3天肝组织表现为大面积大结节、淋巴细胞严重浸润、肝细胞坏死、全小叶出血、肝细胞胞浆肿大,表明D-Gal处理后第3天小鼠肝损伤程度最为严重(图2C)。与ALF组和ALF+胶原凝胶组相比,MSCs治疗组的ALT和AST水平在各时间点均显著降低(P<0.05),胶原凝胶-MSCs组下降更显著(P<0.05) (图2B,由于对照组小鼠ALT和AST指标正常,未在图中列出)。HE染色也显示胶原凝胶-MSCs组较MSCs组组织损伤改善更明显,肝脏损伤程度减轻,中央静脉周围坏死程度减轻,淋巴细胞浸润减少,肝小叶结构未见明显紊乱(图2C)。因此,移植胶原凝胶复合MSCs可以有效改善ALF小鼠的肝脏损伤。因此,移植胶原凝胶复合MSCs对于ALF具有更好的治疗效果。
2.4 胶原凝胶复合MSCs通过抑制细胞凋亡和促进细胞增殖减轻肝损伤
ALF通常发生肝细胞凋亡和出血性坏死[6]。为了探究胶原凝胶复合MSCs如何缓解ALF,我们首先检测肝细胞凋亡水平。cleaved-Caspase 3染色显示,相比MSCs组,胶原凝胶-MSCs组细胞凋亡明显减少(图3A)。Western blotting显示,在胶原凝胶-MSCs组中促凋亡蛋白Bax和PARP1显著降低,而抗凋亡蛋白Bcl2表达更高(图3B)。此外,我们检测第3天各组小鼠肝脏中的炎性因子水平,结果也显示移植胶原凝胶-MSCs较MSCs组能更显著的降低IL-1β、IL-6、TNF-α、iNOS和CCl2等炎性因子水平(图3C,由于对照组小鼠炎性指标正常,未在图中列出)。表明胶原凝胶-MSCs可显著降低肝细胞凋亡和肝脏炎症水平。肝脏损伤后肝细胞可重新获得增殖能力,但在ALF中,肝细胞增殖能力无法代偿肝脏损伤,因此促进肝细胞再生也是缓解ALF的重要策略[7]。研究显示胶原凝胶-MSCs组中Ki-67阳性的肝细胞数目明显多于MSCs组(图3D),相应的增殖相关蛋白PCNA和cyclin D1的表达水平在胶原凝胶-MSCs组表达也更高(图3B)。综上所述,与MSCs组相比,胶原凝胶-MSCs可更好的通过抑制肝细胞凋亡和促进肝细胞增殖减轻D-Gal诱导的肝损伤。
2.5 移植胶原凝胶复合MSCs调控PI3K/AKT信号通路改善肝细胞功能
研究表明PI3K/AKT信号通路是细胞内重要的信号转导通路,在细胞的存活、抗凋亡和增殖中发挥重要的生物调节功能[8]。因此我们推测胶原凝胶复合MSCs是否通过调控PI3K/AKT信号通路来发挥肝脏保护作用。结果显示,移植MSCs组和胶原凝胶复合MSCs组治疗均可以激活PI3K/AKT信号通路,胶原凝胶复合MSCs组激活该通路效果显著优于单独移植MSCs组(图4)。因此,胶原凝胶复合MSCs促进PI3K/AKT通路的激活,抑制D-Gal诱导的肝损伤的凋亡,改善肝细胞功能。

图2 胶原凝胶-MSCs提高MSCs对于ALF的治疗效果
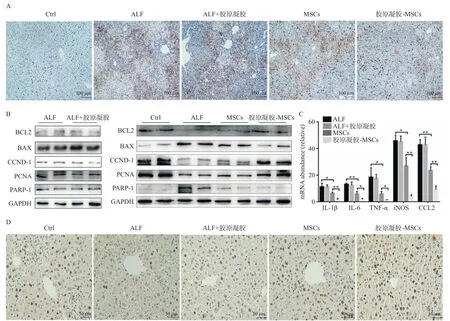
图3 胶原凝胶-MSCs通过减轻肝脏损伤并促进肝脏再生缓解ALF
3 讨论
ALF是具有高死亡率的临床重症,表现为肝细胞功能迅速紊乱,并伴有不可控的全身炎症反应[1]。近年来的研究发现,MSCs移植是更简单、侵入性更小的手术,因此基于细胞的治疗已经被提议作为ALF肝移植的一种切实可行的替代方案[3]。我们课题组前期的研究已经明确MSCs对ALF的治疗作用[9-10],国内其他相关研究也同样证实了这一结论[11]。然而,随着对MSCs研究的深入,MSCs低存活率和高凋亡率显著降低了其治疗效果,因此如何增加细胞定向迁移的数量,将足够量的MSCs有效的递送到受损组织,是干细胞移植的关键因素[12]。近年来,用生物材料承载干细胞可提升干细胞的治疗效果已得到广泛认可[13-14]。胶原凝胶是一种水凝胶,具有水凝胶的特性,可以形成立体三维网状支架,同时胶原蛋白是一种天然来源的高分子蛋白质,它具有来源方便、无毒、低免疫原性和体内可降解等优势[5]。胶原蛋白作为细胞外基质的主要成分,具有良好的生物相容性,是一种理想的生物材料。它不仅提供细胞的靶向递送的载体,同时对细胞黏附和组织三维重建提供支架作用,因此可以提高移植细胞的运输效率,并且可以提供移植细胞在体内所需的生存空间,进而可以增加移植细胞的存活率,并有助于在一定程度上改善单纯的干细胞移植所存在的滞留率和存活率低而使治疗效果受限的问题[5,15]。本实验表明,胶原凝胶本身对ALF无治疗作用,但能明显提高MSCs在肝脏的定植率,同时通过对生存率和肝功能等的检测,表明胶原凝胶能提高MSCs对于ALF的治疗效果。

图4 胶原凝胶-MSCs激活肝脏内PI3K/AKT通路
我们进一步通过免疫组化,证实胶原凝胶复合MSCs可以显著减轻肝细胞凋亡和肝脏损伤,肝脏内TNF-α、IL-1β和IL-6等炎性因子的表达明显降低。同时Ki-67组化和增殖相关蛋白的结果显示胶原凝胶复合MSCs还可以提高损伤后肝细胞的增殖能力,进而提高对于肝损伤的代偿能力,促进ALF肝脏的恢复。同时,我们证实PI3K/AKT通路在胶原凝胶复合MSCs缓解ALF中发挥重要作用。这项研究中,我们证明了移植胶原凝胶复合MSCs在治疗D-Gal诱导的ALF方面表现出优异的疗效。这表明移植胶原凝胶复合MSCs可以作为优化MSCs治疗ALF的新方法。
基于实验结果,我们认为,通过对MSCs进行预处理,胶原支架和MSCs的结合可能是一种针对ALF的重要而有效的治疗方法。本实验也存在一些不足,并未能深入探讨胶原凝胶复合MSCs治疗ALF的具体机制,后续将对其治疗机制进一步的探索与研究,并将研究结果用于临床,为胶原凝胶复合MSCs移植治疗急性肝衰竭的临床应用提供新的理论依据和参考。
