根际促生菌微胶囊剂研发及对苜蓿、燕麦促生效果评价
2019-11-07阿不满杨晓玫张建贵
李 琦,姚 拓*, 阿不满,杨晓玫,,张建贵,,冯 影
(1.甘肃农业大学草业学院/草业生态系统教育部重点实验室, 甘肃 兰州 730070; 2.甘肃草原技术推广总站,甘肃 兰州 730000)
根际促生菌(Plant growth promoting rhizobacteria,PGPR)是指具有一定促生能力的细菌或蓝细菌等[1],具有与植物联合固氮、溶解土壤难溶性磷素、产生植物生长激素和抑制病原菌等优良特性[2-3]。以PGPR菌株为基础研制的微生物菌剂已成为国内外应用微生物研究的热点之一,目前在我国农业农村部登记的微生物菌剂产品共有根瘤菌剂、固氮菌剂、溶磷菌剂、硅酸盐菌剂、菌根菌剂、光合菌剂、有机物料腐熟剂、复合菌剂和生物修复菌剂9个品种[4-5]。微生物菌剂剂型主要有琼脂、固体、颗粒、液体和冻干等5个品种,新剂型的应用主要为包衣剂和微胶囊剂[6]。固体和液体剂型在制备方法上较为方便,但存在许多不足:液体剂型产品保持期短(一般为2~3个月,而农业农村部标准为6个月以上[7]),杂菌污染率高,菌剂施入土壤后微生物存活率低[5];固体剂型的最佳吸附载体材料草炭已为国家重点资源保护对象,作为载体的应用前景不佳,不利于大批量菌剂生产[4]。因此,新剂型的研发与应用十分重要。
微胶囊菌剂(Microcapsules)是指利用物理或化学手段将游离微生物限定在特定载体内,使其高浓度富集制得的一类微生物制剂[8]。目前微胶囊菌剂已广泛应用于食品发酵、制药和废水处理等领域[9-17],但对促生菌微胶囊剂的研究较少,微胶囊菌剂可以提高微生物活性,具有良好的缓释性能,并能屏蔽外界不良环境因素,是理想的菌肥剂型之一。微胶囊菌剂的包埋材料主要为海藻酸钠(Sodium alginate,SA),海藻酸钠是一种从褐藻类植物中提取的高分子多糖[18],当海藻酸钠的水溶液中存在二价阳离子时,海藻酸钠中的钠离子会与二价阳离子发生络合反应,形成凝胶微球[19]。微胶囊制作的操作步骤为:将细胞悬浊液与海藻酸钠溶液混合后,用造粒器具将其滴入一定浓度的氯化钙溶液中,经一段时间的固化反应后制成包埋颗粒[9]。
本研究以前期分离筛选出的4株优良促生菌菌株为基础,海藻酸钠为包埋剂,氯化钙为交联剂,评价微胶囊操作性和成球形,并测定微胶囊菌剂活菌数、包埋率及增殖倍数,确定海藻酸钠与氯化钙的最佳浓度配比,测定微胶囊剂的耐盐、耐碱性。对单一菌株和复合菌株进行包埋,通过盆栽试验探究PGPR微胶囊剂对苜蓿(Medicagosativa)、燕麦(Avenasativa)的促生效果,以期为PGPR微胶囊剂的研发应用提供理论基础和科学依据。
1 材料与方法
1.1 材料
供试菌株:PGPR菌株,由甘肃农业大学草业学院草地微生物多样性实验室提供(表1)。菌株由实验室前期从不同植物根际分离筛选而出,具有较强的固氮、溶磷和分泌植物生长素等能力。

表1 供试菌株
供试植物:燕麦品种陇燕3号(Avenasativa‘Longyan No.3’),发芽率≥90%;苜蓿品种陇威6010(Medicagosativa‘Longwei 6010’),发芽率≥98%,由甘肃农业大学草业学院提供。
盆栽容器:市售塑料杯,高17.7 cm,上口直径8.9 cm,下口直径5.6 cm,杯底部扎有5~10个2 mm圆孔用于渗水。
包埋剂:海藻酸钠(SA),分子式:(C6H7NaO6)n,分析纯(Analytical reagent,AR),购自天津光复精细化工研究所,用前配置一定浓度的水溶液,海藻酸钠遇高温高压易变性,因此将海藻酸钠水溶液置于80℃恒温水浴锅中高温灭菌60 min,室温无菌保存备用。
交联剂:氯化钙(CaCl2),分子式:CaCl2·2H2O,试剂AR,购自国药集团化学试剂有限公司,用前配置一定浓度的水溶液,灭菌,室温无菌保存备用。
破囊液(柠檬酸盐缓冲液):0.2 mol·L-1柠檬酸钠(分子式:C6H5Na3O7)溶液,试剂AR,灭菌。
造粒器具:一次性无菌注射器,规格20 mL,针头型号1.2×30,购自镇江康利医疗器械有限公司。
1.2 方法
1.2.1微胶囊菌剂制备 于超净工作台中,按以下步骤操作:1)取斜面保存的菌株接种于LB液体培养基中,经摇床培养的菌液测定吸光度值(Optical density,OD)大于0.5后与包埋剂以1∶1的比例混合,分别使混合溶液中SA浓度为2%,3%,4%。2)配制浓度为2%,3%,4%的CaCl2溶液,将3种浓度的CaCl2溶液分别置于磁力搅拌器上,注射器分别吸取步骤1中制备好的3种浓度的混合溶液,针头垂直对准CaCl2溶液液面中心位置,液面高度15~20 cm,缓慢推动注射器活塞,使混合溶液呈水滴状滴入CaCl2溶液中,液滴滴落速度保持在25~30滴·min-1,经一段时间的固化交联反应形成微胶囊,共制成9个浓度处理配比。3)将制备出的颗粒室温下交联24 h后滤出,无菌生理盐水洗涤3~5次,4℃保存。将制备好的新鲜包埋颗粒于LB液体培养基中增殖培养48 h,制作增殖后的包埋颗粒,4℃保存。所制得包埋颗粒结合其操作性和成球性,选择最佳浓度配比范围[21]。
1.2.2微胶囊菌剂活菌数、包埋率及增殖倍数测定 称取不同浓度配比下制作的新鲜包埋颗粒和增殖后的包埋颗粒各1 g,参照薛伟明[22]的方法,将0.2 mol·L-1柠檬酸盐缓冲液9 mL加入含包埋颗粒的试管中,旋涡振荡器震荡5~10 min,使微胶囊充分溶解,菌体释放到溶液中,以不接菌的微胶囊作为空白对照,平板菌落计数[7],每个处理3次重复。各指标计算公式[23]如下:
包埋颗粒活菌数(cfu·g-1)=平板计数菌落数/颗粒重;
包埋率(%)=包埋颗粒中的活菌数/总活菌数×100%;
创新型人才要具备合理的创新知识结构。合理的知识结构是提升创新思维能力的基础,没有扎实合理的基础知识、专业知识和创新知识的储备,创新就成了无源之水、无本之木,积累的知识越丰富,思维就越开阔,越易激发创新潜能;创新型人才要具备熟练的创新操作技能,缺少熟练的创新技能,即使产生了灵感,由于缺少横向纵向联系,最终仍是昙花一现。知识经济时代,信息科学技术的迅猛发展,要求创新型人才要具备获取并筛选信息,发现并创造性地解决问题,敢于质疑并求新求变,独立思考和自主判断的自主创新思维和学习能力,强烈的创新欲望,高度的责任感,坚韧不拔、敢“闯”敢“试”的进取精神。
增殖倍数=增殖后微胶囊活菌数/增殖前微胶囊活菌数。
1.2.3微胶囊菌剂耐盐、耐碱性评价 以液体剂型为对照,与筛选出最佳配比的微胶囊菌剂作比较,测定2种剂型菌剂对不同浓度盐、碱环境的耐受性。
耐盐性测定:配制NaCl浓度0.1%,0.2%,0.5%,1.0%,1.5%,2.0%,2.5%的LB液体培养基,并做不接菌的空白对照,每个浓度配制9 mL,共计8个处理,每个处理3次重复,灭菌。将2种菌剂分取1 g接种于配制的培养基中,28℃下160 r·min-1培养48 h,测定2种剂型菌剂在光波长为600下的吸光度值,结果取平均值。OD值测定方法为液体剂型培养到48 h后,以不接菌的培养基调零,测定不同培养液的OD值,然后以NaCl浓度为横坐标,OD值为纵坐标作图。微胶囊剂型培养到48 h后,将培养液滤出,无菌滤纸吸干微胶囊表面水分,加入9 mL柠檬酸盐缓冲液,旋涡振荡器震荡5~10 min充分溶解微胶囊,以不接菌的空白微胶囊的溶解液调零,测定不同溶解液OD值,所得值乘以稀释倍数,作图。
耐碱性测定:配制pH值4.0,5.0,6.0,7.0,8.0,9.0,10.0的LB液体培养基,测定方法同上。
1.2.4微胶囊菌剂对苜蓿、燕麦促生效果评价 2018年9月在甘肃农业大学植物组织培养室进行盆栽试验。选取颗粒饱满且大小一致的苜蓿种子约300粒、燕麦种子约150粒分别置于150 mL三角瓶中,加入1%的NaClO溶液50 mL,不断晃动三角瓶灭菌10 min,无菌水清洗3~5次,然后加入70%酒精50 mL,灭菌5 min,无菌水清洗3~5次,将灭菌后的种子栽于塑料杯中,每杯约装150 g土壤,种子种植量为苜蓿每杯10株,燕麦每杯6株。以液体菌剂和固体菌剂为参比,制备方法参照文献[24],设置空白对照进行室内盆栽试验,并做不接菌的空白微胶囊对照,以探究微胶囊载体材料海藻酸钠对植物的影响。试验共设5个处理,每个处理5个重复:空白对照(Control check,CK);不接菌的微胶囊空白对照(CKO);液体菌剂(JY);固体菌剂(JF);微胶囊菌剂(JN)。苜蓿菌剂选用菌株426制作单一菌株菌剂,燕麦选用菌株ZNYC1,92,Gnyt1制作复合菌株菌剂,菌剂施肥量液体菌剂每杯5 mL,固体菌剂每杯5 g,微胶囊菌剂每杯5 g。待植株生长60 d左右测定各项指标。
测定指标及方法:株高:每个塑料杯中随机选取3株,直尺测量自然高度,结果取平均值[25];根系形态:每个塑料杯中随机选取3株,用根系扫描仪(LA 2400 Scanner,Expression 1000 XL)测定植物的总根长、根表面积、根平均直径、根体积,结果取平均值[26]。
1.3 数据处理
试验数据采用Excel 2010进行处理和图表绘制,方差分析采用SPSS 19.0统计软件。
2 结果与分析
2.1 不同浓度配比下微胶囊的操作性和成球性
操作性和成球性同时较好的有处理SA 3%-CaCl23%,SA 3%-CaCl24%和SA 4%-CaCl23%。从不同浓度配比下包埋颗粒的操作性和成球性可以看出:SA浓度较低时,包埋颗粒易出现拖尾现象,成球性较差。CaCl2浓度较低时,SA与CaCl2的交联能力弱,包埋颗粒易发生粘连。当SA和CaCl2浓度同时过高时,交联程度过强,包埋颗粒易破碎,导致菌体流失(表2)。
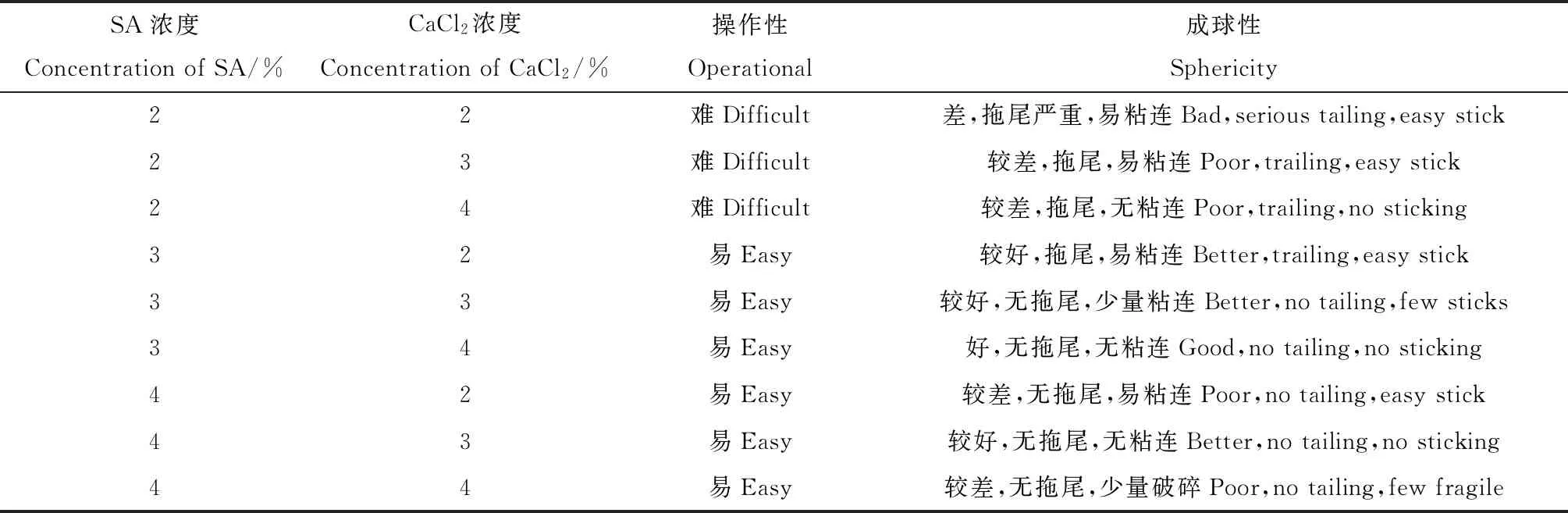
表2 SA-CaCl2不同浓度配比下微胶囊的操作性和成球性
2.2 微胶囊的活菌数、包埋率及增殖倍数
不同浓度处理的微胶囊包埋率均达到80%以上,增殖倍数最高的为SA 3%-CaCl24%处理,此处理下的微胶囊粒径在3~5 mm左右(图1),包埋率达到91.70%,增殖48 h后的微胶囊活菌数为增殖前的9.19倍,显著高于其他处理,活菌数达到1010以上,这是液体和固体剂型很难达到的(表3)。

表3 微胶囊的活菌数、包埋率及增殖倍数
注:同列不同行有相同字母表示差异不显著(P>0.05),有不同字母表示差异显著(P<0.05),下同
Note:Different rows of the same column,same letters indicate no significant difference(P>0.05),small letters mean significant difference (P<0.05),the same as below
2.3 微胶囊菌剂耐盐、耐碱性评价
2.3.1耐盐性 菌液中菌体的浓度与菌液吸光度值(OD值)成正相关关系,OD值越高,菌液含菌量越高。随着盐浓度的升高,2种剂型菌剂OD值均呈现先增高后下降的趋势,在每个盐浓度处理下胶囊菌剂OD值均高于液体菌剂。盐浓度大于1.0%后,随着盐浓度的升高,胶囊菌剂与液体菌剂菌液浓度差异逐渐增大(P<0.05)(图2)。
2.3.2耐碱性 随着溶液pH值的升高,2种剂型菌剂OD值均呈现先增高后下降的趋势。当pH=7.0时,2种剂型菌剂菌液浓度均为最高,且无显著差异(P>0.05),随着pH升高或降低,菌液浓度逐渐下降。与胶囊菌剂相比,液体菌剂菌液浓度下降幅度较高,与胶囊菌剂的差异性显著(P<0.05),且随着pH的升高或降低,差异逐渐增大。当pH=4.0时,胶囊菌剂的OD值为液体菌剂的4倍以上;当pH=10.0时,胶囊菌剂的OD值为液体菌剂的2倍以上(图3)。

图1 微胶囊小球成球情况

图2 不同剂型菌剂在不同NaCl处理下培养48 h的吸光度值

图3 不同剂型菌剂在不同pH处理下培养48 h的吸光度值
2.4 PGPR微胶囊剂对苜蓿、燕麦株高的影响
苜蓿和燕麦处理CKO与处理CK的株高均无显著差异(P>0.05),不同菌剂剂型处理对苜蓿、燕麦株高均有影响,表现为微胶囊菌剂(JN)>固体菌剂(JF)>液体菌剂(JY)。与CK处理相比,苜蓿、燕麦微胶囊菌剂处理株高最高,显著高于CK处理(P<0.05),分别较CK处理增加31.79%,11.60%(图4)。
2.5 PGPR微胶囊剂对苜蓿、燕麦根系形态的影响
2.5.1PGPR微胶囊剂对苜蓿根系形态的影响 处理CKO与处理CK的苜蓿根系形态无显著差异(P>0.05),不同菌剂剂型处理对苜蓿总根长、根表面积和根体积均有影响,表现为微胶囊菌剂(JN)>液体菌剂(JY)>固体菌剂(JF),对苜蓿根平均直径无显著影响。与CK处理相比,微胶囊菌剂处理总根长、根表面积和根体积最高,与CK处理差异均达到显著水平(P<0.05),较CK处理分别增加35.25%,40.02%和30.43%,效果好于液体菌剂和固体菌剂(表4)。

图4 不同剂型PGPR菌肥对苜蓿、燕麦株高的影响

处理Treatment总根长Rootlength/cm根表面积Rootsurfacearea/cm2根平均直径Rootdiameter/mm根体积Rootvolume/cm3CK245.96±26.73b12.87±0.69b0.266±0.0150a0.115±0.0160abCKO233.09±16.16b13.41±0.78b0.240±0.0134a0.081±0.0135bJY290.90±31.40ab16.65±1.03a0.251±0.0109a0.090±0.0141bJF262.53±11.66ab16.00±0.66ab0.237±0.0105a0.064±0.0017bJN332.65±13.53a18.02±0.50a0.259±0.0078a0.150±0.0069a
2.5.2PGPR微胶囊剂对燕麦根系形态的影响 处理CKO与处理CK的燕麦根系形态无显著差异(P>0.05),不同菌剂剂型处理对燕麦总根长、根平均直径和根体积均有影响,对根表面积无显著影响。与CK处理相比,微胶囊菌剂处理总根长、根平均直径和根体积最高,与CK处理差异均达到显著水平(P<0.05),较CK处理分别增加41.56%,25.01%和105.83%,效果显著(表5)。

表5 不同剂型PGPR菌肥对燕麦根系形态的影响
3 讨论
3.1 PGPR微胶囊剂的研发及其耐盐、耐碱性研究
微胶囊化技术作为一种新兴技术,在农业领域引起了普遍关注。目前国内对微胶囊化技术的研究仍处于实验室阶段,存在许多不足:对微胶囊技术的基础研究不够深入;对微胶囊性能的评定体系不够完善;对廉价包埋材料的挖掘不够充分。但PGPR微胶囊剂能提高微生物活性,具有良好的缓释性能,并能屏蔽外界不良环境因素,具有广阔的发展前景[23]。本研究以微胶囊操作性和成球性为评价,进行活菌数、包埋率及增殖倍数测定,确定了微胶囊菌剂的最佳配方,该浓度配比下微胶囊活菌数达到1.08×1010cfu·g-1,增殖前后微胶囊活菌数均高于国家标准《农用微生物菌剂(GB 20287-2006)》[27]对颗粒菌剂有效活菌数(cfu·g-1)≥1.00×108的要求,远高于邵锴等[28]制作的微胶囊菌剂的含菌量,具有一定参考价值。
有研究证实,施用微胶囊菌剂可以延长菌株在土壤中的存活时间,形成局部优势,使菌剂效果可以在植株根际稳定发挥。本研究结果表明,微胶囊菌剂增强了菌体对盐碱胁迫的耐受性,在不同盐碱浓度下菌液浓度均高于液体剂型,原因可能是液体剂型中的微生物与外界直接接触,导致菌体对盐碱胁迫的反应强烈,随着胁迫增加,菌体大量死亡,菌液浓度下降明显,而微胶囊内部形成的微环境为菌株提供了有效的生存空间,起到一定的缓冲和削弱作用,增加菌体对盐碱环境的适应性。韩梅[23]研究发现,当NaCl浓度为2.5%时,液体和草炭剂型活菌数均为0,颗粒菌剂活菌数不足10个·g-1,本研究结果与其结果不同,本研究中NaCl浓度为2.5%时微胶囊菌剂仍有较高的活菌数,原因可能是本试验选用的菌株是由高盐碱土壤中分离出的菌株,在高盐浓度下具有一定生存能力。
3.2 PGPR微胶囊剂对苜蓿、燕麦生长及根系形态的影响
菌剂施入土壤后,菌株能否在复杂的土壤环境下生存并形成优势种群是菌剂发挥促生效果的关键,随着对微生物肥料认识的提升,传统剂型已逐渐不能满足人们对微生物肥料需求的提升,新剂型的研发迫在眉睫。胡小加等[29]研究发现,制作芽胞菌类固定化细胞颗粒,其包埋颗粒能在根际效应的影响下,在植物根系有效定殖。李超敏等[30]研究发现,包埋根瘤菌-光合菌剂复合微胶囊剂,接种效果明显优于菌液;李晓旭等[31]研究发现,施用微胶囊菌剂提高了大豆的产量和品质,显著好于单施液体菌剂和草炭菌剂;何艳慧[32]研究发现,接种菌株SRPG-396微胶囊剂,施加菌剂后棉花鲜重增加17.84%且干重增加33.66%,根干物质量增加13.79%;殷远滔[33]研究发现,利用海藻酸钠-聚乙烯醇-生物炭包埋PGPR菌株,施用后苗高、地径、一级侧根数、地上干重和地下干重较CK增加18.80%,9.90%,43.20%,59.00%和30.50%。本研究对不同剂型菌剂进行盆栽试验比较,结果发现接种PGPR微胶囊剂后,微胶囊载体成分海藻酸钙对苜蓿、燕麦的生长无显著影响,对微生物无毒性,可见海藻酸钠作为载体不参与菌剂对植物的促生作用,对植物微生物均无毒害作用,是理想的载体材料。本研究同时得出,施用PGPR微胶囊剂可以增加苜蓿和燕麦的株高、总根长、根表面积、根平均直径和根体积,对苜蓿和燕麦的生长有一定促进作用,尤其是对苜蓿和燕麦的根系生长促生效果显著,好于液体菌剂和固体菌剂,其主要原因可能是微生物处于内部微环境中,有利于其生长繁殖,微胶囊中的菌株会逐渐被释放出来,从而持续地增加植物根部和根围的活菌数量,形成优势群体,增强与土著菌的竞争能力,并能屏蔽外界不良环境,增强菌株抗逆性,提高菌剂使用效果,增加土壤肥力,因此与液体菌剂和固体菌剂相比,微胶囊菌剂对燕麦和苜蓿根系的促生效果更为显著。
本研究利用根系扫描仪测定了PGPR微胶囊剂对苜蓿、燕麦根系性状的影响,具有一定参考价值。然而土壤是一个复杂的生态体系,影响剂型使用效果的因素复杂多样,今后应加强在建立健全完整的微胶囊菌剂评价体系的研究,制定对微胶囊菌剂释放率、抗逆性、传质性和菌剂在土壤中的定殖状况等的评价标准。
4 结论
本研究确定PGPR微胶囊剂最佳配方为SA 3%-CaCl24%,此配方制作的微胶囊菌剂机械强度较好,提高了菌株对盐碱胁迫的耐受能力。施用PGPR微胶囊剂可明显提高苜蓿和燕麦的株高,以及不同根直径下的总根长,并改善根系形态,对苜蓿和燕麦根系生长的促生效果好于液体菌剂和固体菌剂。
