基于T-RFLP方法的连栽杉木根际土壤细菌群落变化研究
2019-11-07吴则焰赵紫檀林文雄李建鹃刘书影周柳婷刘金福4
吴则焰,赵紫檀,林文雄,李建鹃,刘书影,周柳婷,罗 扬,刘金福4,,*
1 福建农林大学生命科学学院,福州 350002 2 福建省农业生态过程与安全监控中重点实验室,福州 350002 3 作物生态与分子生理学福建省高校重点实验室,福州 350002 4福建农林大学海峡自然保护区研究中心,福州 350002 5福建农林大学林学院,福州 350002
杉木(Cunninghamialanceolata(Lamb.) Hook.)是我国南方重要用材树种,分布遍及16个省(区),因其速生、丰产、优质等特点,与国计民生关系极为密切[1]。杉木林属于人为严格控制下达到相对稳定并保持生态平衡的一种偏途顶级群落,在森林演替过程中具有不可替代的作用[2- 4]。然而,杉木存在严重的连栽障碍问题,表现为在同一林地上多代栽植后,平均木生物量、林分生物量及林分净生产力均呈逐渐下降趋势,植株生长发育不良,病虫害严重,造成产量、品质下降,严重制约着用材林资源的可持续发展[5- 9]。我国南方林区20世纪80—90年代营造的大面积杉木速生丰产林,目前多已进入主伐阶段,均面临多代更新问题。面对如何维持连栽杉木高产高质这一科学难题,连栽障碍机制及其调控是当前杉木人工林栽培亟待解决的重要内容,成为国内外同行研究的前沿热点。
杉木人工林连栽障碍的研究历史较长,期间得到的结论较多,不同的学者观点不一。从生态学角度出发,前人指出杉木人工林多代连栽后,在林分稳定性、抗御病虫害和人为干扰能力以及发挥森林生态效益等方面表现出明显不足,认为引起植物连栽障碍的原因主要有三方面:(1)土壤理化性质恶化、土壤肥力下降[10];(2)植物化感自毒作用[11- 12];(3)土壤微生态环境恶化[13- 14]。针对土壤肥力下降方面,王忠营等[15]、吴鹏飞等[16]研究发现,通过施肥手段防治连栽杉木林地力衰退问题不具可持续性,不宜在生产上大面积推广应用。在植物化感自毒方面,马祥庆[17]、陈龙池等[18]认为自毒作用是杉木连栽障碍的主要原因。然而自毒物质并非在前后代植物之间直接发挥作用,其存在只是诱因,释放到土壤后势必受到微生物的加工、分解、转化等。因此,越来越多的学者认为,自毒物质生态效应的间接作用及其造成土壤微生物区系紊乱是导致植物连栽障碍形成的主要因素[19]。
根际作为植物体的一个重要组成部分,根际微生物群落的宏基因组被认为是植物体的第二基因组,因此根际土壤微生物群落多样性与植物生长发育密切相关[11]。笔者前期运用磷脂脂肪酸技术(PLFA)和变性梯度凝胶电泳技术(DGGE),对不同连栽代数下杉木根际土壤微生物区系开展了研究,发现随着连栽年限的增加,土壤微生物群落真菌数量显著增加,连栽根际土壤中真菌生物多样性提高,特别是镰刀属真菌(Fusariumspp.)等致害真菌所占比例显著提高[20]。此外,笔者前期综合运用Biolog微平板法和高通量测序技术对湿地松(Pinuselliottii)连栽地土壤微生物群落开展研究,发现湿地松连栽后土壤细菌显著减少,致病真菌显著增加,从而加剧土壤微生态失衡[21]。据此,我们推测杉木连栽可能打破根际土壤微生物平衡,导致细菌群落多样性降低,致病菌增加。尽管许多学者开展了植物连栽障碍研究,但目前研究主要集中在土壤养分和化感自毒方面[22- 24],有关连栽杉木根际微生物群落变化的研究较少。本研究运用T-RFLP技术探索连栽杉木根际土壤细菌群落结构变化,旨在从土壤微生态角度揭示连栽杉木根际微生态的变化规律,试图从新的视角揭示杉木连栽障碍机理,为杉木人工林经营管理提供科学依据。
1 材料与方法
1.1 研究区自然概况
连栽杉木样地位于福建省尤溪县国有林场,该林场占地面积21.5 km2,地处中亚热带气候区(25°48′N—26°24′N,117°48′E—118°36′E),归属我国杉木南方主产区。该地区终年温暖湿润,夏冬两季较长而春秋两季较短,冬季有霜期但持续时间短,年均温18.9 ℃(极端低温-7.8 ℃,极端高温40.3 ℃),年均相对湿度为83.0%,年均降水量达1599.6 mm。土壤质地为砾质轻壤土,土层厚度均在100 cm 以上。该林场栽植有3个不同代数的杉木人工纯林,其中第一代杉木林(First Chinese fir rotation plantation,FCP)栽植于1988年,在杂木林皆伐后,采用火烧炼山后用实生杉木苗造林,调查时林龄29a;第二代杉木林(Second Chinese fir rotation plantation,SCP)栽植于1989年,在一代杉木林(32a生)采伐迹地上用实生杉木苗造林,调查时林龄28a;第三代杉木林(Third Chinese fir rotation plantation,TCP)栽植于1992年,在二代杉木林(30a生)采伐迹地上用实生杉木苗造林,调查时林龄25a。
1.2 土壤样品采集与处理
2017年8月,分别在一代杉木林(FCP)、二代杉木林(SCP)和三代杉木林(TCP)设立3个海拔、坡度、坡向、林分密度相近的20 m×20 m实验样地,每代3个样方重复,一共设置9个样方,实验地概况见表1。因根际是土壤-根系-微生物作用最明显的区域,进行着活跃的物质转化和流通以及动力学过程,直接影响着植物的生长发育、养分吸收利用、有益和有害微生物的存活与繁殖,本研究参照张守仕等[25]方法,采用“抖落取样法”采集不同代数杉木根际土壤。先铲去落叶层,用土壤刀挖去上层覆土,剪下细根分枝,轻轻抖动,落下的松散土壤为非根际土;仍黏在根上的为根际土,用毛刷收集后装入自封袋。采用“S”形取样法,每个样方取20株接近平均胸径和树高的杉木根际土,再均匀混合为1份土壤样品。9个样方共获得9个混合后的土壤样品。土样通过2 mm筛选后,一部分冷冻于-80 ℃冰箱;一部分在4 ℃冰箱保存,用于土壤微生物多样性测定;另一部分风干用于土壤理化性质测定。
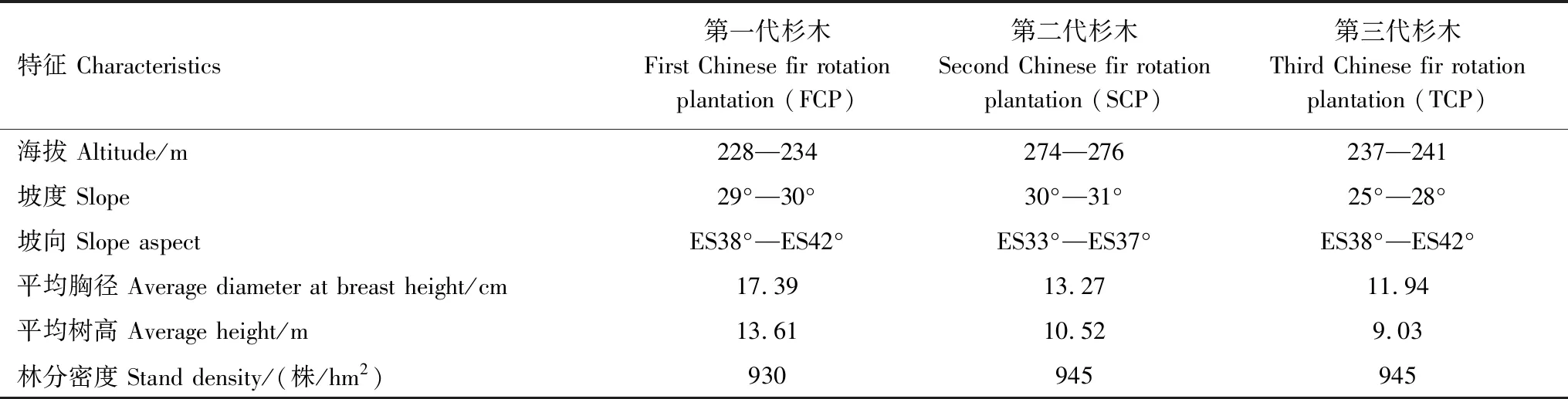
表1 实验样地概况
1.3 土壤理化性质测定
土壤理化性质测定方法参照林大仪[26]方法。用电位法测定土壤pH(水∶土壤为2.5∶1)。土壤全氮(TN)用K2Cr2O7-H2SO4消化法测定,全磷(TP)采用H2SO4-KClO4消煮法测定,速效磷(AP)采用NaHCO3法测定,速效钾(AK)采用CH3COONH4-火焰光度计法测定,全钾(TK)采用NaOH熔融-火焰光度计法测定,速效氮(AN)采用碱扩散法测定,总有机碳(TOC)采用TOC-SSM- 5000A有机碳固体分析仪测定。
1.4 土壤微生物T-RFLP测定
T-RFLP实验步骤参见牟文婷等[27]、林炜铁等[28]。采用SDS-高盐缓冲溶液抽提法提取土壤微生物总DNA,用UNIQ- 10柱式DNA胶回收试剂盒回收纯化后,用带荧光标记的通用引物8- 27F和926- 907R进行其保守区目的片段扩增,PCR产物进行1%琼脂糖凝胶电泳检测,再用胶回收试剂盒纯化回收目的条带。因双酶切具有局限性,本研究采用4种限制性内切酶(MspI、HaeIII、AluI和AfaI),对纯化后的PCR产物进行酶切消化。酶切产物脱盐后与上样缓冲液和标准Maker混合,在ABI自动测序分析仪上进行毛细管电泳。因样品经酶切消化后产生的末端限制性片段(T-RFs)数量太多,本研究选择长度在0—600 pb,荧光强度高于50的片段进行统计分析[29- 31]。由于4种酶切产生的T-RFs数量不同,在计算多样性指数时,统一选取产生T-RFs数量最多的AluⅠ酶切作为分析对象。图谱采用GeneMakerV1.2软件进行分析,并与数据库比对,鉴定末端限制性片段(T-RFs)对应的微生物类群。
1.5 数据处理
采用Excel 2003进行数据初处理和制图,采用DPS 7.05与SSPS 13统计软件进行方差分析、主成分分析及多样性指数计算。其中,用Duncan法进行样本间差异显著性分析,多样性指数计算公式如下:Simpson指数:D=1- Σ(Pi)2;Shannon指数:H= -Σ(Pi)log2Pi;Evenness指数:E=H/Hmax,Hmax=Log2(S)。式中Pi表示相对峰面积,即各个峰面积占总峰面积的比值;S表示丰富度指数,即T-RFs的个数。
2 结果与分析
2.1 不同栽植代数杉木根际土壤理化性质差异
土壤理化性质测定结果见表2。除总有机碳(TOC)、速效磷(AP)两个指标外,土壤的全氮(TN)、速效氮(AN)、全磷(TP)、全钾(TK)、速效钾(AK)均呈现出FCP > SCP > TCP的趋势,即连栽导致土壤养分和肥力逐年降低。其中全氮(TN)从FCP的1.23 g/kg下降到TCP的0.96 g/kg,降幅达21.95%;速效氮(AN)下降了27.15%,全磷(TP)下降了26.67%,全钾(TK)下降了14.96%,速效钾下降了12.35%,即杉木生长所需氮磷钾营养元素均呈下降趋势,其中氮元素下降尤其剧烈。从土壤碳氮比(C/N)来看,TCP土壤最高而FCP土壤最低,整体呈现FCP < SCP < TCP趋势。
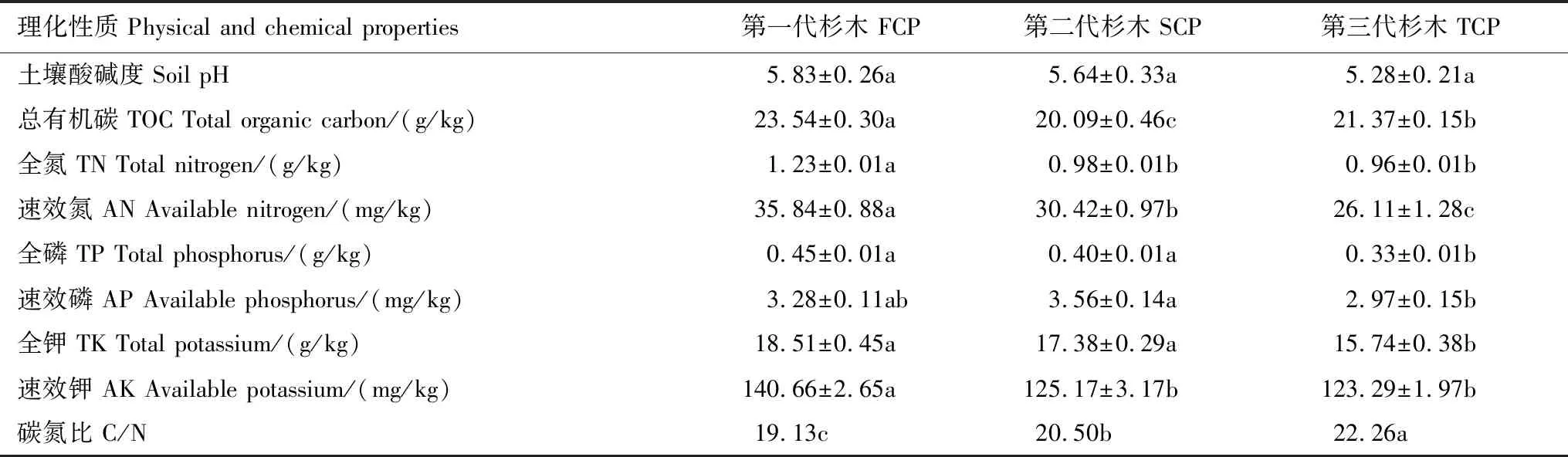
表2 土壤主要理化性质
同一列不同的小写字母表示差异达0.05显著水平
2.2 不同栽植代数杉木根际土壤细菌T-RFs分析
分别利用HaeⅢ、MspⅠ、AfaⅠ和AluⅠ限制性内切酶,对扩增后的16S rRNA产物进行酶切消化。在FCP样品中找到有效T-RF片段为HaeⅢ249个、MspⅠ187个、AfaⅠ158个、AluⅠ288个;在SCP样品中找到有效T-RF片段为HaeⅢ 179个、MspⅠ143个、AfaⅠ113个、AluⅠ229个;在TCP样品中找到有效T-RF片段为HaeⅢ 180个、MspⅠ123个、AfaⅠ103个、AluⅠ204个。总体而言,末端限制性片段数(T-RFs)在不同代数杉木土壤中呈现FCP >SCP >TCP趋势。相对FCP土壤而言,TCP土壤中的HaeⅢ酶切片段数降低了27.71%,MspⅠ酶切片段数降低了34.22%;AfaⅠ酶切片段数降低了34.81%;AluⅠ酶切片段数降低了29.17%。
2.3 不同栽植代数杉木根际土壤细菌群落多样性差异
根据T-RFs数量计算得到土壤细菌群落多样性(表3)。不同多样性指数均表现为:杉木根际土壤细菌群落多样性随栽植代数增长而减少,呈现FCP >SCP >TCP趋势,与T-RFs片段数量变化趋势基本一致。Shannon-Weiner指数显示FCP最高(5.79±0.02),是TCP(5.47±0.03)的105.85%倍,表明FCP土壤细菌多样性更高;Simpson指数显示FCP最高(0.96±0.02),是TCP(0.83±0.01)的115.66%倍;均匀度指数显示FCP最高(0.78±0.01),是TCP(0.70±0.01)的114.43%倍。可见,多代连栽降低了杉木根际土壤细菌群落多样性。
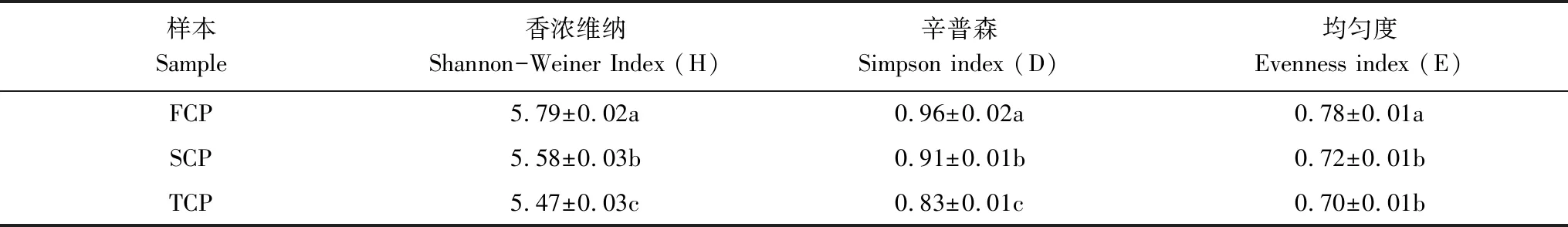
表3 不同连栽代数杉木根际土壤中细菌群落多样性指数
同一列不同的小写字母表示差异达0.05显著水平; FCP: 一代杉木林First Chinese fir rotation plantation; SCP: 二代杉木林Second Chinese fir rotation plantation; TCP: 三代杉木林Third Chinese fir rotation plantation
2.4 不同栽植代数杉木根际土壤细菌群落组成与结构
利用GeneMarkerV1.2并结合网上数据库(http://wdcm.nig.ac.jp/RDP/trflp/#program)分析得到连栽杉木根际土壤细菌群落结构(图1)。不同栽植代数杉木根际土壤共发现细菌12个门类,分别是:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、蓝藻门(Cyanophyta)、螺旋体门(Spirochaete)、拟杆菌门(Bacteroidetes)、热微菌门(Thermomicrobia)、柔膜菌门(Tenericutes)、梭杆菌门(Fusobacteria)、梭菌门(Clostridium)、纤维菌门(Fiber)、其他(others)。其中FCP土壤中,比例超过10%的细菌门类分别是Firmicutes(34.97%)、Cyanophyta(24.04%)、Actinobacteria(12.57%)和Proteobacteria(10.93%);SCP土壤中,比例超过10%的细菌门类分别是Cyanophyta(31.51%)、Firmicutes(28.77%)、Proteobacteria(14.16%)和Actinobacteria(10.96%);TCP土壤中,比例超过10%的细菌门类分别是Cyanophyta(30.56%)、Firmicutes(20.47%)、Proteobacteria(20.18%)和Actinobacteria(17.51%)。
此外,变形菌门在TCP土壤比例最高达20.18%,在FCP和SCP土壤中分别为10.93%和14.61%,呈现随栽植代数增加而递增趋势;厚壁菌门在FCP、SCP和TCP土壤比例分别为34.97%、28.77%和20.47%,呈现随栽植代数增加而递减趋势;放线菌门在TCP土壤比例最高达17.51%,而在FCP和SCP土壤中比例较为接近,分别为12.57%和10.96%。
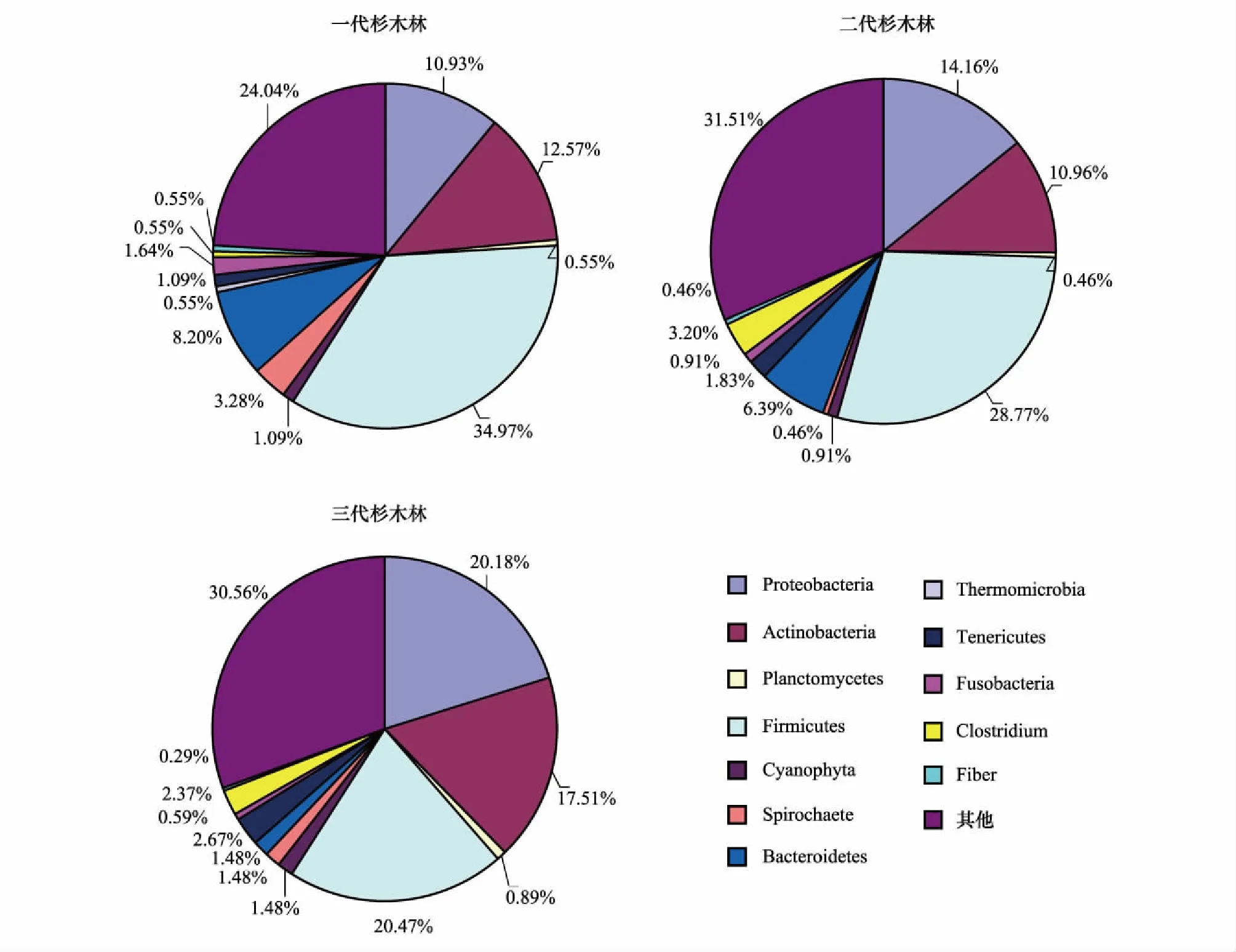
图1 连栽杉木根际土壤中细菌门类比例Fig.1 The proportion of rhizospheric soils bacteria phyla in different rotation Chinese fir plantations变形菌门Proteobacteria;放线菌门Actinobacteria;浮霉菌门Planctomycetes;厚壁菌门Firmicutes;蓝藻门Cyanophyta;螺旋体门Spirochaete;拟杆菌门Bacteroidetes;热微菌门Thermomicrobia;柔膜菌门Tenericutes;梭杆菌门Fusobacteria;梭菌门Clostridium;纤维菌门Fiber
2.5 不同栽植代数杉木根际土壤功能细菌变化
通过把酶切消化产生的T-RFs片段和标准数据库比对,将匹配到的细菌进行整理,并按照功能性分为5类:碳元素循环菌、硫元素循环菌、纤维降解与循环菌、氮元素循环菌及病原菌[32-34],见表4。由表4可知,碳元素循环菌包括黄杆菌属和嗜甲基菌属;硫元素循环菌包括硫化杆菌属;纤维降解和循环菌包括二氧化碳嗜纤维菌属、梭菌属和嗜纤维菌属;氮元素循环菌包括芽孢杆菌属、类芽孢杆菌属及弗兰克氏菌属;致病菌包括梭杆菌属和梭菌属。与碳循环相关的柱状黄杆菌(Flavobacteriumcolumnare)相对含量从一代到三代分别为0.28%、0.16%和0,呈下降趋势;甲基弯曲菌(MethylophilusLW3)相对含量亦呈下降趋势,可见连栽导致参与土壤碳循环的细菌数量减少。与氮元素有关的细菌相对含量,在连栽杉木土壤中均呈现下降趋势。在FCP、SCP、TCP土壤中,芽孢杆菌属的巴氏芽孢杆菌(Bacilluspasteurii)相对含量分别为0.83%、0和0;类芽孢杆菌属的马阔里类芽孢杆菌(Paenibacillusmacquariensis)相对含量分别为0.25%、0.14%和0.06%;弗兰克氏菌属的弗兰克氏菌(Frankiaceae)相对含量分别为0.45%、0.30%和0.16%。
与硫循环有关的热氧化硫化杆菌(Sulfobacillusthermosulfidooxidans)和氧化二硫化物硫化杆菌(Sulfobacillusdisulfidooxdans)相对含量呈现上升趋势,反映出连栽在一定程度上导致参与硫元素循环的细菌数量增加。纤维降解是土壤养分循环的重要一环,与纤维降解有关的二氧化碳嗜纤维菌属(Capnocytophaga)和嗜纤维菌属(Cytophaga)相对含量均有所增长但幅度不大,可见连栽对杉木根际土壤纤维降解菌影响不明显。病原菌鉴定出棒杆菌属1种和梭菌属2种,在连栽杉木土壤中均呈现上升趋势。在FCP、SCP、TCP土壤中,棒杆菌属的解葡萄糖苷棒杆菌(Corynebacteriumgenitalium)相对含量分别为5.13%、5.57%和7.46%;梭菌属的产气荚膜梭菌(Clostridiumperfringens)相对含量分别为0.13%、0.33%和0.54%;溶组织梭菌(Clostridiumhistolyticum)相对含量分别为3.63%、4.33%和5.01%。
2.6 土壤理化性质与微生物群落多样性相关性分析
连栽杉木土壤理化性质和微生物多样性相关性分析见表5。由表5可知,除pH外,其他所有多样性指数均与土壤化学性质呈相关关系。总有机碳(TOC)、速效氮(AN)与土壤微生物群落多样性呈极显著相关。相反,碳氮比(C/N)与土壤微生物群落多样性呈极显著负相关。此外,全氮(TN)与Simpson指数、Shannon-Weiner指数、均匀度指数显著相关;全磷(TP)与Shannon-Weiner指数、均匀度指数显著相关;速效磷(AP)与Simpson指数极显著相关;全钾(TK)与Simpson指数显著相关;速效钾(AK)与所有指数相关性不显著。
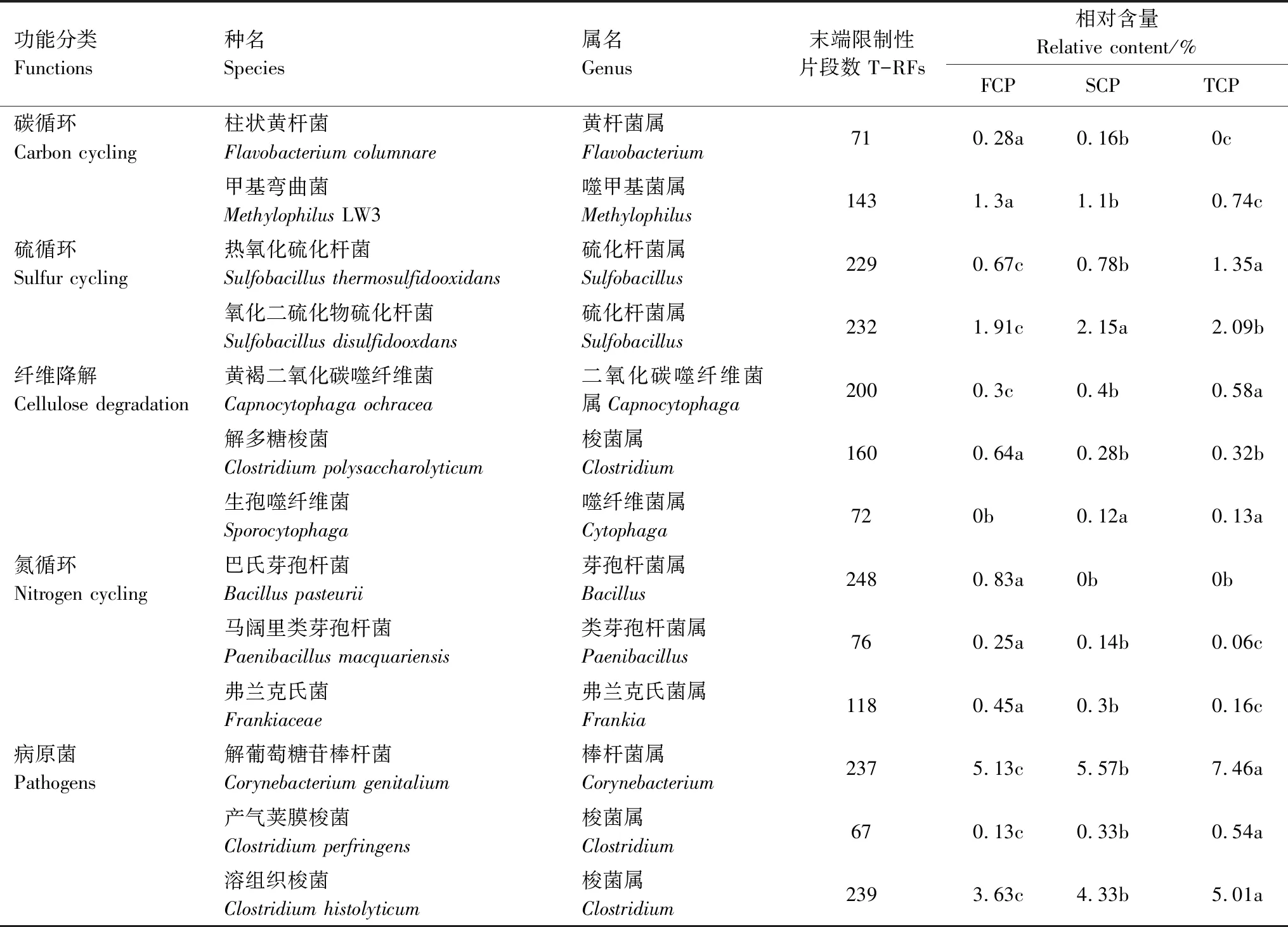
表4 不同栽植代数杉木根际土壤功能菌相对含量分析
同一列不同的小写字母表示差异达0.05显著水平;T-RFs:末端限制性片段数Terminal restriction fragments
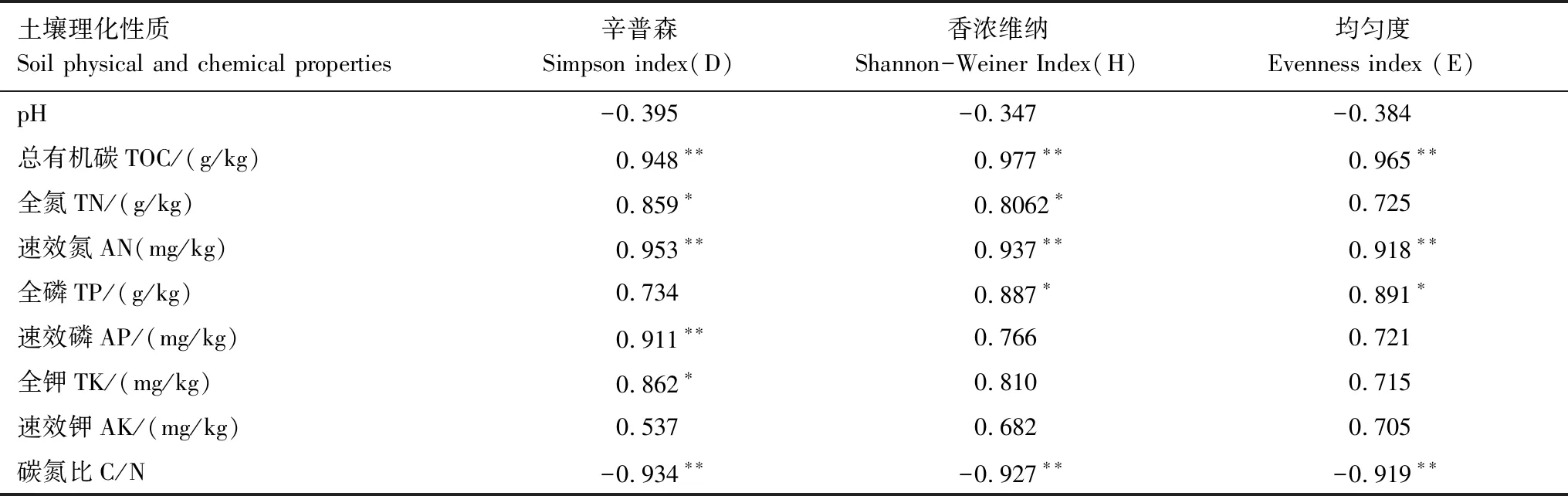
表5 土壤理化性质与微生物群落多样性相关分析 (n=9)
*:P<0.05,显著相关;**:P<0.01,极显著相关
3 结论与讨论
3.1 连栽对杉木根际土壤微生物多样性的影响
除土壤pH外,土壤养分含量指标均与微生物群落多样性相关,且TOC、AN与土壤微生物群落多样性指数呈极显著相关,表明土壤有机质及碳氮含量会影响土壤微生物群落多样性,这和钟文辉等[35]提出的观点一致。土壤TN与Simpson指数、Shannon-Weiner指数、均匀度指数显著相关;TP与Shannon指数、均匀度指数显著相关;TK与Simpson显著相关,可见土壤养分变化导致微生物群落多样性产生相应变化。C/N指数作为土壤重要的指标,影响植物的生长和土壤微生物的平衡。本研究发现土壤微生物群落多样性与C/N显著负相关,与Izumi等[36]研究结果相一致。SCP和TCP土壤C/N显著高于FCP,较高的碳氮比可导致细菌代谢不平衡,从而抑制细菌活性,导致细菌群落多样性降低。
3.2 连栽对杉木根际土壤细菌群落结构的影响
本研究采用T-RFLP技术共鉴定出细菌门类12类,其中占据优势的三大类细菌门类是变形菌门、放线菌门和厚壁菌门。土壤细菌数量和群落多样性从一代到三代呈现下降趋势,与部分学者的研究结果相似。如杜国坚等[37]在浙江开化的杉木人工林连栽试验表明,连栽土壤微生物总数比第一代减少23.4%,其中细菌、放线菌分别减少24.7%和34.0%,真菌却增加10.4%。李茂延等[38]采用经典土壤微生物平板计数法对湖南会同森林生态实验站的连栽杉木根际土壤进行了分析,结果发现连栽杉木根际土壤中细菌和放线菌数量呈现明显减少。但上述实验采用传统的微生物平板培养法,且环境中有99%的微生物都是不可或者难以培养的,因此传统的微生物平板培养法存在重大缺陷。T-RFLP方法具有高通量、可重复性及快速性等优势,我们采用该技术验证并拓展了前人开展的初步研究结论,取得了理想结果。然而,T-RFLP技术属于半定量研究,对群落特征分析仍存在一定程度的偏差,精确性略差。在后续研究中,我们将综合高通量测序、实时定量PCR技术,进一步深入开展连栽杉木根际土壤微生物群落变化研究。
3.3 连栽对杉木根际土壤功能细菌的影响
将细菌按照功能分类后,本研究发现碳循环功能菌和氮循环功能菌含量在连栽杉木土壤中均呈现下降趋势。其中,柱状黄杆菌对土壤碳转化起关键作用;甲基弯曲菌是兼有甲基营养和甲烷营养特性的革兰氏阴性菌,可利用葡萄糖或其他复杂营养物作碳源;芽孢杆菌属能产生芽孢,从而适应恶劣或极端环境,提高微生物对环境的抗性,可利用无机氮作为生长繁殖的氮源,能够促进硝化作用、氨化作用[39];类芽孢杆菌属能产生内生孢子,影响病原菌的细胞壁和细胞膜的结构,干扰蛋白互作,从而达到抵抗病原菌的作用[40]。弗兰克氏菌属作为一种根瘤菌,和寄主植株体产生互利共生关系,该属细菌具有固氮作用,能有效促进植物生长[41]。病原菌鉴定出棒杆菌属和梭菌属,均广泛分布于植物土壤中,通常能够化能自养或者异养,且分解糖类和蛋白质类物质后产生混合有机酸和醇类物质甚至毒素,从而对植物体生长发育及有益菌的群落结构造成不良影响[42]。病原菌数量随栽植代数增加逐渐增多,这种现象可能与连栽后杉木根系分泌化感物质有关。化感物质可影响根际微生物的正常生长发育,甚至改变土壤微生物群落结构[43-45]。张新慧等[46]研究发现,化感物质2,4-二叔丁基苯酚在特定浓度下会抑制啤酒花(Humuluslupulus)根际土壤细菌和真菌,造成土壤中微生物数量减少,多样性降低;李瑞琴等[47]在对马铃薯(Solanumtuberosum)连栽化感物质的研究发现,马铃薯连作根际土壤有2种病原菌呈现上升趋势,鉴定为镰刀属真菌迅速繁殖造成产量下降。
土壤微生物对于森林生态系统的物质循环和能量流动至关重要,不同营林管理措施将会改变土壤微生物群落结构和功能,从而间接影响植物生长。我们推测杉木单一化多代连栽使得植物-土壤生态系统结构简单化、自我调节能力下降。本研究证实了由于杉木多代连栽,确实导致根际微生物群落结构发生了显著变化。然而,连栽障碍形成原因是复杂的,导致其发生的因素是相互关联又相互影响的,是植物-土壤-微生物系统内多种胁迫因子综合作用的结果。此外,植物体在整个生长周期中会释放大量的化学物质,是介导植物与土壤进行物质交换和能量流动的重要载体物质,也是构成植物不同根际微生态特征的关键因素,是植物-微生物互作关系建立的基础。越来越多的学者研究发现,化感物质对根际微生物群落结构有选择塑造作用,不同植物体的根际微生物群落结构具有其独特性与代表性[48- 49];反过来,根际微生物群落结构变化对植物化感物质释放、土壤营养循环、能量流动、信息传递有重要影响,进而影响植物生长发育过程[50]。前人研究发现,杉木多代连栽地中存在多酚类物质积累,根际土及杉木各器官中均存在酚酸类化感物质[4,18]。化感物质在根际土壤中长期大量累积,是否抑制了土壤有益菌的生长,促进了致病菌的繁殖,从而使土壤生态系统陷入恶性循环?此外,土壤作为一个极其复杂的“黑匣子”,杉木根际土壤化感物质如何介导土壤微生物结构发生变化,哪些化感物质起主导作用以及关键的特异微生物如何在连栽障碍形成的根际生态学过程中扮演重要角色,导致杉木土壤生长环境灾变,仍需进一步开展深入研究。
