不同水氮水平对川西亚高山林地土壤酶活性的影响
2019-11-07马伟伟王丽霞郑东辉谢路路尹春英
马伟伟,王丽霞,李 娜,郑东辉,谢路路,刘 庆,尹春英,*
1 中国科学院成都生物研究所,中国科学院山地生态恢复与生物资源利用重点实验室, 生态恢复与生物多样性保育四川省重点实验室, 成都 610041 2 中国科学院大学,北京 100049
大气氮(N)沉降作为全球气候变化的主要特征之一,其来源和分布一直在增长和扩散,预计到2050年,亚洲的高N沉降地区将会大幅度增加[1]。政府间气候变化委员会(IPCC)和国际地圈与生物圈计划(IGBP)的很多核心项目都将N循环作为主要研究内容[2]。N循环是陆地生态系统最主要的生态过程之一[3],它不仅为植物生长发育提供物质基础,而且关系着生态系统的能量转化和生态演替[4]。近年来欧美关于大气N沉降的15N同位素示踪试验表明,只有约3% 的沉降N被固定在森林林木中,其余大部分被固定在土壤中[5],但大量的沉降N在土壤中会对其生态学过程有何影响?至今仍不清楚。全球变化也导致降雨格局发生改变,主要表现为降雨的时空分布不均。IPCC 2013年报告指出,到本世纪末降雨较多的地区降雨量将会进一步增加,而干旱地区将会越来越干旱。土壤水分与氮素有效性对植物生长存在显著的耦合效应[6],也直接影响着土壤生物化学过程[7]。
在过去的十几年,全球变化对陆地生态系统影响的研究大多集中在地上部分,近年来,地下生态学成为研究热点[8- 9]。生态系统的地下部分(根系和土壤)不仅为植物提供有效的养分和水分,而且是陆地生态系统碳氮循环的重要场所和环节[10]。土壤酶作为地下部分最主要的生物学指标之一,是森林生态系统中凋落物分解和土壤有机质转化等土壤生物化学过程中最为活跃的生物活性物质[11],也是影响森林土壤物质循环的主要因素之一。土壤酶活性不仅受土壤水分、温度与pH等环境因子的影响[12-13],还与土壤类型、群落生物量、植被特征、土壤动物类群与数量以及酶类本身的性质有关[14]。在陆地生态系统主要物质(碳氮磷)循环过程中,土壤酶起到关键性作用[15]。川西地区的杨属植物种类资源丰富,青杨在该区域广泛分布[16]。因此本研究选择青杨为材料,研究氮沉降在不同土壤水分状况下对土壤酶活性的影响,对于帮助我们认识不同水分条件下氮素的环境效应具有一定理论和实际意义,对于理解森林生态系统地下生态学过程对气候变化的响应和应对具有重要的科学意义。
关于森林生态系统土壤酶的研究,大部分基于单因素试验(比如单一的氮添加或降水改变),对多因素叠加作用的研究还比较缺乏[17]。根据现有的大部分实验结果发现,氮添加条件下,水解酶活性提高,而氧化酶活性被抑制[18-20]。氮沉降,除对碳过程相关酶活性有影响外,对氮、磷过程相关的酶活性也有着促进或抑制作用[21-22]。当前只有少数的研究是关于土壤酶活性对降水改变的响应,而且这些研究又大多集中在高纬度地区和美洲地区,而其他低纬度及其他洲地区此方面的研究还是相当匮乏[23]。本研究选择与土壤C、N、P转化过程密切相关的5种土壤酶:β-D-葡萄糖苷酶(β-D-glucosidase, βG)、过氧化物酶(Peroxidase, PER)、多酚氧化酶(Polyphenol oxidase, PPO)、β-N-乙酰葡糖胺糖苷酶(β-N-acetylglucosaminidase, NAG)和酸性磷酸酶(Acid phosphatase, AP),其中βG主要作用是将纤维素降解为葡萄糖而参与土壤C循环过程;而PER和PPO主要是参与难降解的木质素分解过程、土壤腐殖化过程等[24];NAG是降解几丁质和肽聚糖、水解氨基葡萄糖[25],是氮矿化的关键酶;AP主要参与有机磷的矿化,能够催化磷酸单脂的水解及无机磷释放。探讨不同浓度的氮沉降在不同土壤水分状况下,土壤酶活性随时间的动态响应。研究结果将为理解氮沉降在不同水分状况下森林生态系统中土壤生态学过程提供理论参考,也可为森林的经营和管理提供指导依据。
1 研究地区与研究方法
1.1 试验地概况
试验于2017年5月—9月在中国科学院成都生物研究所茂县山地生态系统定位研究站(31°42′N,103°54′E,海拔1826 m)进行。试验地位于四川省阿坝州的茂县,地处青藏高原东缘横断山系北段,是青藏高原东缘和长江上游生态环境十分脆弱的高山峡谷地带的典型代表。该区属于暖温带亚高山季风气候,年平均气温、年积温、年降水量和年蒸发量分别为8.9℃、2690.8℃、919.5 mm、795.8 mm。植被属针阔叶落叶常绿混交林。该区土壤主要为淋溶褐土和棕壤土。
1.2 试验设计与样品采集、处理
于2017年5月初在当地主要次生林的林下采集土壤,土壤基本情况如下:土壤为棕壤土,pH 6.88,全氮含量2.2 g/kg,有机质含量27.5 g/kg,铵态氮、硝态氮含量分别为5.28、32.20 mg/kg,有效磷含量6.93 mg/kg。土壤经过筛、混匀后,分装到直径30 cm、高28 cm的圆形塑料花盆中,每盆装15 kg。
2017年3月初选取直径为1.0—1.5 cm的一年生青杨枝条,剪取长度约为15—20 cm的扦插条(上端剪成平口,下端剪成斜口),采用直插法进行扦插,覆土浇水的同时用塑料薄膜覆盖。2017年5月初,待扦插苗长势稳定,选取大小一致的幼苗移栽到上文提到的花盆中。试验期间所有盆栽均在自然光照的遮雨塑料大棚内,目的是避免自然降雨和氮沉降的影响,大棚离地1 m高度之间为遮阳网,目的是保证大棚内具有良好的通风性。试验期间的白天温度、夜间温度和相对湿度分别为12—31℃、9—15℃和35%—85%。
1.3 样品测定
在施氮后6 h、24 h、3、7、14、31 d和62 d采集土壤,采样时每处理随机选择3盆作为重复。具体采样方法:将土壤混匀后过2 mm筛,去除可见根系等,取500 g土样保存在自封袋中,并迅速用冰袋冷藏带回实验室,置于4℃冰箱中保存,用于土壤酶活性测定。βG、NAG、AP活性测定采用多孔板荧光光度法(激发波长:365 nm;发射波长:450 nm),其主要原理是在低底物浓度条件下,通过检测酶裂解释放荧光基团(4-甲基伞形酮)所发出的荧光强度进行检测。PER和PPO活性测定采用多孔板分光光度法,在460 nm处测定生成物2,3-dihydroindole- 5,6-quinone- 2-carboxolate的吸光度[27]。称取10克过筛的鲜土,烘干后利用重量之差计算其土壤含水量。于此同时称取两克过筛鲜土放入250 mL的三角瓶中,加入100 mL pH为5.5的醋酸钠缓冲液并用磁力搅拌器不断搅拌,在搅拌的同时,吸取200 μL土壤悬浮液到96孔板中,分别加入上述5种土壤酶的底物4-Methylumbelliferyl β-D-glucopaanoside、4-MethylumbelliferylN-acetyl-β-D-glucosaminide、4-Methylumbelliferyl phosphate、EDTA和L-dihydroxyphenylalanine(DOPA)以及4-Methylumbelliferone标准溶液进行培养,上述5种土壤酶在25℃温度下分别培养5 h、2 h、2 h、4 h、4 h后,在培养βG、NAG、AP的荧光比色板的每个孔中加入20 μL 1 mol/L NaOH溶液终止反应。在PER和PPO两种氧化酶培养结束时(土壤颗粒已经沉淀在96孔板的底部),从每个孔中转移100 μL上清液至新的96微孔板中,用于上机测定。通过全波长多功能读数仪(Varioskan Flash,Thermo,USA)测定每个孔中的吸光值,样品酶活性用每小时每千克样品的基质(μmol)转化率表示。
1.4 数据处理
利用OriginPro 8.5软件绘制7个取样时间点的土壤酶活性折线图,以阐明实验期间其动态变化。为研究实验期间的水分和氮沉降对主要土壤酶活性的影响,我们将7次取样的测定结果,采用Shapiro-Wilk 和Levene′s tests 对实验数据进行正态分布检验和方差齐性检验,然后对其平均值利用SPSS 22.0软件进行两因素方差分析比较土壤水分(W)、施氮(N)及交互作用对5种土壤酶活性的影响,采用LSD多重比较的方法比较不同处理间5种土壤酶活性的差异。
2 结果与分析
2.1 土壤酶活性的动态变化特征
2.1.1βG活性动态变化特征

图1 不同水氮处理下β-D-葡萄糖苷酶活性(平均值±标准误)Fig.1 Dynamics of β-D-glucosidase activities in different soil water content after nitrogen fertilization (mean± SE)W40、W60、W80分别为最大田间持水量的40%、60%和80%;N0、N4、N8分别为0、4、8 g N m-2 a-1
βG活性在施氮7 d内变化较大,7 d后随处理时间的延长逐步平稳(图1)。在两个月的实验期间,各处理的βG活性基本都呈现升高-降低-升高-降低的双峰模式:分别在施氮1天后急剧上升,然后下降,在7 d时又上升达到高峰。N0、N4和N8沉降N在W40、W60水分处理下,βG活性高峰均出现在1 d,其峰值分别为13.12、11.3、13.17、12.07、9.55、11.46 μmol kg-1h-1,在31 d趋于平稳,其活性稳定在5—8 μmol kg-1h-1。N0、N4和N8沉降N在W80水分处理下,βG活性高峰均出现在7 d,其峰值分别为15.5、11.53、11.46 μmol kg-1h-1,在31 d趋于平稳,其活性稳定在7—10 μmol kg-1h-1左右。
2.1.2PER和PPO活性动态变化特征
如图2所示,PER活性在施氮14 d内变化较大,14 d后随处理时间的延长逐步平稳。在实验期间,各处理的PER活性基本都呈现双峰模式:分别在施氮1天后急剧上升,然后下降,在7 d和14 d时又上升到高峰。N0W60、N0W80、N4W40、N4W80、N8W40和N8W60处理,PER活性高峰均出现在1 d,其峰值分别为733.5、712.7、888.1、611.7、683.1、980.2 μmol kg-1h-1。N0W40、N4W60和N8W80处理下,PER活性高峰出现在14d,其峰值分别为633.2、597.8、596.1μmol kg-1h-1。各处理均在31 d趋于平缓,其活性稳定在300—400 μmol kg-1h-1。
相似地,PPO活性也在施氮14 d内变化较大,14 d后随处理时间的延长逐步平稳(图3)。在两个月的试验期间,各处理的PPO活性基本呈现双峰模式:分别在施氮后1天后上升,然后下降,在7 d或14 d时又达到高峰。N0W40、N0W60、N0W80和N4W40处理,PPO活性高峰出现在7 d,其峰值分别为319.09、394.29、417.14、314.45 μmol kg-1h-1, N4W60和N4W80处理PPO活性高峰出现在14 d,其峰值分别为329.03、521.55 μmol kg-1h-1,N8W40、N8W60和N8W80处理,PPO活性高峰出现在1 d,其峰值分别为420.57、592.04、444.58 μmol kg-1h-1。各处理均在31 d趋于平稳,其活性稳定在100—200 μmol kg-1h-1。
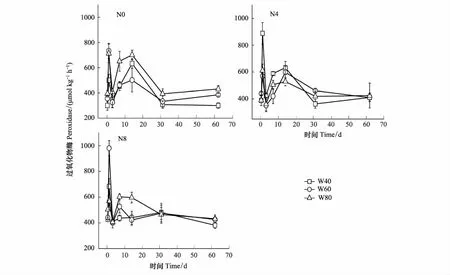
图2 不同水氮处理下过氧化物酶活性(平均值±标准误)Fig.2 Dynamics of Peroxidase activities in different soil water content after nitrogen fertilization (mean± SE)

图3 不同水氮处理下多酚氧化酶活性(平均值±标准误)Fig.3 Dynamics of Polyphenol oxidase activities in different soil water content after nitrogen fertilization (mean± SE)

图4 不同水氮处理下β-N-乙酰葡糖胺糖苷酶活性(平均值±标准误)Fig.4 Dynamics of β-N-acetylglucosaminidase activities in different soil water content after nitrogen fertilization (mean± SE)
2.1.3NAG活性动态变化特征
关于NAG活性在试验处理期间的变化,研究发现在施氮7 d内变化较大,7 d后随处理时间的延长逐步平稳(图4)。在实验期间,各处理的NAG活性基本都呈现双峰模式:分别在施氮1天后急剧上升,然后下降,在7 d时又上升达到高峰。N0W40、N0W80、N4W40、N4W60、N8W40和N8W60处理,NAG活性高峰出现在1 d,其峰值分别为5.85、7.54、6.81、6.62、5.46、6.21 μmol kg-1h-1。N0W60、N4W80和N8W80处理,NAG活性高峰出现在7 d,其峰值分别为8.81、6.67、7.14 μmol kg-1h-1。各处理下的NAG活性均在31 d趋于平稳,其活性稳定在4 μmol kg-1h-1左右。
2.1.4AP活性动态变化特征
如图5所示,AP活性在施氮14 d内变化较大,14 d后随处理时间的延长逐步平稳。在两个月的实验期间,各处理的AP活性基本都呈现双峰模式:分别在施氮1天后急剧上升,然后下降,在7 d和14 d时又上升达到高峰。N0W40、N0W60、N0W80、N4W60、N4W80、N8W40和N8W60处理,AP活性高峰出现在1 d,其活性峰值分别为12.41、12.37、12.14、10.47、8.87、9.67、9.74 μmol kg-1h-1。N4W40和N8W80处理,AP活性高峰出现在7 d,其活性峰值分别为11.51、11.52 μmol kg-1h-1。各处理下的AP活性均在31 d趋于平稳,其活性在5—8 μmol kg-1h-1。

图5 不同水氮处理下酸性磷酸酶活性(平均值±标准误)Fig.5 Dynamics of acid phosphatase activities in different soil water content after nitrogen fertilization (mean± SE)
2.2 土壤酶活性对水氮处理的响应
2.2.1βG活性对水氮处理的响应
在整个试验期间,W和N均显著影响了βG活性,两者之间无显著的交互作用(表1)。总体而言,土壤含水量的降低显著降低了βG活性,随着土壤水分有效性的降低,βG活性逐渐降低,在W40时达到最低。施氮对βG活性有显著的抑制作用,而且施氮浓度越大,抑制效应越大。由表1可以看出,无氮沉降状态下(N0),与W80相比,βG活性在 W60、W40条件,分别降低了9.1%和14.7%(P<0.05);氮沉降浓度在N4状态下,与W80相比,βG活性在W40条件降低7.5%(P<0.05),W60无显著差异;氮沉降浓度在N8状态下,与W80相比,βG在W40条件,降低了19.1%(P<0.05),W60差异不显著。在W40水分状态下,与N0相比,βG活性在N8处理下,降低了16.7%(P<0.05),N4处理无显著差异;在W60水分状态下,与N0相比,βG活性在N8处理下,降低了8.8%(P<0.05),N4无显著差异;在W80水分状态下,βG活性在N4、N8处理下,分别降低了10.4%和12.2% (P<0.05)。
2.2.2PER和PPO活性对水氮处理的响应
由表1可以看出,W、N、W×N的交互作用对PER活性无显著影响;在整个试验期间,W对PPO活性有显著影响,而N、W×N的交互作用对PPO活性无显著影响(表1)。总体而言,土壤含水量的降低显著降低了PPO活性,随着土壤水分有效性的降低,PPO活性逐渐降低,在W40时达到最低。由表1可以看出,无氮沉降状态下(N0),与W80相比,PPO活性在W40、W60水分条件均无显著差异;氮沉降浓度为N4状态下,与W80相比,PPO活性在W40水分条件,降低了37.7% (P<0.05),W60与W80相比则无显著差异;氮沉降浓度为N8状态下,与W80相比,PPO活性在W40和W60条件无显著差异。
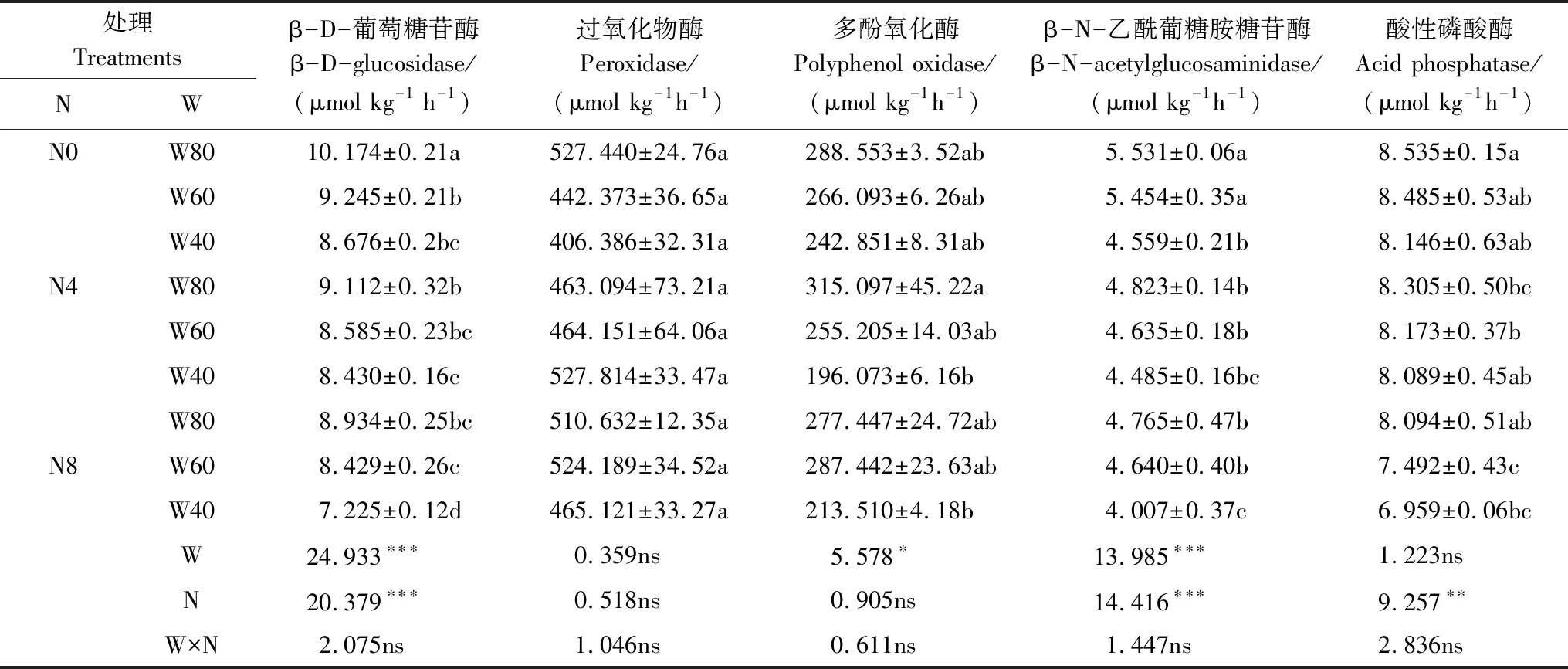
表1 试验期间各处理土壤酶活性平均值(±标准误)及方差分析结果
N: 氮 Nitrogen; W: 水 Water.不同字母表示处理间差异显著(P<0.05);***,P<0.001; **,P<0.01; *,P<0.05; ns;差异不显著; ns, not significant
2.2.3NAG活性在对水氮处理的响应
W和N均显著影响了NAG活性,两者之间无显著的交互作用(表1)。总体而言,土壤含水量的降低显著降低了NAG活性,随着土壤水分有效性的降低,NAG活性逐渐降低,在W40时达到最低。施氮对NAG活性有显著的抑制作用,而且随施氮浓度的增加,抑制效应越大。由表1可以看出,无氮沉降状态下(N0),与W80相比,NAG活性在W40条件,降低了17.6%(P<0.05),在W60条件无显著差异;氮沉降状态为N4时,与W80相比,NAG活性在W40和W60条件均无显著差异;氮沉降状态为N8时,与W80相比,NAG活性在W40条件,降低了15.9%(P<0.05),在W60条件无显著差异。在W40水分状态下,与N0相比,NAG活性在N8处理下降低了12.1%(P<0.05),在N4处理无显著差异;在W60条件下,与N0相比,NAG活性在N4和N8处理下,分别降低了15.1%与14.9%(P<0.05);在W80水分条件下,NAG活性在N4和N8处理下,分别降低了12.8%和13.8%(P<0.05)。
2.2.4AP活性对水氮处理的响应
N显著影响了AP活性,W以及W×N的交互作用对其活性无影响(表1)。总体而言,施氮对AP活性有显著的抑制作用,而且随施氮浓度的增加,抑制效应越大。由表1可以看出,在W40水分条件下,与N0相比,AP活性在N4和N8处理下无显著差异;在W60水分条件下,与N0相比,AP活性在N8条件下降低了11.7%(P<0.05),N4处理无显著差异;在W80水分条件下,与N0相比,AP活性在N4处理下降低了2.7%(P<0.05),N8处理无显著差异。
3 讨论
3.1 土壤酶活性在不同水氮处理下的动态变化特征分析
从时间格局上看,5种土壤酶活性对氮沉降在不同土壤水分下的响应趋势大致相同,均先呈现波动性变化随后5种酶活性分别在7 d和14 d呈下降并逐渐平稳的趋势。由图1—图5可知,土壤酶活性的高峰主要出现在温度较高的月份,这与前人[28- 29]的研究结果相互支持。本研究中,酶的活性高峰都出现在温度较高的7月,8月和9月酶活性有所降低且趋于平稳。这可能是因为较高的土壤温度使分泌这5种酶的微生物活动增强[30],也可能是因为不同季节中植物根系或微生物对营养元素摄取需求的差异[31]、季节性的土壤温度变化引起的底物可利用性改变[32]引起的。至于在前几个取样时间点出现升高降低之后又升高又降低的现象,原因可能是根际分泌物引起土壤微生物的变化或者根系分泌的化感物质对土壤酶的合成有影响[7]。本项研究还不能完全解释这种变化规律,还需要更进一步的深入研究。
3.2 水氮处理对土壤酶的影响
本研究结果表明,水分对βG、NAG、PPO活性有促进作用,对AP、PER活性无影响。这与Kardol等[33]、Dilly等[34]和A′Bear等[35]的研究结论相似,提高土壤湿度后,除亮氨酸氨肽酶外,βG、纤维二糖水解酶、β-木糖苷酶、NAG活性均显著提高,这可能是由于含水量的增加,促进了分泌此类酶的微生物生长繁殖,从而向土壤中分泌更多的酶。Hackl等[36]发现土壤含水量是微生物群落结构组成的重要调控因子,细菌和真菌的生物量也随土壤含水量的变化发生变化[37];而Zhou[38]的研究结果表明β-D-葡萄糖苷酶活性并没有随着降水量的增加而增加,这可能是因为微生物群落对含水量的响应存在一个阈值,超过阈值会使土壤形成厌氧环境,从而抑制土壤酶活性[39]。另外,土壤含水量的变化还会影响微生物胞内外的压力,进而影响微生物向环境中释放土壤酶[40]。本研究中,土壤水分的提高显著增加了βG、NAG、PPO活性,将会促进土壤有机质与养分的分解、速效养分的释放,增强土壤肥力[41]。
关于氮沉降对水解酶活性的影响,因林分类型[42]、不同外加氮源[43]、土壤pH、亦或受到其他因素[44]影响而不同。现有研究表明,氮沉降下,水解酶活性提高[20,41,45]。本研究结果表明,氮沉降对βG、NAG、AP有抑制作用。这与Deforest[19]、Kang[46]和施瑶等[47]研究结果类似,大气氮沉降抑制了βG、AP活性、NAG活性。这可能是由于本研究中的取样地是以磷为限制性元素的生态系统。在磷为限制性元素的生态系统中,氮沉降对土壤酶活性和微生物生物量表现为抑制作用或无作用[48]。另外,也有可能是本研究中的氮沉降抑制了微生物的生长,土壤酶活性是土壤微生物群落新陈代谢的直接表达[49],土壤微生物数量越多,土壤酶活性越高[50]。刘星等[51]研究认为,当生态系统中本底土壤氮含量较低时,土壤酶活性对施氮多表现为正响应,反之,则可能表现为负响应。这说明我们研究所在区域土壤本底氮含量较高,进一步的沉降氮将会抑制酶活性,从而使该地区碳氮磷循环速度变慢。

3.3 酶活性之间的相关分析
5种酶之间的相关分析表明,只有βG和NAG活性呈显著正相关,其他酶活性之间无显著相关性(数据未列出)。张德生和郑洪元[59]认为,单独以酶活性单位作为肥力指标有一定局限性。由于酶专一作用于某一基质,因此个别酶活性只能反映土壤专一的分解过程或营养循环,如文中的NAG是降解几丁质和肽聚糖、水解氨基葡萄糖,是氮矿化的关键酶;AP活性可与土壤有机磷酸盐联系起来。本文以土壤酶为研究对象,但土壤酶活性变化的背后往往是微生物群落结构的变化,水分和氮素的交互作用对土壤微生物群落结构的影响仍需进一步研究,以及在试验周期的长短上对土壤微生物及酶的活性有一定影响,因此本试验区多因素交互作用的试验应持续进行,为该区生态系统中生态学过程提供更好的理论参考。
4 结论
综上所述,两个月的实验期间,在不同水氮处理下,5种土壤酶活性的动态变化基本都呈现升高-降低-升高-降低的双峰模式,水分与氮素的交互作用对5种土壤酶均未产生显著影响。土壤水分的升高对βG、NAG、PPO有促进作用,对AP、PER活性无影响。氮素添加抑制了3种水解酶活性,对氧化酶无显著影响。
