基于色谱法与质谱法分析唾液酸的衍生方法的研究进展
2019-11-07张启伟
张启伟, 郑 琦
(江汉大学化学与环境工程学院, 交叉学科研究院, 光电化学材料与器件教育部重点实验室, 湖北 武汉 430056)
唾液酸(sialic acids)是神经氨酸(neuraminic acid)的N-或O-取代衍生物,拥有相同的9碳核心结构,在自然界中已发现60余种[1,2]。神经氨酸的N-或O-取代主要发生在C4、C5、C7、C8、C9位置,其中依据C5位置取代基团的不同,唾液酸被分成3大类,即N-乙酰神经氨酸(N-acetylneuraminic acid, NeuAc)、N-羟乙酰神经氨酸(N-glycolylneuraminic acid, NeuGc)和酮基-脱氧壬酮糖酸(2-keto-3-deoxynononic acid, KDN);发生在其他位置的取代基团主要包括乙酰基、磺酸基、乳酰基、甲基和磷酸基等[3,4]。3种结构最简单的唾液酸如图1所示,其他唾液酸均为此3种唾液酸的衍生物。

图1 唾液酸的基本结构
唾液酸大量存在于包括人体和各种脊椎动物体内,也存在于部分无脊椎动物、真菌和细菌中[3,5-9]。唾液酸有着广泛的生物功能,可参与到细胞间相互作用、细胞黏附与分化、神经发育与记忆形成、肠道微生态平衡等生理过程;与此同时,也与炎症、癌症、传染病、神经退行性疾病、自身免疫疾病等病理性活动密切相关[10-14]。为了深入理解唾液酸的生物功能,糖组学领域的科研工作者经过几十年的努力,陆续建立了多种表征分析方法。
以色谱法与质谱法为核心的检测技术,是当前唾液酸表征分析研究中最主要且应用最广泛的方法[15-17]。然而在通过色谱法、质谱法分析天然唾液酸时,经常遭遇检测灵敏度低、结构易被破坏、色谱分离度差等问题,因此在样品前处理过程中,通常需要将唾液酸衍生化。衍生化的优势包括提高检测灵敏度,稳定唾液酸结构,增强色谱分离度,改变碎片化模式,强化结构特征等。本文将重点对用于色谱与质谱分析唾液酸的衍生方法进行归纳和总结,并展望该领域的应用前景及发展趋势等。
生物体内的唾液酸,一部分以游离的形式存在;另一部分则经常作为糖缀合物(glycoconjugates)的组成结构,以多种方式连接于其末端[18,19]。这使得关于唾液酸的色谱与质谱分析方法大体上可分成4个层次,即单糖水平、寡糖水平、糖肽水平和糖蛋白水平。目前而言,在糖肽及糖蛋白等高水平上表征唾液酸仍然面临极大困难,因而大部分衍生方法主要应用于单糖与寡糖水平上。本文将从单糖、游离唾液酸、N/O-聚糖、糖脂等4个层面总结唾液酸的衍生方法。
1 单糖水平的唾液酸衍生方法
1.1 邻苯二胺类试剂
连接于糖缀合物上的唾液酸能够通过酸解、酶解等方法被解离[20,21]。解离后,唾液酸分子中的α-酮基-羧基能够与邻苯二胺类试剂的氨基发生反应,从而形成一种喹喔啉衍生物(见图2)。在水溶液中,唾液酸能够以α-吡喃糖、β-吡喃糖、非环状酮等多种形式存在(以β-吡喃糖形式为主)[22]。而上述衍生方法的一个重要优势在于反应生成的喹喔啉衍生物能够消除端基异构体,防止单一结构在色谱分离时因异头碳而产生多色谱峰。因衍生物具有荧光效应,故此方法常用于唾液酸的液相色谱-荧光检测分析中[15]。与此同时,衍生后的唾液酸能够呈现出更好的色谱分离度和质谱电离效率,使得其在唾液酸的液相色谱-质谱分析中也有较为广泛的应用[3,15,23]。
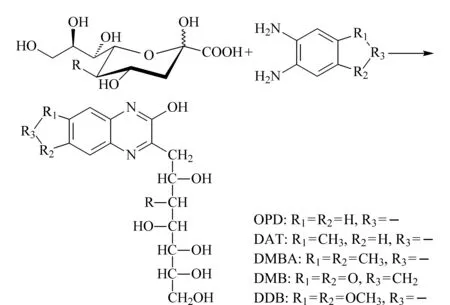
图2 唾液酸与邻苯二胺反应生成喹喔啉衍生物的示意图
已报道的邻苯二胺类试剂主要包括邻苯二胺(o-phenylenediamine, OPD)、3,4-二氨基甲苯(3,4-diaminotoluene, DAT)、1,2-二氨基-4,5-二甲氧基苯(1,2-diamino-4,5-dimethoxybenzene, DDB)、4,5-二甲基-1,2-苯二胺(4,5-dimethylbenzene-1,2-diamine, DMBA)、4,5-亚甲二氧基-1,2-苯二胺(4,5-methylenedioxy-1,2-phenylenediamine, DMB)等(见图2)[24-28]。其中,DMB因具有荧光信号强、能够显著提高色谱分离度等优势,成为在单糖水平上衍生唾液酸的首选衍生试剂[15],相关方法已经被开发成商业化试剂盒。相较于DMB,其他邻苯二胺类试剂具有价格低廉、易获得同位素标记物等优势,同样具有重要的应用价值。值得注意的是,此类试剂也可以和其他α-酮酸发生反应,例如α-酮戊二酸、丙酮酸、对羟基苯丙酮酸等。因此在对生物样品进行直接衍生分析时需要注意信号干扰等问题[15]。
邻苯二胺类试剂衍生的唾液酸在串联质谱分析中能够产生特征性碎片离子。以被DMB衍生的唾液酸为例,其可以产生m/z313、295、283、229等碎片离子,有利于唾液酸的鉴别[3,29]。此类试剂衍生的唾液酸,即便含有不同的修饰基团,其碎片化模式依然非常相似,难以通过质谱有效辨别不同结构。因而在鉴定同分异构体、修饰基团的连接位置等方面,此方法应用性不强。
邻苯二胺类试剂衍生方法的主要缺陷有两点:样品浓度会随着反应时间的延长而呈现下降趋势,这意味着衍生过程伴随着未知的副反应;同一条件对不同唾液酸的衍生效率并不完全相同,存在衍生歧视的风险[28,30-32]。这些问题导致此类试剂在唾液酸混合物的定量分析研究中存在局限性。
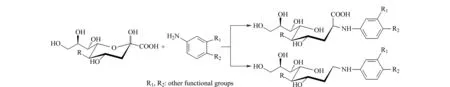
图3 苯胺类试剂衍生唾液酸的示意图
1.2 苯胺类试剂
标记唾液酸的代表性苯胺类试剂为2-氨基吖啶酮(2-aminoacridone, AMAC),其通过还原胺化作用与唾液酸的α-酮基发生反应[33,34]。然而,常规的还原胺化反应条件易引起脱羧作用,从而导致生成大量相对分子质量减少44的产物,即衍生后的样品中既包含完整产物,也存在中性丢失产物(见图3),严重制约了此方法的应用。为了尽可能提高产物的单一性,Szabo等[34]通过改变反应条件以提高脱羧作用发生的概率,从而只生成中性丢失产物。除AMAC外,7-氨基萘-1,3-二磺酸(7-aminonaphtalene-1,3-disulfonic acid)、4-氨基苯磺酸(4-aminobenzene sulfonic acid)等苯胺类试剂也已被用于衍生唾液酸。不同之处在于,这些试剂的磺酸基具有强负电荷属性,主要用于毛细管电泳以及负离子模式下的质谱分析[35,36]。
1.3 甲基化试剂
在强碱性条件下,通过碘甲烷(methyl iodide)将分子中羟基、羧基、氨基上的氢原子用甲基取代,是最早建立的唾液酸衍生方法之一[37],一般称之为全甲基化方法。全甲基化方法自建立后又多次被优化,目前仍然是衍生寡糖的重要方法之一[16]。另一类甲基化方法则先衍生羧基,然后再衍生羟基等其他基团。例如,在用氯化氢的甲醇溶液将羧基甲基化后,可以通过乙酸酐吡啶溶液(acetic anhydride pyridine)、双(三甲基硅烷)三氟乙酰胺(bis(trimethylsilyl)trifluoroacetamide)等试剂将唾液酸分子乙酰化或硅烷化[38,39]。但是自邻苯二胺类试剂被广泛应用后,上述方法已较少用于单糖水平上的唾液酸分析,而且苛刻的反应条件易破坏唾液酸的某些修饰基团[40],进一步限制了相关方法的应用。
另有一种两步衍生方法,先用重氮甲烷(diazomethane)衍生羧基后,再用七氟丁酸(heptafluorobutyric acid)衍生羟基。该反应的生成物既可以保留唾液酸的修饰基团(如乙酰基、甲基等),又可在气相色谱-质谱分析中产生特征性碎片离子,有利于鉴定修饰基团的连接位置以及同分异构体等[41,42]。此方法具有反应速率高且生成物稳定性强等优势,但由于重氮甲烷存在不稳定性和高危险性,使其应用受到了限制。
1.4 烷基胺类试剂
苯胺类试剂主要和唾液酸的α-酮基发生反应,而烷基胺类试剂则通常被用于衍生羧基,已报道的试剂包括十七氟癸胺(heptadecafluoroundecylamine, HFUA)、4-(N,N-二甲基氨基)-7-(2-氨基乙基氨基)-2,1,3-苯并恶二唑(4-(N,N-dimethylaminosulfonyl)-7-(2-aminoethylamino)-2,1,3-benzoxadiazole)、4-(N,N-二甲基氨基)-7-哌嗪子基-2,1,3-苯并恶二唑(4-(N,N-dimethylaminosulfonyl)-7-piperazino-2,1,3-benzoxadiazole)等[43-45]。此类试剂能够同时衍生唾液酸及其氧化产物,例如NeuAc及其氧化产物4-(乙酰氨基)-2,4-二脱氧-D-甘油-D-半乳糖辛酸(4-(acetylamino)-2,4-dideoxy-D-glycero-D-galacto-octonic acid, ADOA)可以用于评估生物体遭受的氧化压力等[44]。以HFUA为代表的含氟衍生试剂,因其衍生物可以特异性地保留在含氟固定相的色谱柱上,并与样品中的其他非氟组分分离,故而能够有效减少液相色谱以及LC-MS分析中的干扰信号[45]。
与苯胺类试剂相似,烷基胺类试剂无法消除端基异构体,使得单一唾液酸易形成多个色谱峰,大大增加了色谱图的复杂性[45]。先消除端基异构体再衍生唾液酸是一种可行的方案。已有文献[46]报道,唾液酸能够被双氧水氧化从而转变为相对分子质量减少28的产物,即ADOA,此产物无端基异构体,或许可以在胺类试剂衍生唾液酸的研究中发挥重要作用。
2 游离唾液酸的衍生方法
糖缀合物上的唾液酸在衍生反应过程中可能发生解离,从而干扰游离唾液酸的定量分析,而使用苯二胺类试剂衍生游离唾液酸的关键在于选择合适的反应条件以抑制解离的发生。最常用的邻苯二胺类试剂是DMB,典型的衍生条件是在酸性环境下保持50 ℃恒温2.5 h;改变条件至4 ℃并延长反应时间至48 h,即可有效衍生样品中游离的唾液酸[18]。DMBA也可以通过类似方法抑制解离并衍生游离的唾液酸[47]。
上述方法现已成为分析游离唾液酸的常规策略,除此之外,近些年也有其他方法被报道[27,48]。氯化氢的正丁醇溶液可以直接衍生游离唾液酸,此反应在无水条件下进行以抑制糖缀合物上的唾液酸发生解离[48]。先从样品中分离游离的唾液酸,再进行衍生化处理,这也是一种有效的分析策略[27,49]。虽然此方法操作复杂,但适用性更广泛。采取简化前处理的方式,通过在负离子模式下的质谱分析也可以直接分析游离的唾液酸[50]。
3 在N/O-聚糖水平上的唾液酸衍生方法
寡糖是一种由几个至几十个单糖单元聚合而成的碳水化合物,经常作为糖缀合物的重要组成部分通过多种途径参与生物体的生理功能。一般而言,可以将寡糖分为4大类:N-聚糖(N-glycan)、O-聚糖(O-glycan)、糖胺聚糖(glycosaminoglycan)和糖脂(glycosphingolipid)[51]。其中,糖胺聚糖很少被唾液酸化(sialylation),目前仅在硫酸角质素(keratan sulfate)中发现了此现象[52-54];其他寡糖则经常发生唾液酸化。因此,本文不讨论糖胺聚糖,仅从N-聚糖、O-聚糖和糖脂的层面总结在寡糖水平上的唾液酸衍生方法。
N-聚糖连接于蛋白质的天冬酰胺残基上,O-聚糖主要连接于蛋白质的丝氨酸或苏氨酸残基上,二者结构较为相似,衍生方法基本可以通用。在N/O-聚糖水平上的唾液酸衍生方法,除至今仍被广泛使用的全甲基化外,近些年来又相继发展了以醇类、胺类试剂为核心的方法[16]。已有较为全面的文献[16,55]总结了这些方法的原理,本文仅从衍生试剂的角度归纳并补充相关内容。
3.1 醇类试剂
在有偶联剂存在的情况下,甲醇/乙醇能够与唾液酸的羧基发生酯化反应[56,57]。该反应对连接位置不同的唾液酸具有很高的选择性。如前文所述,唾液酸经常连接于糖蛋白的末端,且与糖链的连接方式也较为多样化,尤以α2,3-与α2,6-连接最为常见。其中,以α2,6-连接的唾液酸的羧基能够与醇类衍生试剂发生酯化反应;以α2,3-连接的唾液酸则能够与相邻的单糖残基(通常是半乳糖)发生缩合反应,生成内酯。衍生反应的高选择性使得糖链产生结构差异与相对分子质量差异,有利于在色谱与质谱分析中鉴定唾液酸的连接方式。以甲醇衍生为例,如果糖链中存在α2,6-连接的唾液酸,则相对分子质量增加14(见图4a);如果糖链中存在α2,3-连接的唾液酸,则相对分子质量减少18(见图4b)[57]。此类方法通过相对分子质量差异鉴别不同连接方式的唾液酸,一般称之为“连接特异性”(linkage-specific)衍生方法。

图4 唾液酸的连接特异性衍生示意图
3.2 胺类试剂
与醇类试剂相似,以甲胺、二甲胺、异丙胺等为代表的胺类试剂也可以在无水条件下与α2,3-、α2,6-连接的唾液酸发生特异性反应。其中,α2,6-连接的唾液酸发生羧基酰胺化反应;α2,3-连接的唾液酸发生内酯化反应,通过质谱分析衍生后的糖链就可以鉴定唾液酸的连接方式[58,59]。截至目前,已经被用于连接特异性衍生的试剂有10余种,不同试剂的衍生效果存在一些差异性,以异丙胺的特异性最高[59]。值得注意的是,连接特异性的衍生方法主要适用于样品中仅含有α2,3-与α2,6-连接的唾液酸,而对于α2,8-连接的结构,其能与相邻唾液酸的羟基发生内酯化反应(见图4c),模式与α2,3-连接的唾液酸较为相似[60]。
α2,3-连接的唾液酸形成的内酯稳定性不高,连接特异性的衍生方法被进一步优化,通过两步反应依次衍生α2,6-与α2,3-连接的唾液酸。在第一步反应中,α2,6-连接的唾液酸被酯化或胺化,α2,3-连接的唾液酸被内酯化;在第二步反应中,内酯化的唾液酸开环后被其他胺类试剂继续衍生[59,61]。两步反应既保证了衍生产物的特异性,也增强了其稳定性,逐渐成为表征酸性N/O-聚糖的常用方法之一。
胺类试剂的特异性衍生作用通常在1-(3-二甲基氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三唑存在的情况下发生。若改变反应条件则可以消除这种特异性,例如,在1-羟基苯并三唑不存在的情况下,甲胺、甲苯胺可以同时胺化α2,3-、α2,6-和α2,8-连接的唾液酸[60,62,63]
3.3 肼类试剂
与胺类试剂相似,肼类试剂也可以与唾液酸的羧基发生缩合反应,生成酰肼衍生物。事实上,已有多种肼类试剂被用于衍生寡糖的还原端,但用于衍生唾液酸的试剂仍然不多,主要为乙酰肼(acetohydrazide)[40]。另一种肼衍生方法则是由羟基在强氧化剂作用下生成的酮基与肼类试剂发生反应[64]。当氧化剂高碘酸钠的浓度达到10 mmol/L时,寡糖的末端残基均可与肼反应;若降低高碘酸钠的浓度至1 mmol/L,则只有糖链末端的唾液酸残基与肼反应,通过此方法可以选择性富集唾液酸化的糖肽[15,65]。
4 在糖脂水平上的唾液酸衍生方法
糖脂是一类由寡糖与脂类共价连接而成的糖缀合物,部分糖脂的糖链末端含有唾液酸残基,以神经节苷脂(ganglioside)最为典型。神经节苷脂大量存在于神经系统中,参与众多生理过程,并在一些疾病中发挥重要作用[6,66]。一般而言,通过质谱的负离子模式可以直接分析唾液酸化的糖脂[67,68],不过,因衍生后的糖脂在提高色谱分离度以及稳定唾液酸残基等方面具有一些优势,故衍生化方法在相关研究中也有较为广泛的应用。
4.1 甲基化试剂
全甲基化方法于20世纪60年代已被用于衍生糖脂,现如今仍然是重要的糖脂衍生方法之一[66,69,70]。常规的全甲基化方法会掩盖天然分子中的甲基化修饰,研究者采用氘代碘甲烷衍生神经节苷脂,并在蓝指海星(Linckialaevigata)中发现了C8位置存在天然甲基化修饰的唾液酸[71]。全甲基化衍生一般需要在强碱性试剂(如氢氧化钠)存在的情况下发生;若改变反应条件,取消强碱性试剂,则碘甲烷主要与唾液酸的羧基反应生成甲酯类物质[72,73]。类似地,3-甲基-1-对甲苯基三氮(3-methyl-1-p-tolyltriazene)可以代替碘甲烷完成羧基的甲基化反应[74,75]。相对于全甲基化方法而言,甲基化的反应条件较为温和,有利于抑制唾液酸残基上的修饰基团被破坏。值得注意的是,甲基化方法主要衍生α2,3-与α2,6-连接的唾液酸,而α2,8-连接的唾液酸易在反应过程中被内酯化[60],通过此现象应当可以特异性地鉴别α2,8-连接的结构。
4.2 胺类试剂
近些年来,胺化反应逐渐被引入到唾液酸化糖脂的色谱与质谱分析中。胺化试剂与羧基发生缩合反应后能够将酸性基团中性化,有利于稳定唾液酸残基。糖脂被2-(2-吡啶胺)乙胺(2-(2-pyridilamino)ethylamine)衍生后,一方面能够产生荧光从而便于通过液相色谱-荧光检测方法分析;另一方面也可以改变二级质谱的碎片化模式,有利于简化谱图。对于烷基胺类试剂而言,其在无水条件下可以衍生唾液酸。而最近一项研究[60]表明,甲胺、乙胺等试剂在水溶液中依然可以高效率衍生唾液酸化糖脂;与之相对,异丙胺、二甲胺等试剂在相同条件下却几乎不与羧基反应。连接特异性的衍生方法也适用于糖脂,其中,α2,6-连接的唾液酸发生羧基酰胺化反应;α2,3-与α2,8-连接的唾液酸发生内酯化反应,而内酯化的唾液酸在开环后可以继续被其他胺类试剂衍生[60]。
在1 mmol/L高碘酸钠存在的情况下,唾液酸残基的C7与C8键断开后生成酮基,生成的酮基可被胺类试剂进一步衍生,近期文献[76]报道了一种基于此操作的同整质量标记(isobaric tag)[77]唾液酸化糖脂的方法。串联质谱标签(tandem mass tag)通常被用于标记多肽、N/O-聚糖的还原端[78,79],上述方法则创新性地将其拓展应用于标记糖脂。不过,此方法会破坏唾液酸残基的结构,导致关键的生物学信息被丢失。
5 结论与展望
经过几十年的发展,研究者们已经建立了多种唾液酸衍生方法,以便增强对其生物功能的认识。但开发新的衍生方法与检测技术仍然是当前糖生物学领域的重要话题与关键任务。
单糖水平上的唾液酸衍生方法应当致力于解决如下几个问题:第一,减少副反应的发生;第二,消除目标分子的端基异构体等;第三,增强修饰基团的连接位点与同分异构体鉴别能力;第四,发展同位素标记等相对定量分析技术。N/O-聚糖水平上的唾液酸衍生方法相对成熟,当前主要面临色谱分离度与检测灵敏度不能满足需求的问题,以及相关方法没有得到规范化应用等问题。糖脂水平上的衍生技术则需要考虑:第一,建立能够改善待测分析物分子的碎片化模式的方法;第二,将N/O-聚糖衍生方法推广到本领域内;第三,建立温和的同位素标记方法。
