血清抗苗勒管激素检测对多囊卵巢综合征的诊断意义
2019-11-07张琳岳喻伦闫莉汪靖园
张琳,岳喻伦,闫莉,汪靖园
(西安医学院附属宝鸡医院,1.检验科;2.妇产科,陕西 宝鸡 721006;3.西安交通大学第一附属医院检验科,陕西 西安 710061)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄妇女较为常见的内分泌症候群,以稀发排卵或不排卵(OA)、高雄激素血症(HA)、卵巢多囊样形态(PCOM)为主要特征,发病率高达5%~10%,占无排卵性不孕症患者的50%~70%[1-2]。PCOS患者多表现为月经稀少、闭经、多毛、不孕、肥胖、胰岛素抵抗(IR)等症状体征,增加了II糖尿病、代谢相关疾病和心血管疾病发生风险,严重影响身心健康和生活质量[3]。目前PCOS的发病机制尚未明确,临床表现呈异质性,不利于临床准确诊断和指导相关治疗。抗苗勒管激素(anti-Mullerian hormone,AMH)是转化生长因子β超家族的重要成员,也称为苗勒氏管抑制物。近些年,国内外陆续有报道[4-5]指出PCOS患者血清AMH表达异常升高,和卵泡发育及内分泌激素水平存在某种关联,其临床检测价值在生殖内分泌领域逐渐突显。本研究检测68例PCOS患者血清AMH和相关生化内分泌指标水平,旨在探讨AMH检测对PCOS的诊断意义。现报告如下。
1 资料和方法
1.1 一般资料
收集西安医学院附属宝鸡医院2017年12月至2018年7月收治的68例PCOS患者,记为PCOS组,均符合2003年鹿特丹会议制定的PCOS诊断标准[6]:(1)月经稀发、闭经,排卵或无排卵;(2)具有HA征象,如多毛、痤疮、肥胖或雄激素升高等;(3)超声检查提示卵巢呈多囊性改变。上述3项中具备2项以上且排除其他高雄激素病因,即可确诊PCOS。排除库兴氏综合征、卵巢早衰、先天性肾上腺增生、高催乳素血症、甲状腺疾病等内分泌相关疾病或其合并恶性肿瘤者。选取同期来院体检的40例月经周期规律的健康女性,记为对照组。两组纳入对象入组前2个月均未使用影响内分泌药物或相关治疗,且均对研究知情同意。该研究已获得医学伦理委员会批准。
1.2 研究指标及方法
两组对象均于月经周期第2~4天抽取晨起空腹外周静脉血5 mL(闭经者抽血时间不限),室温下静置5 min,常规3 000 rpm/min离心10 min分离血清,于-20 ℃冰箱冷存待测。检测指标包括血清AMH、卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)、雌二醇(E2)、催乳素(PRL)、空腹血糖(FBG)和空腹胰岛素(FIN)等。
血清AMH水平:酶联免疫吸附法(ELISA)法检测,检测仪器采用美国Dynex 全自动酶免分析仪,试剂盒购于广州康润科技有限公司(产品号KR-001-2015042),组内变异系数<5%,组间变异系数<15%。血清FSH、LH、T、E2、PRL、FIN水平:化学发光法检测,检测仪器采用美国贝克曼全自动发光免疫分析仪及配套试剂,组内、组间变异系数<6.25%。FBG:己糖激酶法检测,检测仪器采用日本东芝TBA-120FR全自动生化分析仪。
采用超声监测双侧卵巢卵泡数目(FN);测量两组身高体重,根据体质指数(BMI)=体重(kg)/[身高(m)×身高(m)]计算BMI(Kg/m2);采用胰岛素抵抗指数(HOMA-IR)评估IR状态,计算公式:HOMA-IR=[FBG×FIN]/22.5。
1.3 统计学分析
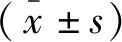
2 结果
2.1 两组一般资料比较
PCOS组中,年龄22~34岁,平均(27.21±3.18)岁;BMI指数19.43~27.16 kg/m2,平均(24.03±2.98)kg/m2。对照组中,年龄21~34岁,平均(27.09±3.20)岁;BMI指数17.54~25.16 kg/m2,平均(21.24±2.63)kg/m2。两组年龄比较,差异无统计学意义(t=0.189,P>0.05),PCOS组BMI指数高于对照组,差异有统计学意义(t=4.902,P<0.01)。
2.2 两组血清AMH和相关研究指标水平比较
PCOS组血清AMH显著高于对照组,差异有统计学意义(P<0.01);组间血清FSH、E2、PRL比较,差异无统计学意义(均P>0.05),但PCOS组LH、T、FBG、FIN水平和FN、HOMA-IR均高于对照组,差异有统计学意义(均P<0.05或<0.01)。见表1。

表1 两组血清AMH水平及相关研究指标比较
2.3 血清AMH和相关指标相关性分析
Pearson法分析显示,两组血清AMH水平和年龄、BMI、FSH、E2、PRL水平无明显相关性(P>0.05),与LH、T、FBG、FIN、FN及HOMA-IR均呈正相关(r=0.276、0.309、0.343、0.317、0.332、0.374,均P<0.05或<0.01)。对照组血清AMH仅与LH、FN水平呈正相关(r=0.280、0.291,P<0.05)。见表2。
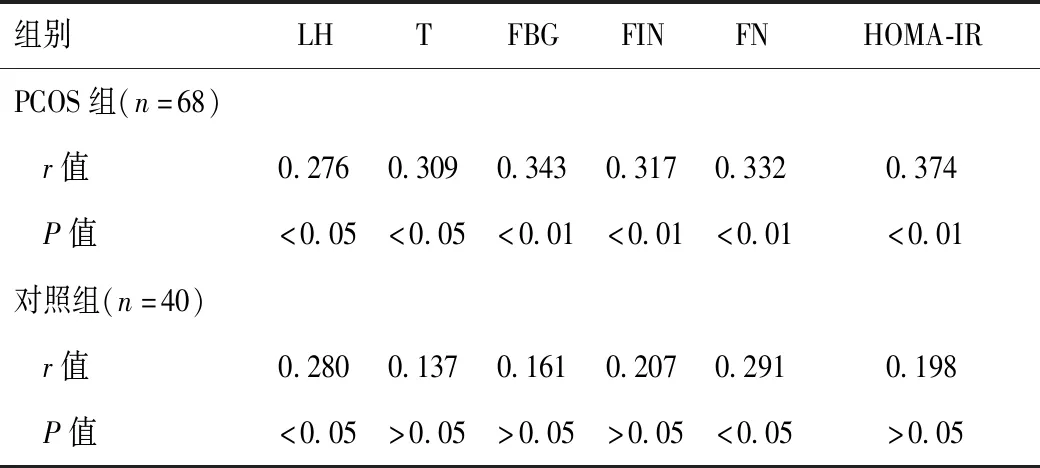
表2 血清AMH水平和相关指标相关性Pearson法分析
3 讨论
AMH属于转化生长因子β(TGF-β)超家族成员,近年来发现PCOS患者血清和卵泡液AMH水平明显高于健康同龄女性,成为生殖健康领域备受关注的激素指标[7]。AMH由两个72 000的二聚体单体组成,在胚胎期与性分化、性腺发育有关,出生后表达于女性卵泡颗粒细胞上,由卵巢的窦前卵泡和小窦状卵泡分泌,主要作用是抑制原始卵泡的募集,同时降低生长卵泡对FSH的敏感性,可能在卵泡选择和发育中发挥重要作用[8]。国外也有报道[9]指出,AMH作为卵泡募集的调节因子,可以调节卵泡发育和性激素合成,能较好反映卵巢储备功能,敏感预测卵巢对超排卵的反应性,对PCOS等生殖内分泌疾病具有潜在检测价值。
窦卵泡数量显著增加是PCOS患者典型的生殖内分泌特征,也是造成不孕的重要原因[10]。有卵巢形态学研究[11]显示,PCOS患者≤4 mm的小窦状卵泡数量是正常同龄女性的2~3倍,在卵巢皮质表面呈“项链征”排列,但同时卵泡发育停滞,不发生优势卵泡的选择,这种特征和AMH的生成及作用机制存在某种关联。本研究显示,PCOS组血清AMH高达(6.93±2.35)ng/mL,明显高于对照组(3.93±1.68)ng/mL(t=7.074,P<0.01),提示AMH可能参与调节卵泡生长发育过程,早期窦状卵泡数量明显增多是AMH分泌水平升高的重要原因[12]。但临床单纯依靠B超下窦卵泡计数诊断评估PCOS也存在一定不足,原因在于部分PCOS患者血清AMH水平升高不仅仅受窦卵泡数目增多的影响,还和各个卵泡分泌AMH的能力有关,因此用血AMH检测取代超声下卵泡数目作为PCOS的辅助诊断依据存在一定合理性[13-14]。
HA是PCOS的另一重要内分泌特征,PCOS患者高LH和雄激素水平可抑制颗粒细胞增殖,易导致卵泡提前黄素化(LUFS)和发育异常[15]。AMH可能与雄激素存在潜在联系,PCOS患者AMH水平增加可能与雄激素促进卵泡聚集、促进其分泌有关[16]。有报道[17]指出,AMH和雄激素水平呈正相关,并认为AMH通过抑制芳香化酶mRNA表达,使雄激素向雌激素转化过程受阻,造成卵泡局部高雄激素环境。当雄激素累积到一定阈值时可影响卵泡发育和优势卵泡的形成,同时产生过多的AMH会进一步加剧局部高雄激素环境,导致恶性循环。本研究显示PCOS组AMH和LH、T、FBG、FIN、FN及HOMA-IR均呈正相关(P<0.05或<0.01),也充分证实AMH和卵泡发育和雄激素水平的内在相关性,和Matsuzaki等[18]研究相吻合。值得强调的是,AMH和HOMA-IR也呈正相关,但其具体机制尚不明确,可能和胰岛素刺激PCOS患者雄激素分泌以及增加HA风险等有关[19]。此外,相较FSH、LH、T、E2等传统检测指标,AMH水平在整个月经周期中较为稳定,不受外源性促性腺激素类药物、避孕药及下丘脑-垂体轴分泌的促性腺激素等影响,可在月经周期任意时间检测,操作也较为方便[20]。
综上所述,血清AMH水平与卵泡发育及内分泌激素合成失调具有密切相关性,常规激素指标检测基础上联合AMH检测对临床诊断评估PCOS具有重要的辅助参考价值。但目前医学上对AMH和PCOS的研究深度有所不足,如缺乏AMH对PCOS的诊断界值标准,种族、地区和遗传是否影响PCOS患者AMH表达等,在后续的研究中需进一步深入探讨。
