不同培养基对牡丹、芍药杂交种胚培养的研究
2019-11-07贺丹苏晓迪何松林解梦珺郑云冰王政刘艺平
贺丹,苏晓迪,何松林,解梦珺,郑云冰,王政,刘艺平
不同培养基对牡丹、芍药杂交种胚培养的研究
贺丹1,2,苏晓迪1,何松林1,2*,解梦珺1,郑云冰1,王政1,刘艺平1
1. 河南农业大学林学院, 河南 郑州 450002 2. 河南科技学院, 河南 新乡 453003
目前牡丹、芍药远缘杂交种胚的挽救未能建立起高效稳定的体系,杂交种胚珠和幼胚培养的研究也鲜少报道。本文通过对牡丹、芍药杂交败育前的杂交胚进行培养,研究了不同培养基对杂种胚萌发的影响。以牡丹品种‘凤丹白’(‘Feng dan bai’)、芍药品种‘粉玉奴’(‘Fen yu nu’)为亲本,进行远缘杂交。本研究以MS为基本培养基,添加不同浓度的激素组合,对杂交种胚正常生长的初代培养基进行了筛选,认为处理为MS + 6-BA 1.0 mg·L-1+ NAA 0.1 mg·L-1+ 3%蔗糖的膨大率,发芽率及发芽势相对较高,是较好的初代培养基。将初代培养基上的幼苗转移至继代培养基上,30 d后发现,各项指标最优的处理为MS + IBA 0.2 mg·L-1+ GA30.2 mg·L-1+ 6-BA 0.2 mg·L-1+ 3%蔗糖,其次为MS + IBA 0.1 mg·L-1+ GA30.3 mg·L-1+ 6-BA 0.2 mg·L-1+ 3%蔗糖。本试验在生根培养30 d后发现,MS + IBA 0.3 mg·L-1+ NAA 0.2 mg·L-1+ 3%蔗糖的培养效果较好,根状突起较多,根数及根长都相对较高。胚培养结果表明:培养基种类不同,对胚的诱导分化也有所不同。
牡丹; 芍药; 杂交种; 培养基; 胚培养
牡丹()是温带原产落叶灌木,因其花大色艳、华贵芬芳,长期以来深受人们的喜爱,是我国著名的观赏、药用植物[1]。芍药()为芍药科芍药属植物,芍药作为花卉资源,因花大色艳、品种繁多,经过人工的配置即可形成引人入胜的景观,具有极高的园林观赏的价值[2,3]。然而在现实生产过程中牡丹芍药的繁殖会遇到多种困难[4]。作为植物繁殖的新手段,组织培养技术已广泛普及,其优点是它在短时间和较少的空间内,从一个小个体产生大量的植株,因其繁殖系数高且周期短,大大加快了育种进程[5-7]。目前,牡丹、芍药远缘杂交种胚的挽救还未能建立起高效稳定的体系,而且杂交种胚珠和幼胚培养的研究也鲜少报道。因此,在以后的工作中,应着重从继代培养基的筛选、激素组合、减轻褐化等方面进行杂种胚挽救的研究,为今后牡丹的育种工作开辟新的方向。有研究表明幼胚培养能够使胚快速萌发成苗,将萌发时间提前,可用于挽救杂种胚败育、解除种子休眠、将育种周期提前、提高发芽率等,加速育种的进程[8,9]。而杂交育种是提高植物观赏价值、选育植物新品种的重要途径[10]。然而园艺植物种间和属间杂交经常会碰到一些阻滞,如花粉无法正常萌发、花粉管畸形生长,或受精后胚与胚乳畸形生长、种胚败育、无法顺利萌发等[11]。为了满足市场生产需求,胚挽救技术在杂交育种工作中被广泛应用,不仅可以克服部分障碍,加快植物育种进程,也成为了研究者们在植物种质创新和新品种培育方面争相发掘的课题[12,13]。同时,该技术在快速繁殖方面也有巨大潜力。在胚挽救过程中,为了降低对胚的伤害,保证培养中胚的顺利生长,尽量直接用胚珠或子房进行培养,其中胚珠与胚培养是较为常用的方式。如今,胚培养技术已经在一些农作物(小麦等)及园艺植物(橄榄、七叶树等)上获得了一定进展[14-16],已有研究发现,胚的不同发育时期及培养基等对胚培养的结果具有非常大的影响,胚培养开始逐渐由培养成熟胚向近成熟胚培养发展[17-19]。但在杂交胚育种工作中仍有诸多问题尚未解决,如幼胚继代培养、杂交种褐化严重问题都大大影响了育种工作的效率[20]。
本试验以前人的技术和研究理论为基础[21,22],选择花期相近、生长势较强的牡丹芍药品种为父母本,开展远缘杂交试验,研究培养基、激素组合对杂交种幼胚诱导的影响,由此选择出牡丹芍药胚挽救的最适培养基类型及激素配比组合,旨在获得远缘杂交育种材料的同时,探讨出适合杂种胚培养的最佳培养基,为今后牡丹芍药的远缘杂交育种奠定基础。
1 材料与方法
1.1 试验地点与材料
实验地点在河南农业大学苗木基地进行试验。选用生长势强,枝繁叶茂,枝干健壮的牡丹和芍药作为供试材料,根据试验条件对杂交后的种胚进行选取。材料种类:牡丹‘凤丹白’(‘Feng dan bai’);芍药‘粉玉奴’(‘Fen yu nu’)。
1.2 杂交试验方法
选择生长势强、花药繁密的‘粉玉奴’(父本),与结实力强的‘凤丹白’(母本)进行杂交,于松蕾期,去掉雄蕊和花瓣,套袋并挂上标签,每天观察柱头的时期及形态特征,直至第10 d。为保证授粉成功,连续授粉3 d。授粉后立即套袋,挂上标签,并注明授粉日期,以最后一次授粉时间作为授粉受精过程的开始,于授粉后7~10 d轻轻去掉套袋。杂交后观察柱头发育状况,并根据败育时期及时采集材料。杂交数量为982朵,采用重复授粉的方法。
1.3 杂交种胚处理
将采集回来的杂交种子去种荚,温水浸泡3~4 h后剥去种皮,于流水下冲洗2 h,用吸水纸吸去多余水分后放置于无菌超净工作台上备用。
在无菌超净工作台上用75%酒精(30 s)、0.1% HgCl(8 min)、无菌水(2次2 min)对去种皮种子进行循环两次的消毒处理,最后用无菌水搅拌清洗3 min(3次)。将消毒后的种子放在有滤纸的灭过菌的培养皿上,用镊子和刀小心取出胚乳内靠近珠孔一侧的幼胚,然后接种在启动培养基中。
1.4 不同GA3、NAA、IBA和6-BA水平的设计
培养方法:以下各种培养基均加入蔗糖3.0%、琼脂0.7%、pH调至5.8,并放置于培养室中常规条件(温度24±1 ℃,光强2000 LX,光照时间12 h·d-1)下培养。
1.4.1 初代培养以MS为基本培养基,设置6组不同浓度的6-BA、NAA梯度组合,浓度配比如表1所示。每个处理接种9瓶,每瓶接3个种胚。定期观察培养物污染、褐化、上胚轴膨大、真叶抽生率等生长表现。30 d后统计各项指标。

表1 初代培养基及激素组合
1.4.2 继代培养分别以MS、1/2MS为基本培养基,设置7组不同浓度的IBA、6-BA、NAA、GA3梯度组合,浓度配比如表2所示。每个处理接9瓶,每瓶接3个胚。定期观察幼苗污染、褐化、苗枯死数、胚轴膨大、真叶抽生等生长表现。30 d后统计各项指标。

表2 继代培养基及激素组合
1.4.3 生根培养以MS为基本培养基,设置4组不同浓度的IBA、NAA梯度组合,浓度配比如表3所示。每个处理接种9瓶,每瓶接3个种胚。定期观察幼苗生根数、根数、愈伤、叶片枯死、苗枯死数等生长表现。30 d后统计各项指标。

表3 生根培养基及激素组合
1.5 胚苗形态指标的统计与分析
测定胚苗抽真叶率、发芽势、抽腋芽率、根数、胚轴膨大率、污染率、死亡率。
抽真叶率(%)=抽出真叶株数/该种培养基中接种胚的总数×100%;
发芽势=该种培养基中的幼胚在发芽过程中发芽种胚数达到高峰期时正常发芽种胚总数/该种培养基中接种胚的总数×100%;
发芽率(%)=该种培养基中的幼胚发芽数/该种培养基中接种胚的总数;
抽腋芽率(%)=子叶或茎的腋芽抽出的胚数/该种培养基中接种胚的总数×100%;
胚轴膨大率(%)=胚轴膨大胚数/该种培养基中接种胚的总数×100%;
死亡率(%)=枯死苗数/该种培养基中接种胚的总数×100%;
生根率(%)=生根的幼苗数/该种培养基中接种胚的总数×100%。
2 结果与分析
2.1 不同初代培养基对杂交胚生长的影响
经过30 d的初代培养,结果如表4所示。杂种胚接种于初代培养基上3~5 d后子叶开始张开(如图1-A),13 d左右子叶开始迅速变大变绿(如图1-B),30 d上胚轴开始伸长,真叶抽出(如图1-C、D)。在6种培养基中,胚膨大率由高到低依次为A-6(92.0%),A-5(74.1%),A-2(59.3%);抽真叶率由高到低为A-1(54.2%),A-6(44.0%),A-2(33.3%);褐化率由低到高依次为A-1(0),A-2(0),A-3(6.3%);污染率整体偏低。综合认为,A-6上的胚膨大率、抽真叶率、发芽势相对于其它处理较高,且无污染率,是较好的初代培养基。

表4 不同初代培养基对杂交胚生长的影响

图1 胚初代培养
2.2 不同继代培养基对杂交胚继代生长的影响
将各初代培养基上的幼苗转至继代培养基上培养30 d后,统计各形态指标,结果如表5所示。从幼苗生长状况上来看,在7种培养基中,抽真叶率最高的为B-6(77.1%),其次为B-5(75.0%);抽腋芽率最高的为B-6(62.9%),其次为B-5(57.1%);污染率整体较低,除B-1(6.5%),B-4(9.7%)外,其它处理均无污染;胚轴膨大率最高为B-6(51.4%),其次为B-3(34.4%);枯死率最低为B-6(37.1%),其次为B-5(39.3%)。其中,B-1,B-2,B-3,B-4上的幼苗真叶与茎抽出较快,但茎过长,有徒长趋势,且易生出愈伤组织,容易褐化。综上认为,B-6(如图2-A),B-5(如图2-B)上的幼苗生长状况相对良好,具有较好的幼苗继代效果。
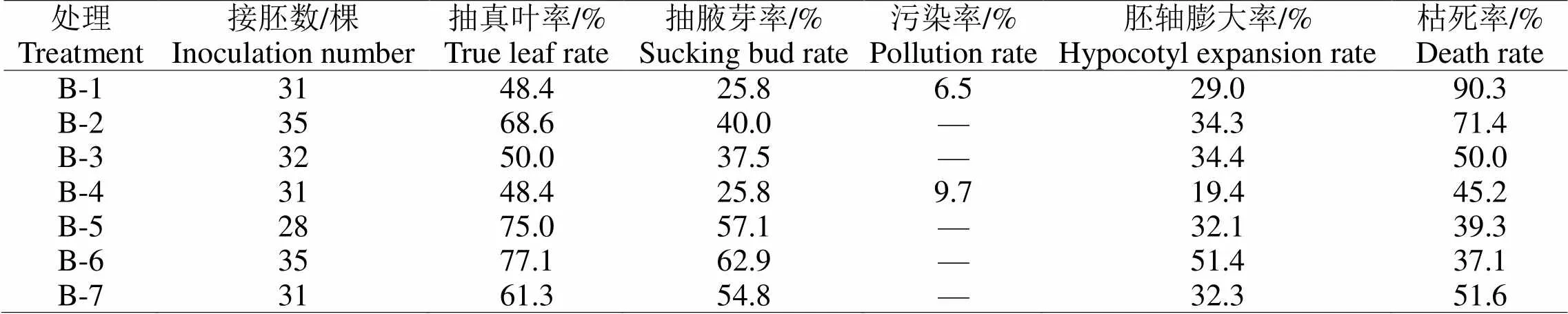
表5 不同继代培养基对杂交胚幼苗生长的影响

图2 胚继代培养
2.3 不同生根培养基对杂交幼苗生根生长的影响
将继代培养基上的杂交幼苗转入生根培养基中进行生根培养,培养15 d后,部分外植体胚根基部出现白色的根状凸起,其后有定根出现,30 d后统计生根情况,结果如表6所示。
从幼苗生长状况来看,C-1、C-2各生根一棵,根数均为2,其它处理无生根现象;C-1根长为1~2 cm,C-2根长0~1 cm;苗枯死率以C-1(51.9%)最低,其它处理均较高;C-1根原基突出较为明显,C-4无根原基突出现象;C-4的褐化程度较高,但愈伤现象一般;C-1褐化程度较低且存在个体差异,但愈伤现象明显。综上所得,虽然C-1(如图3)上的幼苗根长较长、根状突起较多,褐化程度相比于其它处理轻,但是在培养过程中幼苗逐渐枯死,且愈伤现象严重,因此可以用作短期生根试验培养基。
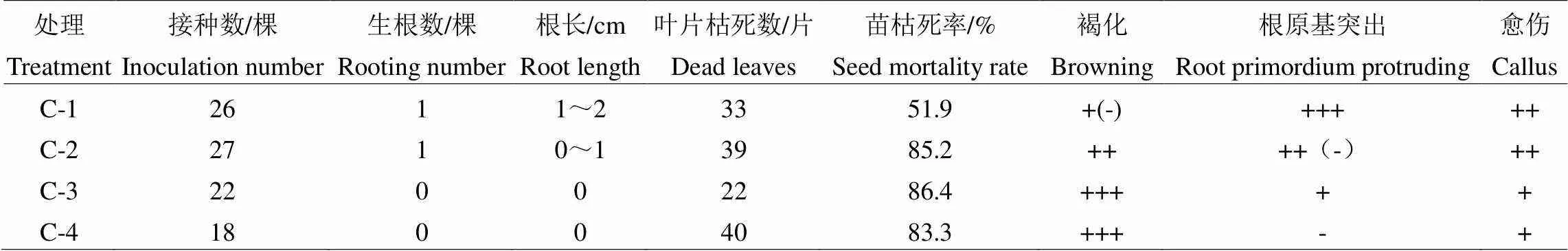
表6 不同培养基对杂种幼苗生根生长的影响
注:-表示无现象;+表示现象一般;++表示现象明显;+++表示现象很明显;+(-)表示存在个体差异。
Note:- indicates no phenomenon; + indicates general phenomena; ++ indicates phenomena; +++ indicates phenomena is obvious; +(-) indicates individual difference.

图3 胚生根培养
3 讨论
培养基种类不同,对胚的诱导分化也有所不同。在已经报道的牡丹组织培养研究中曾发现,杂种胚在MS基本培养基上的萌发率最高,适合作为牡丹杂种胚挽救的培养基[21]。植物在组织培养过程中,往往要添加一些植物调节剂来催化器官或组织的分化[7]。影响植物的萌发并不是单独的激素因素起作用,激素在发挥其生理作用时并不是独立的,而是互相影响,互相制约的[23]。高昌勇与纪庆亮分别在牡丹胚组织培养的研究结果中表明,添加6-BA的MS培养基中培养的牡丹胚的上胚轴、下胚轴可以正常生长,并且有些胚的芽萌动,真叶生长,可形成完整幼苗,NAA促进胚基部愈伤组织的形成,对胚生长有明显的抑制作用[24,25],与本实验结果相似。
继代培养基对杂种胚的继代生长也至关重要。另外在试验中发现,随着GA3浓度的上升,胚苗出现了茎徒长、胚轴褐化和愈伤严重的现象,之后在培养基中添加1 g·L-1的PVP并没有降低褐化的程度。此结果与何桂梅在两种牡丹胚培养以及王雪玲在牡丹芍药胚培养上的研究结果相似[17,26]。
此外,影响组培苗生根的因素有很多,培养基类型是其中较为重要的因素。一般而言,木本植物比草本植物难生根,来自成年树的外植体比来自幼年树的外植体难生根,生根使用的培养基多为MS或1/2 MS[20]。牡丹组培苗在一般情况下较难生根,这也是影响组培快繁技术应用于生产的难点,目前生根中的影响因素主要有继代时间、激素类型、生根方法等[26]。殷丽青等在以牡丹幼胚为外植体诱导愈伤组织时,将体胚转接培养后获得了再生植株,但体胚的正常植株转化率不高[27]。本试验在生根培养30 d后发现,虽然有生根现象,但在培养过程中出现叶片枯死,胚轴形成愈伤且褐化严重的现象,推测其原因可能是地上部分茎叶生长过旺,消耗掉了大量碳水化合物,从而抑制了根系发育,由于不能生根及长期的离体培养导致芽处于休眠状态,从而引起较多的叶片、幼苗枯死[17]。要提高离体胚培养的成苗率,需在培养时控制幼苗的长势,降低褐化与愈伤程度,否则胚轴容易形成大量愈伤组织或茎徒长的现象,不利于胚苗后期的正常生长。
4 结论
本试验以MS为基本培养基,附加不同浓度的植物激素6-BA与NAA,对杂交种胚正常生长的初代培养基进行了筛选后,认为A-6(6-BA 1.0 mg·L-1+ NAA 0.1 mg·L-1)的膨大率,发芽率及整齐度相对较高,是较好的初代培养基。在将初代培养基上的幼苗转移至继代培养基上,30 d后统计各项指标发现,各项指标最优的配比为B-6(IBA 0.2 mg·L-1+ GA30.2 mg·L-1+ 6-BA 0.2 mg·L-1),其次为B-5(IBA 0.1 mg·L-1+ GA30.3 mg·L-1+ 6-BA 0.2 mg·L-1)。这两种培养基抽出真叶数较多,抽出侧茎率也相对较高,具有较好的幼苗继代效果。在生根培养的过程中发现,C-1(IBA 0.3 mg·L-1+ NAA 0.2 mg·L-1)的培养效果较好,根状突起较多,根数及根长都相对较高,需在培养时控制幼苗的长势,降低褐化与愈伤程度,以提高杂种苗质量及成苗率。
[1] 包满珠.花卉学[M].第2版.北京:中国农业出版社,2003:489-499
[2] 郁书君,崔永强,杨梅.荷兰的植物新品种保护与审定制度[J].中国农业,2009(1):14-16
[3] 魏冬霞,张滕,郑严仪,等.芍药愈伤组织中体细胞胚发育过程的组织细胞学观察[J].植物研究,2018,38(1):56-63
[4] 王蒙蒙,卜祥藩,张倩,等.“凤丹”离体快繁工厂化技术研究[J].分子植物育种,2018,16(2):526-534
[5] 戴思兰,黄河,符建新,等.观赏植物分子育种研究进展[J].植物学报,2013,48(6):589-607
[6] 文书生,成仿云,钟原.‘正午’牡丹微繁殖体系的建立[J].植物科学学报,2016,34(1):143-150
[7] 王新,成仿云,钟原.凤丹牡丹鳞芽离体培养与快繁技术[J].林业科学,2016,52(5):101-110
[8] 周仁超,姚崇怀.紫斑牡丹胚培养与植株再生(简报)[J].亚热带植物科学,2001,30(3):62,68
[9] 于茜茜,杜娟,王进茂,等.转基因741杨杂种胚培养与植株再生[J].东北林业大学学报,2013,41(10):65-68
[10] 郝津藜,赵娜,石颜通.黄牡丹远缘杂交亲和性及杂交后代形态分析[J].园艺学报,2014,41(8):1651-1662
[11] 王杰,贾月慧,张克中,等.百合雌蕊中杂交亲和性与不亲和性差异表达基因分析[J].北京林业大学学报,2017,39(2):1000-1522
[12] Onay A, Pirinc V, Yildirim H,. In vitro micrografting of pistachio(.Siirt)[J]. Plant cell, tissue and organ culture, 2004(77):215-219
[13] Prem D,Singh S, Gupta PP,. High-frequency multiple shoot regeneration from cotyledonary nodes of guar (L. Taub)[J]. In Vitro Cellular & Developmental Biology-Plant, 2003,39(4):384-387
[14] 李新玲,曲敏,闫玉清,等.影响小麦成熟胚培养及植株再生因素的研究[J].植物研究,2005,25(1):49-52
[15] 吕秀立,施季森.欧洲七叶树的离体培养及快速繁殖[J].南京林业大学学报(自然科学版),2004,28(3):41-44
[16] 蔡汉权,赖钟雄,林燕文,等.橄榄成熟胚培养研究[J].江西农业大学学报,2005,27(4):548-553
[17] 何佳梅.牡丹远缘杂交育种及其胚培养与体细胞胚发生的研究[D].北京:北京林业大学,2006
[18] 安阿莉,苏小玲,毛娟,等.紫斑牡丹幼胚离体培养试验[J].甘肃农业大学学报,2009,44(6):63-68
[19] 朱向涛,王雁,彭镇华,等.牡丹‘凤丹’体细胞胚发生技术[J].东北林业大学学报,2012,40(5):54-58
[20] 张倩,王芳华.牡丹试管苗生根与移栽技术研究进展[J].园艺学报,2012,39(9):1819-1828
[21] 郭子霞.牡丹花粉贮藏及杂交幼胚的挽救[D].郑州:河南农业大学,2012
[22] 王雪玲.芍药牡丹组间远缘杂交及‘凤丹’胚培养研究[D].郑州:河南农业大学,2014
[23] 李新风,巩振辉,孙冬青.不同品种牡丹几个生理参数的比较及其与组培褐化的关系[J].西北农业学报,2008,17(1):142-145
[24] 高昌勇.牡丹胚离体培养的研究[J].安徽农业科学,2009,37(19):8844-8865
[25] 纪庆亮,蒋素华,秦仪利.牡丹组织培养[J].安徽农业科学,2009,37(33):16253-16254
[26] 朱向涛,王雁,吴倩,等.江南牡丹茎段愈伤组织诱导与植株再生[J].核农学报,2015,29(1):56-62
[27] 殷丽青,周音,胡永红,等.毒莠定对牡丹愈伤诱导及体胚发生的影响[J].核农学报,2013,27(8):1106-111
Study on the Embryo Culture of Peony and Paeonia Hybrids with Different Media Components
HE Dan1,2, SUXiao-di1, HE Song-lin1,2*, XIEMeng-jun1, ZHENG Yun-bing1, WANG Zheng1, LIU Yi-ping1
1.450002,2.453003,
At present, no efficient and stable system has been established for distant hybrid embryos of peony and paeonia, and few studies have been reported on the culture of hybrid ovules and young embryos. In this paper, the effects of different culture media on the germination of hybrid embryos were studied by culturing the hybrid embryos before the abortion of peony and Chinese peony. The varieties 'Fenyunu' ofand 'Feng Dan Bai' ofcultivar were used as parents to carry out thedistant hybridization. With MS as the basic medium, adding different concentrations of hormone combina-tions, after screening the primary culture medium for normal growth of hybrid embryos, the effects medium were screened. MS + 6-BA 1.0 mg·L-1+ NAA 0.1 mg·L-1+ 3% sucrose was better in primary culture medium with the better swelling rate and germination rate. The initial medium seedlings were transferred to subculture medium for 30d. The optimal ratio of each concentration was MS + IBA 0.2 mg·L-1+ GA30.2 mg·L-1+ 6-BA 0. mg·L-1+ 3%sucrose, followed by MS + IBA 0.1 mg·L-1+ GA30. mg·L-1+ 6-BA 0.2 mg·L-1+ 3% sucrose. After rootingculture for 30 days, MS + IBA 0.3 mg·L-1+ NAA 0.2 mg·L-1+ 3% sucrose had better culture effect, more rhizomes, higher root number and root length. The results showed that: different types of media can induce different differentiation of embryo.
Peony; Paeonia; hybrid embryo; medium component; embryo culture
S68
A
1000-2324(2019)05-0747-06
10.3969/j.issn.1000-2324.2019.05.003
2018-06-28
2018-07-17
国家自然科学基金(31600568);河南农业大学科技创新基金(30600965);河南农业大学博士启动基金(30600408)
贺丹(1983-),女,博士,讲师,主要从事园林植物遗传育种. E-mail:dandan990111@163.com
Author for correspondence. E-mail:hsl213@yeah.com
