MRI-DWI评估肝癌经导管肝动脉化疗栓塞术后临床疗效
2019-11-06朱明洪陈雪莲余娇徐晓栎韦伟
朱明洪,陈雪莲,余娇,徐晓栎,韦伟
肝细胞肝癌是我国最常见的恶性肿瘤之一,因其病情隐匿、进展迅速,仅有20%~30%的患者能有机会进行根治性切除[1]。经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)已成为BCLC-B级的肝细胞肝癌患者治疗的首选治疗方法,但由于TACE术姑息性、重复治疗的特点,评价其术后疗效显得尤为重要[2]。目前,临床广泛使用多层螺旋CT(multisliecs helieal CT,MDCT)和动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)[3]来评价TACE术的有效性,但这些方法无法对肿瘤坏死提供定量分析。磁共振扩散加权成像(diffusion weighted imaging,DWI)可通过评价组织中水分子的扩散率来反映其含水量及大分子的浓度,从而定量分析肿瘤组织的坏死程度[4]。因此,本研究拟探讨MRI-DWI对TACE术后疗效的评价价值,以期达到精准评估患者肝脏功的结构状态,进而改善患者TACE术的疗效评价。
1 资料与方法
1.1 一般资料
收集2016年1月至2018年7月在我院接受TACE治疗的肝癌患者230例。纳入标准为符合原发性肝癌诊疗规范“原发性肝癌的临床诊断与分期标准”[5]、病理诊断为肝细胞癌、无TACE术禁忌症、肝功能Child Pugh分级为A或B级、于术前1~3 d及术后4~6周行DWI及MRI增强扫描;排除标准为非原发性肝细胞癌、合并胆管癌或肝外转移、严重肝肾功能不全、顽固性腹水及其他无法耐受TACE术的因素。
纳入的230例患者中,男性131例、女性99例,年龄23~86岁,平均(51.39±10.08)岁;肝右叶肿瘤164例、肝左叶66例,肿瘤直径3~11 cm,平均(7.02±2.21)cm。
所有患者或家属在TACE治疗术前均签署知情同意书,本研究在获本院医学伦理理委员会批准。
1.2 检查方法
使用Philips Achieva 3.0T XP超导MRI扫描仪,分别于TACE治疗术前和术后一个月对患者行MRI-DWI检查。
1.2.1 DWI检查 体部线圈,采用自旋回波-平面回波序列,TR/TE为6 400 ms/75 ms,矩阵184×138,层厚为6.0 mm,层间距为1.2 mm;选用扩散敏感梯度因子b分别为50、500、1 000 mm2/s,设3个扩散梯度场方向;患者仰卧位,常规行轴位T1WI、T2WI和冠状面T2WI及DWI扫描,影像学诊断由固定两名副主任医师进行测量各层面肿瘤及正常组织的表观弥散系数(apparent diffusion coefficient, ADC)值。
1.2.2 MRI检查 选用钆喷酸葡胺为造影剂,分别于动脉期/门脉期/延迟期和注射造影剂1 h进行扫描检查。
1.2.3 影像学定量分析 利用工作站AW 4.4进行图像分析,GE后处理软件计算ADC值。术前和术后病灶增强后的对比增强比(contrast enhancemenst ratios,CER)动脉期=(SI动脉期-SI平扫)/SI平扫,术前和术后病灶的信号比(signal intensity ratio,SIR)动脉期=SI病灶/SI肝脏。
1.3 患者资料收集及治疗效果评估
收集纳入患者一般资料,如性别、年龄等,病理诊断情况,根据影响学资料记录肝癌的位置、肿瘤直径。并收集TACE术前和术后MRI-DWII检查中的病灶参数:ADC值、CER动脉期值、SIR动脉期值、肿瘤直径。治疗效果评估参照体瘤疗效评估标准(Response Evaluation Criteria In Solid Tumors,RECIST)标准[6],治疗后实体瘤最大径减少>30%为有效,反之则无效;当靶病灶直径之和较随访期间最小径增加≥20%或出现新发病灶,则病情发生进展。当患者存在多个肝癌病灶时,根据全部可测量病灶直接判断治疗效果。治疗后根据患者治疗效果分为治疗有效组和无效组,比较两组影像学定量参数值变化。
1.4 统计学分析
2 结果
2.1 影像学定性分析及肝癌TACE术后疗效评估
230例患者共检出肝癌病灶284个,肿瘤平均直径为(7.02±2.21)cm。TACE术前病灶呈长T1稍长T2信号,部分病灶内混杂长T1长T2信号,在DWI序列上为高信号,而在ADC图上肿瘤信号低于正常肝实质,动态增强扫描动脉期可见明显强化,门脉期及平衡期强化减退。 TACE术后瘤灶内残存及复发部分动脉期可见明显强化,而瘤灶内坏死部分增强后无强化。根据RECIST标准,患者TACE术后有效组170例,无效组60例。
2.2 影像学定量分析
肝癌患者TACE治疗后瘤灶ADC值较治疗前明显增加,CER动脉期和SIR动脉期较治疗前明显减少,差异均有统计学意义(P<0.05),见表1;有效组和无效组患者术前ADC值、CER动脉期和SIR动脉期差异无统计学意义,术后有效组ADC值大于无效组,CER动脉期和SIR动脉期小于无效组,差异均有统计学意义(P<0.05),见表2。
2.3 典型患者影像学资料

表1 284个肝癌病灶TACE治疗前、后定量参数数值变化
注:ADC,表观弥散系数

表2 两组TACE治疗前、术后肝癌定量参数值变化
注:*与同组术前比较,P<0.05。
3 讨论
TACE术通过动脉注入化疗药物或使供血动脉栓塞,进而诱导肿瘤组织缺血坏死,目前已成为无法手术的肝细胞肝癌的主要治疗手段[7],但由于部分病灶栓塞不满意或侧支动脉循环的形成,肿瘤未能彻底坏死甚至可能再次复发,TACE治疗需进行多次[8],因此准确评估TACE术后的疗效对判断病情转归和制定进一步治疗方案具有重要意义。目前临床上广泛采用CT和MRI评估TACE术后疗效,但当碘油沉积较浓时,CT增强扫描易受影响[9];而MRI无法评估增强前T1WI上的高信号病灶[10]。DWI作为一种快速、准确、无需影像对比剂的成像技术,可对肿瘤组织的坏死程度进行定量分
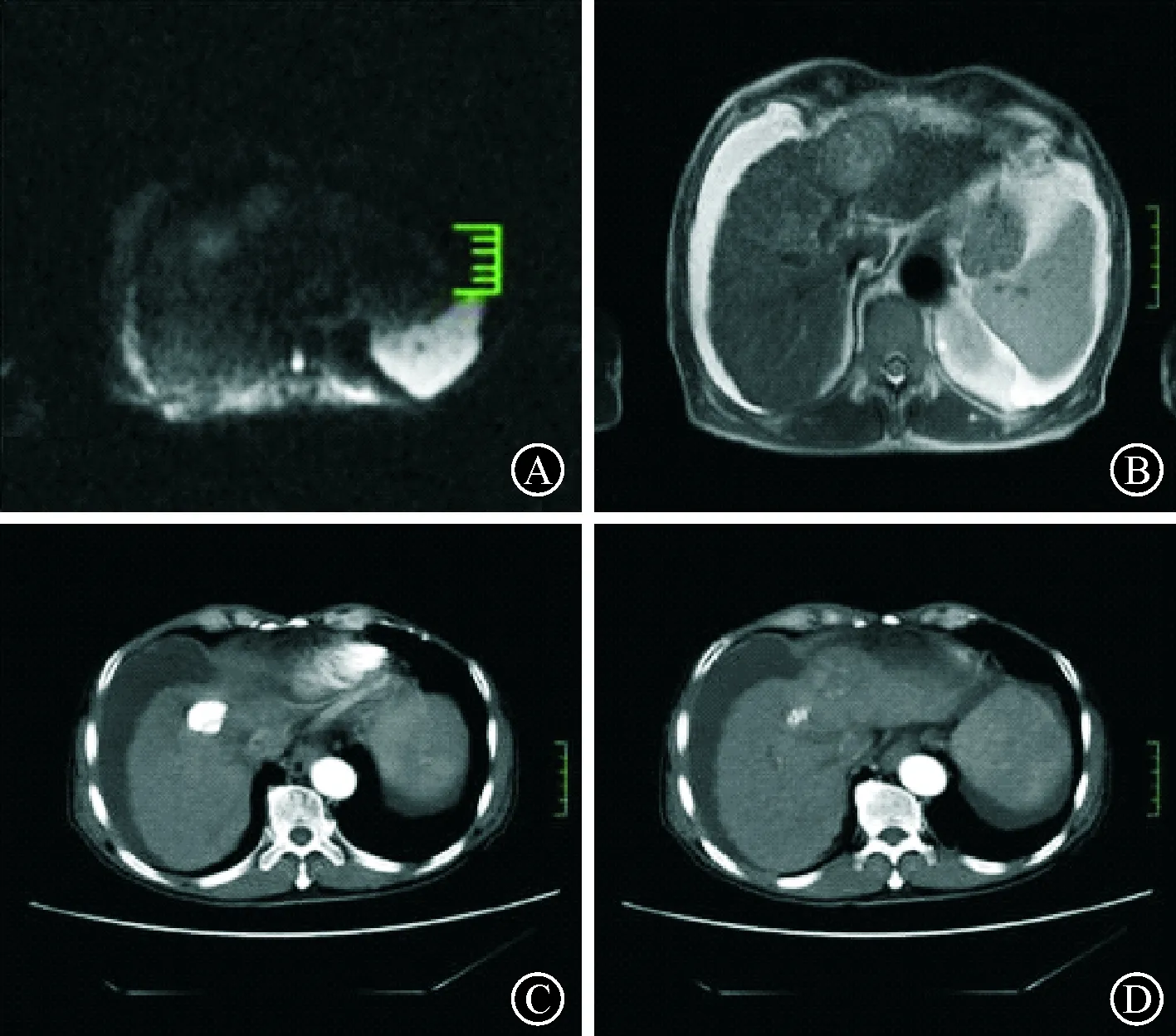
图1一例68岁男性肝细胞癌患者TACE治疗前后影像学变化 A:MRI扫描可见肝左叶内侧段多发团块状异常信号影,DWI呈稍高信号。B:MRI扫描可见肝左叶内侧段团块状异常信号影,T2WI呈稍高信号,治疗后2个月病灶可见小片弥散受限。腹腔内可见液体信号影。C: TACE治疗前CT增强扫检查,肝左叶内侧段见动脉期强化灶,周边不清。D:患者TACE治疗后较TACE治疗前(C)强化范围缩小
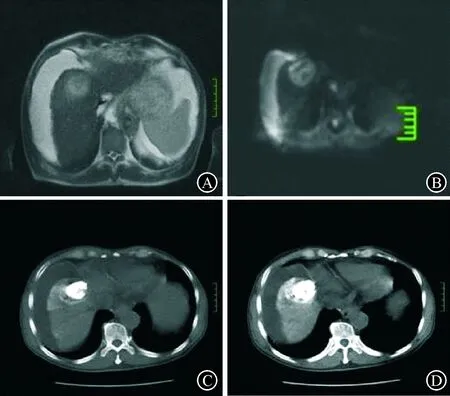
图2一例62岁男性肝细胞癌患者TACE治疗前后影像学变化 A:MRI扫描可见肝右叶团块状异常信号影,T2WI呈稍高信号,边界欠清。B:DWI呈稍高信号。C:TACE治疗后1个月肝脏CT增强扫描。肝左叶内侧段;D:TACE治疗后1个月肝右前叶病灶内大量碘油沉积,病灶较前明显减小,内可见小片斑点状无强化液化坏死区
析[11]。因此,本研究通过分析肝细胞肝癌患者TACE术前后MRI-DWI的结果,探讨该方法对TACE术后疗效的水平等多种方面有关[17],因此及时判断TACE治疗效果也尤为重要。高回青[18]等的研究显示,肝癌TACE治疗有效组的ADC值明显升高,而无效组升高不明显或无变化。本研究也发现,TACE术后有效组ADC值大于无效组,CER动脉期和SIR动脉期小于无效组,差异均有统计学意义(P<0.05)。这主要是由于肿瘤组织残存较多时,细胞间隙减小,水分子扩散受限,因此ADC值保持不变或升高不明显。而有效组术后CER动脉期和SIR动脉期小于无效组,推测原因为肿瘤组织供血动脉被栓塞,有活性的肿瘤组织减少,相应的反映病灶动脉血供的CER动脉期和SIR动脉期降低。而事实上,根据文献报道,尽管约44%~65%患者首次TACE治疗后可能会无效,但再次进行TACE治疗后肿瘤可以得到有效控制[19],对于反复TACE治疗的评估如患者是否具体TACE抵抗、出现疾病进展等MRI复查也具有一定优势[20]。
当然本研究也存在以下的不足:①本研究为回顾性研究,纳入的样本量有限,受到伦理学要求限制,无法开展随机对照组研究,因此得出结论可能存在一定偏倚;②对于MRI的最佳扫描参数、ADC值与复发或新发病灶的关系等问题没有进行进一步讨论分析;③对于肝癌TACE治疗后有效及无效的影响学预测由于患者病例数较少原因未能进一步分析。因此今后仍需要更多前瞻多中心的研究,进一步明确上述问题。
综上所述,我们发现MRI-DWI可有效评估肝细胞癌患者TACE术后的病灶大小及坏死程度,对评估治疗效果、术后早期复发等具有重要价值,能够为进一步治疗方案提供重要的参考依据。
