miR-514a-3p靶向Syk对胃癌细胞活力、迁移和侵袭的影响
2019-11-06赵梦汪玉宝张淳
赵梦,汪玉宝,张淳
胃癌是消化道系统常见的恶性肿瘤,在全球癌症相关死亡中排名第二[1]。近年来,胃癌发病率呈现增长趋势,我国是胃癌的高发地区,每年新增发病人数约60万[2]。由于胃癌患者早期无典型症状,患者确诊时多处于进展期,常伴随有淋巴结转移[3],所以,胃癌患者的治疗疗效较差,预后不佳,晚期胃癌患者5年生存率不超过10%[4]。因此,探寻胃癌的发病机制并寻找胃癌治疗的作用靶点具有重要意义。微小RNA(micro RNA,miRNA)是一类内源性的小分子非编码RNA,长度约为18~25个核苷酸,可与靶mRNA的3′或5′端UTR区结合,抑制mRNA翻译或降解mRNA,调控基因的表达[5]。目前已发现多种miRNA在胃癌中表达异常,参与胃癌细胞的生物学行为,影响胃癌的发生和发展。如miR-27a在胃癌组织和细胞中高表达,并且可能通过激活Wnt /β-catenin信号通路靶向SFRP1促进胃癌细胞的增殖、迁移和侵袭[6]。miR-103a-3p在胃癌组织中表达升高,其在体外通过靶向抑制ATF7表达促进胃癌细胞的增殖[7]。研究显示,miR-514a-3p在黑素瘤、人睾丸生殖细胞肿瘤中异常表达,参与疾病的发生和发展[8-9]。但miR-514a-3p在胃癌细胞中的表达及其对胃癌细胞生物学行为影响和作用机制的相关研究还未见报道。本研究检测了胃癌细胞MGc-803和SGC-7901中miR-514a-3p表达水平,并探讨了miR-514a-3p对SGC-7901细胞活力、迁移和侵袭的影响及调控机制,以期为胃癌的治疗提供新的作用靶点。
1 材料与方法
1.1 细胞和实验试剂
胃癌细胞MGc-803和SGC-7901以及正常胃上皮细胞GES-1均购自中国科学院生物化学与细胞生物学研究所。胎牛血清(FBS),杭州四季青;高糖DMEM、MTT和二甲基亚砜,北京索莱宝科技有限公司;Trizol试剂,美国Invitrogen公司;逆转录试剂盒,北京诺博莱德科技有限公司;PCR试剂盒,日本TOYOBO公司;PCR引物由上海生工生物技术有限公司设计并合成;与转染相关miR-514a-3p mimics、阴性对照等,广州锐博生物科技有限公司; lipofectamineTM2000试剂盒,上海阳光生物科技有限公司;RIPA裂解液、TBST、SDS-PAGE凝胶配制试剂以及BCA蛋白测定试剂盒,上海碧云天公司;脾酪氨酸激酶(Syk)抗体,LabVision公司;GAPDH、Cyclin D1、P21、E-cadherin和MMP-2,美国Santa Cruz;HPR标记的羊抗兔IgG抗体,武汉博士德生物工程有限公司;荧光素酶活性检测试剂盒,上海钰博生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养 GES-1、MGc-803和SGC-7901细胞均采用含10% FBS的高糖DMEM培养基置于37 ℃、5% CO2、97%湿度的培养箱中培养。根据细胞生长情况和培养基颜色变化,每2~3天换液一次。待细胞融合至80%左右时,胰酶消化,进行传代或实验。取适量对数期各细胞,采用qRT-PCR法检测细胞中miR-514a-3p表达水平。
1.2.2 qRT-PCR检测miR-514a-3p表达 收集各组细胞,PBS清洗后加入Trizol试剂提取总RNA。分光光度计检测RNA的纯度和浓度。当RNA溶液在260 nm和280 nm处的吸光值比值处于1.8~2.0时可用于后续实验。根据逆转录试剂盒操作说明书,将提取得到的总RNA逆转录为cDNA。以cDNA为模板进行扩增。PCR扩增条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,共40个循环。以U6为内参,采用 2-ΔΔCt法计算细胞中miR-514a-3p的相对表达水平。
1.2.3 细胞分组和转染 取对数生长期的SGC-7901细胞,采用lipofectamineTM2000脂质体转染试剂进行转染实验。SGC-7901细胞分为anti-miR-514a-3p组和anti-miR-NC组,分别转染anti-miR-514a-3p和anti-miR-NC;miR-NC组和miR-514a-3p组,分别转染miR-NC和miR-514a-3p mimics;anti-miR-514a-3p+si-NC组和anti-miR-514a-3p+si-Syk组,分别共转染anti-miR-514a-3p与si-NC,anti-miR-514a-3p与si-Syk。转染后培养48 h,收集各组细胞用于后续实验。
1.2.4 MTT检测细胞活力 转染后的SGC-7901细胞,调整浓度为5×104个/mL,接种于96孔板中,每孔200 μL,置于培养箱中分别培养24 h、48 h和72 h。培养结束后,向每孔中加入20 μL浓度为5 g/L的MTT溶液,培养箱中继续孵育4 h。取出培养板,吸弃上清液,向每孔中加入150 μL的二甲基亚砜溶液,室温下反应5 min,混合均匀,于酶标仪490 nm处测定各孔的OD值。
1.2.5 Transwell检测细胞迁移和侵袭 ①细胞迁移实验:转染后的SGC-7901细胞,采用无血清的高糖DMEM培养基重悬,调整细胞密度为1×105个/mL。取200 μL细胞悬液,直接加入至Transwell小室的上室中,下室加入500 μL含10% FBS的高糖DMEM培养基,置于培养箱中培养12 h。取出小室,使用棉签擦掉上室表面细胞,4%多聚甲醛固定10 min,结晶紫染色15 min,PBS清洗3次,置于显微镜下观察。随机选取5个视野计数,取平均值作为迁移细胞数。②细胞侵袭实验:首先在小室的上室铺Matrigel基质作为侵袭模型,然后在加入细胞悬液,剩余操作与细胞迁移实验相同。
1.2.6 Western blot检测蛋白表达 各组SGC-7901细胞置于冰上,加入含蛋白酶抑制剂的RIPA裂解液,充分裂解30 min后,4 ℃、12 000 rpm离心15 min。收集上清液(蛋白),采用BCA试剂盒检测蛋白质浓度。取适量蛋白溶液,加入上样缓冲液,煮沸5 min使蛋白变性。然后行SDS-PAGE电泳。电泳结束后,转至PVDF膜,5%脱脂牛奶室温条件下进行封闭,封闭时间2 h。加入一抗,置于4 ℃冰箱中进行孵育,时间12 h。TBST洗膜,加入HPR标记的羊抗兔IgG抗体,室温条件孵育1 h。TBST洗膜,加入ECL发光试剂避光显影,凝胶成像分析系统曝光拍照。Image 软件分析蛋白条带灰度值。以GAPDH为内参,目的蛋白与GAPDH蛋白条带灰度值的比值表示目的蛋白的相对表达水平。
1.2.7 双荧光素酶报告基因实验验证 生物信息学预测结果显示,Syk的3′UTR含有miR-514a-3p的互补序列,miR-514a-3p可能靶向调控Syk表达。为了验证miR-514a-3p对Syk的靶向调控作用,构建Syk野生型(WT)和突变型(MUT)质粒。分为WT-Syk组和MUT-Syk组,WT-Syk组插入Syk野生型质粒3′UTR片段的荧光素酶报告基因载体,MUT-Syk组插入Syk突变型质粒3′UTR片段的荧光素酶报告基因载体。并分别在SGC-7901细胞中转染miR-NC、miR-514a-3p mimics,检测荧光素酶活性。
1.3 统计学方法

2 结果
2.1 miR-514a-3p在正常胃上皮细胞GES-1和胃癌细胞MGc-803、SGC-7901中的表达
qRT-PCR检测结果显示,与正常胃上皮细胞GES-1比较,胃癌细胞MGc-803和SGC-7901中miR-514a-3p表达水平显著升高,差异具有统计学意义(P<0.05),说明胃癌细胞中miR-514a-3p呈高表达。此外,胃癌细胞SGC-7901中miR-514a-3p表达水平相对于MGc-803较高,因此,后续实验选择SGC-7901细胞作为研究对象。见表1。
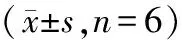
表1 miR-514a-3p在细胞GES-1和细胞MGc-803、SGC-7901中的表达
注:与GES-1组比较,*P<0.05
2.2 抑制miR-514a-3p表达对胃癌细胞SGC-7901活力的影响
分别转染anti-miR-NC、anti-miR-514a-3p至SGC-7901细胞,qRT-PCR检测结果显示,与anti-miR-NC组比较,anti-miR-514a-3p组SGC-7901细胞中miR-514a-3p表达水平显著降低(P<0.05),说明转染anti-miR-514a-3p抑制了SGC-7901细胞中miR-514a-3p表达。MTT检测结果显示,与anti-miR-NC组比较,anti-miR-514a-3p组SGC-7901细胞分别培养24、48、72 h后OD值均显著降低(P<0.05),说明抑制miR-514a-3p表达降低了SGC-7901细胞活力。Western blot检测结果(图1)显示,与anti-miR-NC组比较,anti-miR-514a-3p组SGC-7901细胞中Cyclin D1蛋白表达显著降低(P<0.05),P21蛋白表达显著升高(P<0.05),见表2。

图1抑制miR-514a-3p表达对胃癌细胞SGC-7901增殖蛋白表达的影响
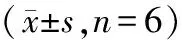
表2 抑制miR-514a-3p表达对胃癌细胞SGC-7901活力的影响
2.3 抑制miR-514a-3p表达对胃癌细胞SGC-7901迁移、侵袭的影响
Transwell检测结果显示,与anti-miR-NC组比较,anti-miR-514a-3p组SGC-7901细胞迁移和侵袭数显著减少(P<0.05),说明抑制miR-514a-3p表达降低了SGC-7901细胞的迁移和侵袭能力。Western Blot检测结果(图2)显示,与anti-miR-NC组比较,anti-miR-514a-3p组E-cadherin蛋白表达显著升高(P<0.05),MMP-2蛋白表达显著降低(P<0.05),见表3。

图2抑制miR-514a-3p表达对胃癌细胞SGC-7901迁移、侵袭蛋白表达的影响
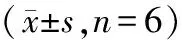
表3 抑制miR-514a-3p表达对胃癌细胞SGC-7901迁移、侵袭的影响
2.4 miR-514a-3p靶向调控Syk
生物信息学软件显示,Syk的3′UTR含有miR-514a-3p的互补序列,见图3A。双荧光素酶报告基因实验结果显示,转染miR-514a-3p mimics 对 MUT-Syk组的荧光素酶活性无显著影响(P>0.05),但能显著降低WT-Syk组的荧光素酶活性(P<0.05),见表4。qRT-PCR和Western blot检测结果(图3B)显示,miR-514a-3p组SGC-7901细胞中Syk mRNA和蛋白表达均显著低于miR-NC组,anti-miR-514a-3p组SGC-7901细胞中Syk mRNA和蛋白表达均显著高于anti-miR-NC组,进一步说明,miR-514a-3p靶向负调控Syk表达,见表5。
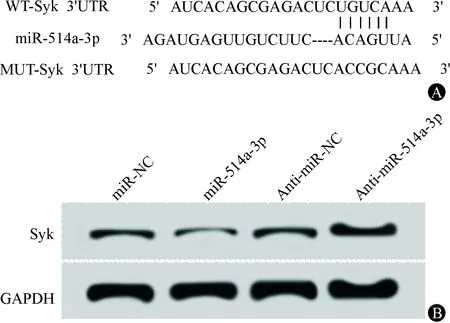
图3miR-514a-3p靶向、调控Syk A:Syk的3′UTR含有miR-514a-3p的互补序列;B:miR-514a-3p调控Syk的表达
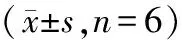
表4 双荧光素酶报告实验
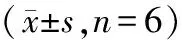
表5 miR-514a-3p调控Syk的表达
注:与miR-NC组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05
2.5 下调Syk表达能逆转抑制miR-514a-3p表达对胃癌细胞SGC-7901增殖、迁移、侵袭的作用
分别转染anti-miR-514a-3p与si-NC、si-Syk至SGC-7901细胞,Western Blot检测结果显示,与anti-miR-514a-3p+si-NC组比较,anti-miR-514a-3p+si-Syk组SGC-7901细胞中Syk蛋白表达水平显著降低(P<0.05),说明下调Syk表达能逆转抑制miR-514a-3p表达对Syk蛋白表达的促进作用。MTT和Transwell检测结果显示,与anti-miR-NC组比较,anti-miR-514a-3p组SGC-7901细胞分别培养24、48、72 h后OD值均显著升高(P<0.05),SGC-7901细胞迁移和侵袭数显著增加(P<0.05),说明下调Syk表达能逆转抑制miR-514a-3p表达对miR-514a-3p细胞活力、迁移和侵袭的抑制作用。Western blot检测结果(图4)显示,与anti-miR-NC组比较,anti-miR-514a-3p组SGC-7901细胞中Cyclin D1和MMP-2蛋白表达显著升高(P<0.05),P21和E-cadherin蛋白表达显著降低(P<0.05),见表6、7。
3 讨论
胃癌具有较高的发病率和致死率[10]。随着医学水平的进步,近年来胃癌的发病率和死亡率有所降低,但是患者预后仍然不理想[11]。多数胃癌患者的死亡是由于肿瘤的转移复发[12]。研究表明,miRNA可调控与细胞增殖、迁移和侵袭等生命过程相关的基因表达,参与肿瘤的发生和发展[13]。研究胃癌中异常表达的miRNA及其调控机制,可为胃癌的靶向治疗提供新靶标。

图4抑制Syk能逆转抑制miR-514a-3p表达对胃癌细胞SGC-7901增殖、迁移、侵袭蛋白表达的影响
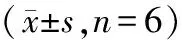
表6 抑制Syk能逆转抑制miR-514a-3p表达对胃癌细胞SGC-7901增殖的作用
注:与anti-miR-NC组比较,*P<0.05;与anti-miR-514a-3p+si-NC组比较,#P<0.05
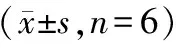
表7 抑制Syk能逆转抑制miR-514a-3p表达对胃癌细胞SGC-7901迁移、侵袭的作用
注:与anti-miR-NC组比较,*P<0.05;与anti-miR-514a-3p+si-NC组比较,#P<0.05
miR-514a-3p定位于chrXq27.3,在肾细胞癌[14]等多种肿瘤中表达异常,影响肿瘤细胞的生物学行为,参与肿瘤发生和发展过程。有报道称,发生淋巴结转移的胃癌患者癌组织中miR-514a-3p表达上调[15],但miR-514a-3p在胃癌细胞中的表达以及miR-514a-3p表达对胃癌细胞活力、迁移和侵袭的影响还未见报道。本研究首先采用qRT-PCR检测了胃癌细胞MGc-803和SGC-7901中miR-514a-3p表达水平,结果显示,胃癌细胞中miR-514a-3p呈高表达,提示miR-514a-3p可能作为促癌基因参与胃癌的发生和发展。通过siRNA干扰抑制SGC-7901细胞中miR-514a-3p表达,结果显示,抑制miR-514a-3p表达降低了SGC-7901细胞的活力、迁移和侵袭能力。Cyclin D1是一种原癌基因,当其表达异常升高时会引起细胞增殖失控[16]。P21是一种细胞周期依赖性激酶抑制因子,可抑制细胞增殖[17]。细胞间粘附作用和连接能力的降低,会导致肿瘤细胞脱落并转移到其他组织和器官。上皮间质转化是上皮细胞表型向间质细胞表型转变的过程,主要表现为细胞粘附分子表达减少等,肿瘤迁移与上皮间质转化密不可分[18]。上皮钙粘素(E-cadherin)是上皮的分子标志物,研究显示,其表达下调是上皮间质转化发生的重要特征[19]。基质金属蛋白酶是一类可降解细胞外基质和基底膜的酶,可促进肿瘤细胞的迁移和侵袭[20]。本研究显示,抑制miR-514a-3p表达可降低Cyclin D1和MMP-2蛋白表达,促进P21与E-cadherin蛋白表达,提示miR-514a-3p可能通过调控与细胞增殖、迁移和侵袭相关蛋白的表达影响胃癌细胞的活力、迁移和侵袭能力。研究显示,miR-514a-3p在肾细胞癌(RCC)组织和细胞中表达下调,上调miR-514a-3p表达可能通过EGFR/MAPK/ERK途径抑制RCC细胞的增殖、活力、迁移和侵袭,并负向调节与上皮-间质转化(EMT)相关的蛋白质的表达,miR-514a-3p作为抑癌基因参与肾细胞癌发生和发展[21]。这与本研究miR-514a-3p在胃癌细胞中高表达结果不一致,可能与肿瘤类型不同有关,表明miR-514a-3p在不同肿瘤中发挥的作用不同。
MiRNA常与靶mRNA的3′或5′ UTR区结合,抑制mRNA翻译或裂解mRNA,通过调控靶基因的表达参与肿瘤的发展进程。为了进一步了解miR-514a-3p影响胃癌细胞生物学行为的调控机制,采用生物信息学软件预测发现,Syk的3′UTR含有miR-514a-3p的互补序列,提示miR-514a-3p可能通过调控Syk表达影响胃癌细胞的活力、迁移和侵袭。本研究双荧光素酶报告基因结果证实miR-514a-3p可与Syk的3′UTR结合。并且上调miR-514a-3p表达可抑制SGC-7901细胞中Syk mRNA和蛋白表达,而下调miR-514a-3p表达促进了SGC-7901细胞中Syk mRNA和蛋白表达,进一步说明miR-514a-3p在SGC-7901细胞中靶向负调控Syk表达。
酪氨酸激酶是一组在信号传导通路中发挥重要作用的蛋白质。Syk是酪氨酸激酶家族中的成员之一,基因定位于染色体9q22,在造血细胞、淋巴细胞、血管内内皮细胞等细胞广泛表达。研究显示,Syk在乳腺癌、喉癌、宫颈癌等多种肿瘤中表达缺失或低表达,参与肿瘤细胞的恶性生物学行为,与肿瘤的发生和发展过程密切相关[22-24]。有报道称,胃癌组织中Syk阳性表达与患者肿瘤分化程度、淋巴结转移以及TNM分期密切相关,Syk表达缺失增强胃癌细胞的增殖、迁移和侵袭等恶性生物学行为[25]。还有研究显示,与Syk阴性表达的胃癌组织细胞相比,Syk阳性表达的胃癌组织细胞凋亡率明显升高,Syk通过诱导胃癌细胞凋亡抑制其生长和转移[26]。本研究结果显示,下调Syk表达可有效逆转miR-514a-3p表达对胃癌细胞活力、迁移和侵袭的抑制作用,提示miR-514a-3p靶向负调控Syk表达影响胃癌细胞的生物学行为,是胃癌治疗的潜在靶标。
综上所述,胃癌细胞中miR-514a-3高表达,抑制miR-514a-3表达可有效抑制胃癌细胞的活力、迁移和侵袭能力,其可能通过靶向下调Syk表达发挥作用,为胃癌的靶向治疗提供了新的作用靶点及一定的实验依据。
