重组L-谷氨酸氧化酶固定化细胞的制备
2019-11-05李力王亚平饶犇马立新
李力 王亚平 饶犇 马立新

摘要:为了提高表达L-谷氨酸氧化酶(LGOX)的重组大肠杆菌(pET-23a-lgox)的底物催化耐受性,尝试了对重组菌进行固定化的研究。结果表明,产LGOX的重组大肠杆菌工程菌种的最佳固定化条件为:海藻酸钠浓度2.5%,CaCl2溶液浓度13 g/L,pH 6.5,OD600 nm为14的工程菌与海藻酸钠的最佳体积比1∶40,此时得到的固定化工程菌机械强度最好。通过酶学性质比较发现,固定化的细胞与游离细胞在底物催化过程中相比,同等条件下前者温度耐受性、pH耐受性、使用频次等均高于后者。
关键词:固定化细胞;海藻酸钠;L-谷氨酸氧化酶
中图分类号:Q814.2 文献标识码:A
文章编号:0439-8114(2019)17-0132-04
DOI:10.14088/j.cnki.issn0439-8114.2019.17.035 开放科学(资源服务)标识码(OSID):
Abstract: In order to improve the substrate catalytic tolerance of recombinant E. coli(pET-23a-lgox) expressing L-glutamate oxidase(LGOX), this study attempted to study the immobilization of recombinant bacteria. The results showed that the best immobilization conditions were 2.5% sodium alginate, 13 g/L CaCl2 solution, pH 6.5, and the optimal volume ratio of engineering bacteria(OD600 nm=14) to sodium alginate was 1∶40. At this time, the mechanical strength of the stationary engineering bacteria was the best. Through the comparison of enzymatic properties, it was found that the immobilized cells were more tolerant than free cells in the substrate catalysis process. And under the same conditions, their temperature tolerance, pH tolerance, and the use of frequency were higher than free cells.
Key words: immobilized cells; sodium glginate; L-glutamate oxidase
细胞固定化技术是20世纪70年代发展起来的一种新技术,是一种类似于酶的固定化技术,但是又区别于酶的固定化技术的一种新型固定化技术。细胞被固定化以后,继续保持生命体征,在底物颗粒较小的情况下,能够保持全细胞催化特性[1,2],完成全细胞催化反应。固定化细胞在对底物催化过程中,对环境一般具有较高的耐受性。因此,能进行全细胞催化活性的重组细胞都可以尝试进行固定化研究,以期提高细胞的催化反应使用效率。固定化细胞又称固定化活细胞或者固定化增殖细胞,各种有功能的细胞都可以做成固定化细胞[3,4]。
固定化酶与固定化细胞的使用各有优缺点,在应用过程中善于取其优点,避其缺点方能将酶的功能发挥到极致。固定化酶的优点是催化反应较灵活,酶与底物可以接触,也很容易分离,可以反复使用,节约成本;缺点是对于一系列的酶促反应效率不高[5-9]。固定化细胞的优点是成本低,固定化细胞可以反复生长,反复使用,细胞与底物容易分开;缺点是固定化细胞只能针对低分子量底物进行反应,底物与反应集团接触效率较低[1-4]。
L-谷氨酸氧化酶(LGOX)是一种黄素蛋白酶类,具有黄素腺嘌呤核苷酸(FAD)结合区域,专一性很好,能特异性地催化底物L-谷氨酸,产生H2O2、氨和α-酮戊二酸,因在催化反应过程中产生H2O2,反应过程中的电子能够被H2O2电极捕获,所以常被用来制备传感器应用于临床检测、发酵生产、食品安全检测等各个方面[10-12]。本研究通过基因合成的方法合成了来源于加纳链霉菌(Streptomyces ghanaenis ATCC 14672)的L-谷氨酸氧化酶(LGOX)基因,将该基因克隆在大肠杆菌表达载体(pET23a)上[13]。测序正确的大肠杆菌表达载体通过常规转化进入大肠杆菌表达菌种BL21(DE3),IPTG诱导后获得具有活性的LGOX,通过对该重组菌进行底物催化反应分析发现,该酶可以实现全细胞底物催化反应。该工程菌具备了制备固定化工程菌的条件,为此,本试验尝试了将该工程菌固定化,工艺条件为模式固定化,以期为该工程菌的大规模工业生产奠定基础。
1 材料与方法
1.1 材料
L-谷氨酸:购自西格玛奥德里奇(上海)贸易有限公司;酵母提取物:购自英国Oxoid在中国的代理公司;Tryptone和蛋白胨:购自上海金畔生物科技有限公司代理(英国Oxoid);YNB:购自上海金畔生物科技有限公司;N,N-二甲基苯胺、过氧化氢酶和4-氨基比林:购自西格玛奥德里奇有限公司;葡萄糖、tris-base、KH2P04、NaOH、KCl等:購自上海国药集团化学试剂有限公司。质粒抽提试剂盒、琼脂糖凝胶回收试剂盒等常用的试剂盒购自天根生化科技有限公司;海藻酸钠、戊二醛、氯化钙等化学试剂购自潍坊玉鼎化工有限公司;其他常用的试剂耗材购买于武汉市汉阳区贝创科瑞生物试剂经营部。
1.2 仪器设备
各种电泳设备购自北京六一生物科技有限公司;各种型号离心机购自Eppendorf公司;移液器购自Eppendorf、Ruining、吉尔森等各公司;温控摇床等常用的微生物学设备购自北京兰贝石恒温技术有限公司;无菌操作台购自江苏苏净集团有限公司;超纯水仪购自密理博生物器材厂;磁力搅拌器购自武汉市洪山区中心科创实验器材经营部;其他小型设备购自国内各种仪器设备公司。
1.3 大肠杆菌发酵液的制备方法
将重组大肠杆菌的种子液按1%的比例接种于发酵培养基中,37 ℃条件下,140 r/min摇菌约2 h;当种子培养基培养到OD600 nm为0.6~0.8时,加入终浓度为0.8%的乳糖,28 ℃下诱导12 h;4 ℃,12 000 r/min下离心2 min,倒掉上清液;用缓冲液重悬菌体备用。
1.4 固定化细胞的制备方法
取OD600 nm≈14的菌体与2.5%的海藻酸钠(V/V≈1/5),在磁力搅拌器上充分混匀;吸取混合液,5~10 cm高处将混合液滴入13 g/L的CaCl2溶液中,形成光洁的小球微粒;将小球微粒置于13 g/L的CaCl2溶液中,4 ℃静置3 h;过滤取出小球,用生理盐水储存,4 ℃静置备用。
1.5 固定化细胞酶活的测定方法
取固定化细胞适量,与11 mg/mL的L-谷氨酸500 μL,60 U/mL辣根过氧化物10 μL,0.261 μg/mL N,N-二甲基苯胺140 μL,0.122 μg/mL 4-氨基安替比林100 μL,在对应酶的最适反应条件下在磁力搅拌器上反应0.5 h,过滤掉小球,取上清[13]。冷却至常温于550 nm测吸光值。
酶活计算按照如下公式:L-谷氨酸氧化酶活力(U/g)=A550 nm/14.3×3.1/0.1×1/20×稀释倍数,其中,14.3为提取常数,3.1为反应总体积(mL),20为反应时间(min)。L-谷氨酸氧化酶定义为,在酶的最适催化反应条件下,每分钟释放1 μmol的H2O2所需要的LGOX的酶量为即为1 U的酶活。来测定固定化细胞的酶活。
2 结果与分析
2.1 固定化条件分析
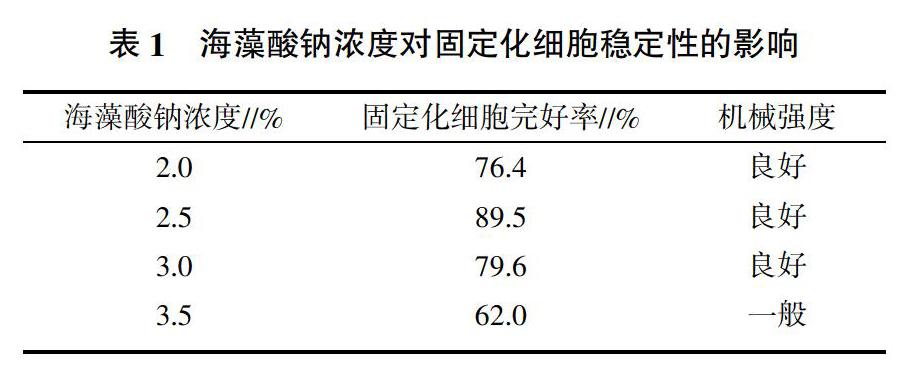
2.1.1 海藻酸钠浓度对固定化小球稳定性的影响 取湿重为1 g的重组大肠杆菌与不同浓度的海藻酸钠溶液包埋,制备固定化细胞,反应6 h后肉眼观察计算固定化小球的完好率,结果见表1。由表1可见,当海藻酸钠的浓度为2.5%时,固定化细胞反应6 h后,固定化小球完好率最高,固定化细胞的稳定性更好。说明本工程菌种中的特有离子对于海藻酸钠不可逆的凝结,在海藻酸钠的浓度为2.5%的时候达到最好的状态。
2.1.2 CaCl2浓度对固定化小球稳定性的影响 海藻酸钠包埋工程菌主要依赖于Ca2+作为中间的连接,使得海藻酸钠形成有镂空的颗粒,从而包埋工程菌,因此CaCl2的浓度和凝结时间是海藻酸钠作为包埋剂的主要因素。
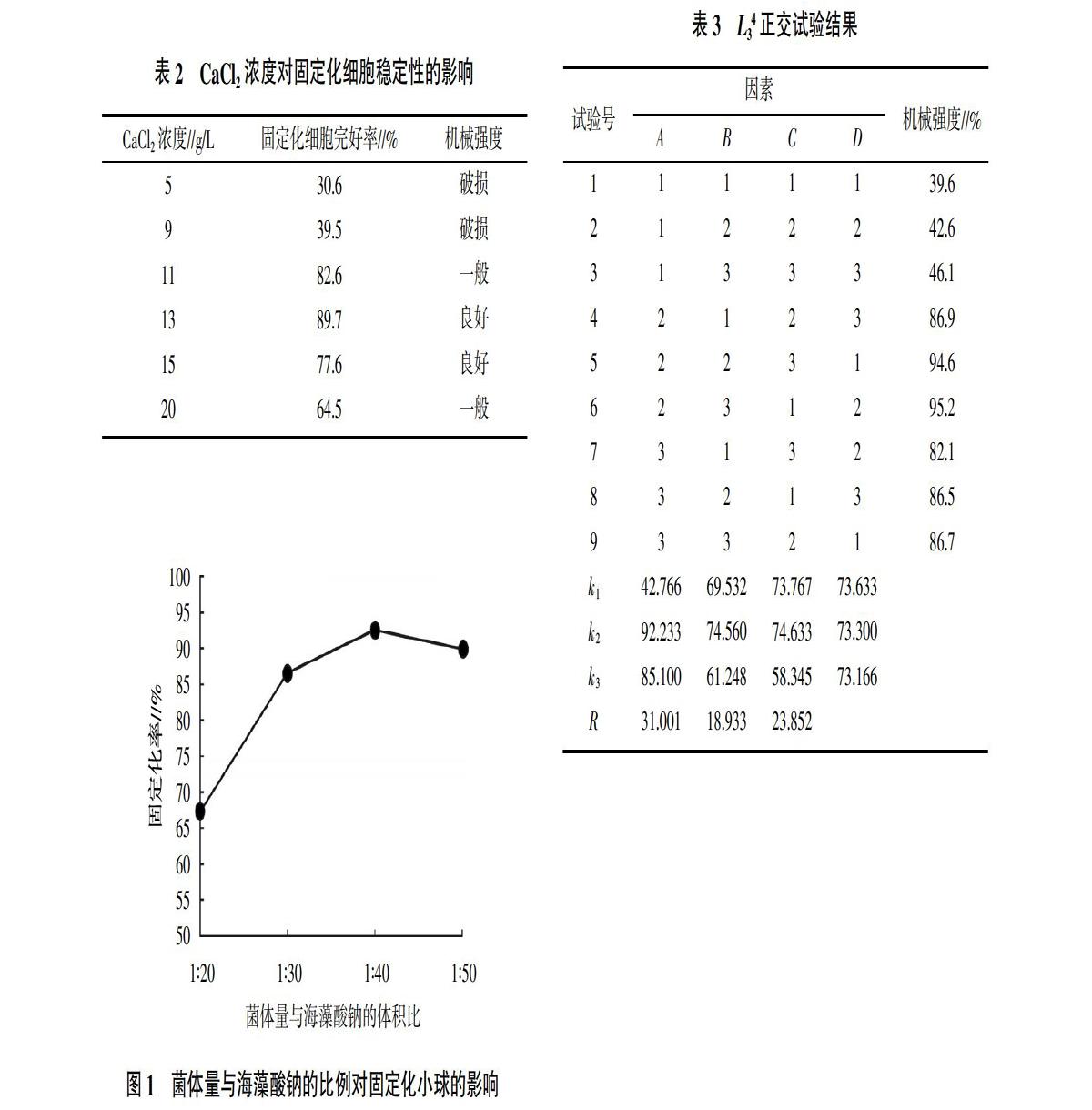
通过不同浓度的CaCl2检测固定化细胞的储备液环境对固定化细胞稳定性的影响。将固定化的细胞置于不同浓度的CaCl2溶液中,反应12 h后,肉眼观察并计算固定化细胞的完好率,判断CaCl2浓度对固定化细胞稳定性的影响,结果如表2所示。结果表明,当CaCl2浓度为13 g/L时,小球的稳定性最好。说明对于本工程菌而言,当CaCl2浓度大于11 g/L时凝集效率最好,得到的固定化小球机械强度最大。
2.1.3 菌液与海藻酸钠体积比对小球稳定性的影响 取2.5%的海藻酸钠与不同体积比的OD600 nm=14的重组大肠杆菌菌体进行包埋,制备固定化细胞,并在13 g/L的CaCl2储备6 h后,测定固定化小球稳定性,结果见图1。通过肉眼观察计算小球稳定性,发现菌体与海藻酸钠体积比在1∶40的时候,能够更大程度地固定重组细胞,提高细胞的固定化效率。从以上的结果可以看出,当菌体与海藻酸钠的体积比为1∶40时,固定化小球的稳定性良好,对于重组菌进行固定化细胞酶促反应最有利。
2.1.4 正交试验设计及结果 根据单因素试验,设计单因素A海藻酸钠浓度(2.0%、2.5%、3.0%)、B氯化钙浓度(9、13、17 g/L)、C菌体(注:菌体OD600 nm=14)与海藻酸钠体积比(1∶30、1∶40、1∶50)、D固定化时间(4、8、12 h)进行4因素3水平的正交试验,试验指标为固定化小球的机械强度,筛选最佳固定化工艺条件[14,15],具体见表3。方差分析结果表明,在一定范围内,固定化的时间对小球稳定性的影响并不是很大,但是在一定范围内,海藻酸钠的浓度和CaCl2的浓度对小球的稳定性具有交互影响,从方差试验结果中可以推断出,产LGOX重组菌的最佳固定化条件是海藻酸钠浓度2.5%,CaCl2浓度13 g/L,菌体负载量1∶40,固定化时间4 h为宜。
2.2 固定化细胞与全细胞酶促反应比较
参照测L-谷氨酸氧化酶酶学性质的方法,比较全细胞与固定化细胞在酶催化反应中的酶学性质,利用全细胞或者固定化细胞与11 mg/mL的L-谷氨酸作为底物,反应0.5 h后,4 ℃条件下,6 000 r/min离心5 min,按照L-谷氨酸氧化酶活性的测定方法,测定两种酶的最适反应温度和最适反應pH,得到结果见图2。测试结果表明,全细胞和固定化细胞在底物催化过程中,最适反应pH都在6.5左右,只是固定化细胞的适应pH要比全细胞广泛,pH 5.5~7.5都能保持较高(80%以上)的相对酶活(图2A);从图2B中可以看出,固定化后的细胞在反应过程中温度耐受性也有所提高。
2.3 固定化细胞使用频次分析
对表达LGOX的重组大肠杆菌进行诱导表达,达到诱导表达的最高酶活后,对细胞进行固定化,对固定化的细胞进行使用频次研究,每次使用固定化细胞在最适条件下催化0.5 h后,过滤收集,直到使用相应的次数,催化11 mg/mL的L-谷氨酸(盐)的底物,并测定酶活,绘制曲线图见图3。结果表明,固定化细胞的使用要比全细胞在酶催化的过程中有更好的耐受性。细胞在固定化之后,使用50次以后还能保持80%左右的相对酶活。推测可能原因是全细胞在酶催化的过程中更容易受到催化反应体系的高渗透压的破坏,耐受性比固定化细胞的耐受性差。
3 小结
通过固定化细胞和全细胞的酶学性质分析比较发现,固定化表达L-谷氨酸氧化酶的大肠杆菌,固定化细胞的pH和温度适应性比全细胞更加广泛,固定化细胞比全细胞直接反应表现出相对较好的温度耐受性和pH耐受性。
通过对固定化细胞的使用频次研究发现,固定化细胞比全细胞反应使用频次更多,含有酶的固定化细胞酶活稳定性更好,温度耐受性相对较好。细胞的固定化为L-谷氨酸氧化酶的工业化应用奠定了基础。固定化表达L-氨基酸氧化酶的细胞成功对底物L-谷氨酸进行催化反应,也为利用L-氨基酸氧化酶制备生物传感器在食品行业、医药行业、临床诊断方面的应用提供了新思路。
参考文献:
[1] KYEONG J S,YEOM S H. Preparation of immobilized whole cell biocatalyst and biodiesel production using a packed-bed bioreactor[J].Bioprocess Biosyst Eng,2014,37(11):2189-2198.
[2] CHEN J P,LIN G H. Optimization of biodiesel production catalyzed by fungus cells immobilized in fibrous supports[J].Appl Biochem Biotechnol,2010,161(1-8):181-194.
[3] 孙 婷,杜 伟,刘德华,等.固定化全细胞催化可再生油脂合成生物柴油的稳定性[J].生物工程学报,2009,25(9):1379-1385.
[4] BAN K,KAIEDA M. Whole cell biocatalyst for biodiesel fuel production utilizing Rhizopus oryzae cells immobilized within biomass support particles[J].Biochem Eng J,2001,8(1):39-43.
[5] 刘秀伟,司 芳.酶固定化研究进展[J].化工技术经济,2003, 21(4):12-16.
[6] 许松伟,张 杰,杨占平,等.载体对包埋酶微环境的影响分析[J].化学进展,2008,20(1):163-170.
[7] 蒋挺大.甲壳素和壳聚糖作为酶和细胞的固定化载体的研究进展[J].工业微生物,1998,28(3):32-37.
[8] ROGER A,SHELDON. Enzyme immobilization:The quest for optimum performance[J].Reviews,2007,10(1002):1289-1307.
[9] SERIKOV V S,LIASHEV I D. The influence of melatonin on the content of lipid peroxidation metabolites and antioxidant enzyme activity in the liver of rats after immobilization[J].Ross Fiziol Zh Im I M Sechenova,2014,100(4):458-464.
[10] ARIMA J,TAMURA T,KUSAKABE H,et al. Recombinant expression,biochemical characterization and stabilizationthrough proteolysis of an l-glutamate oxidase from Streptomyces sp. X-119-6[J].J Biochem,2003,134:805-812.
[11] WACHIRATIANCHAI S,BHUMIRATANA A,UDOMSOPAGIT S. Isolation,purification and characterization of l-glutamate oxidase from Streptomyces sp. 18G[M].Electron J Biotech,2004,7(3):9-10.
[12] 李青山,李曉波,李友荣,等.用静息细胞培养法研究L-谷氨酸氧化酶的生物合成[J].华东理工大学学报,1994,20(2):168-172.
[13] YAPING W, BEN R,HONG Y,et al. High-level expression of l-glutamate oxidase in Pichia pastoris using multi-copy expression strains and high cell density cultivation[J].Protein expression and purification,2017,129:108-114.
[14] 张 飞,刘 寅,魏 涛,等.缬氨酸转氨酶固定化细胞的制备[J].中国调味品,2014,39(8):9-15
[15] 韩振为,言海燕.海藻酸钠-硅藻土包埋石油脱硫菌Rhodococcus sp. H-412[J].化学工业与工程,2006,23(6):520-522.
