天然矿物对重金属Pb2+的吸附性能研究
2019-11-05程婷陈晨张晓刘海霞吕瑞阳
程婷 陈晨 张晓 刘海霞 吕瑞阳


摘要:利用天然矿物吸附重金属Pb2+,研究吸附剂量、pH、反应时间对吸附效果的影响,对其吸附过程进行吸附等温线和吸附动力学拟合。结果表明,随着吸附剂量的不断提高,初始浓度为50 mg/L与100 mg/L的重金属Pb2+的吸附去除率均不断提高,而其饱和吸附量逐渐下降,天然矿物对重金属Pb2+的最大饱和吸附量为87.67 mg/g。酸性条件下天然矿物对重金属Pb2+的吸附效果较低,而偏酸性环境吸附处理效果较好。天然矿物对Pb2+的吸附去除率随反应时间的增加而不断增加。天然矿物对Pb2+的吸附过程符合Freundlich吸附等温模型,且Pb2+的吸附过程拟合结果更加符合准二级动力学模型。
关键词:重金属Pb2+;天然矿物;吸附性能
中图分类号:X52 文献标识码:A
文章编号:0439-8114(2019)17-0056-04
DOI:10.14088/j.cnki.issn0439-8114.2019.17.014 开放科学(资源服务)标识码(OSID):
Abstract: The experiment was conducted to examine the adsorption of Pb2+ on the natural mineral. The adsorbent dosage, pH and the reaction time was investigated, and the adsorption isotherm and kinetics equation in the adsorption process was discussed. The results showed that, with the increasing of the adsorbent dosage, the removal rate of Pb2+ on the natural mineral was improved at the concentration of 50 mg/L and 100 mg/L gradually, while the saturated adsorption capacity was decreased. The maximum saturated adsorption capacity of natural minerals for heavy metal Pb2+ was 87.67 mg/g. The adsorption of heavy metals Pb2+ by natural minerals at acidic condition was relatively lower, while the adsorption treatment effect of slightly acidic environment was better. The removal rate of Pb2+ increased gradually with the increased of reaction time. The adsorption process of Pb2+ accorded with Freundlich adsorption isotherm. Furthermore, the reaction of adsorption on natural mineral to Pb2+ matched to the pseudo-second class reaction kinetics model.
Key words: heavy metal Pb2+; natural mineral; adsorption property
近年來,随着化工、冶金、电子电镀等行业的发展,越来越多的重金属废水被排放到环境中,其在自然环境和人体中累积、转化,对生态环境与人体健康造成了严重威胁。重金属污染及其相应的重金属废水的污染处理问题一直是国内外学者关注的热点之一[1-3]。铅是一种常见的有毒金属,铅污染主要来自铅和锌矿的开采、含铅汽油的炼制及使用电缆、电池、涂料、电镀矿企业的生产废水。在重金属污染的处理技术中,吸附是一种较为常见且有效的处理方法,其对重金属的去除取得了较好的效果[4-6]。本研究利用天然矿物对重金属Pb2+进行吸附,考察了不同影响因素条件下天然矿物对重金属Pb2+的吸附效果,并对其吸附等温线与吸附动力学进行了探讨。
1 材料与方法
1.1 试验材料
天然矿物主要化学组成(氧化物形式)为SiO2(65.82%)、Al2O3(13.39%)、K2O(2.21%)、CaO(1.72%)、Fe2O3(1.65%)、MgO(1.16%)。
试验所用主要仪器有气浴恒温摇床(THZ-92B)、pH酸度计(PHS-3C)、原子吸收光谱仪(AA240DUO)等。
1.2 试验方法
1.2.1 试验步骤 在10 mL干燥的具塞聚丙烯管中加入一定量的天然矿物,移取一定浓度的重金属Pb2+溶液,用稀HCl和NaOH溶液调节吸附体系的初始pH,置于气浴恒温摇床中设定一定的反应温度,以150 r/min振荡进行吸附反应。吸附反应完成后取混合液过滤(0.45 μm水系滤膜),在原子吸收光谱仪上测定吸附后残余的重金属Pb2+浓度。
1.2.2 分析方法 原子吸收光谱仪分析吸附后溶液中的重金属Pb2+浓度。吸附容量的计算公式:
式中,Qe为吸附容量(mg/g),C0为金属离子初始浓度(mg/L),Ce为金属离子吸附平衡浓度(mg/L),V为溶液体积 (mL),m为吸附剂用量(g)。
2 结果与分析
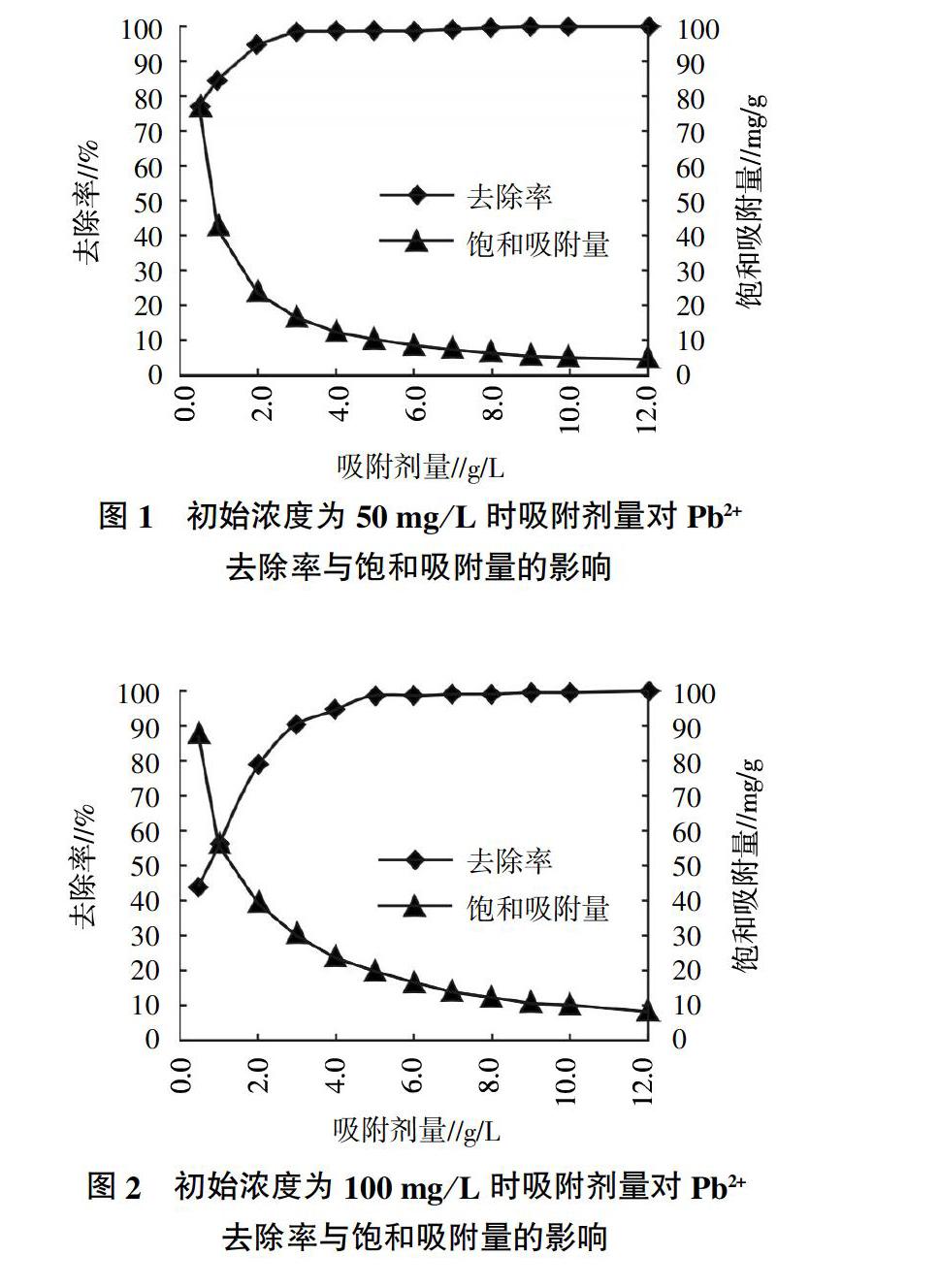
2.1 吸附剂量对Pb2+去除率与饱和吸附量的影响
不同初始浓度时吸附剂量对天然矿物吸附重金属Pb2+的去除率和饱和吸附量的影响如图1与图2所示,Pb2+的初始浓度分别为50 mg/L与100 mg/L,吸附剂量为0.5~12.0 g/L,吸附反应时间为12 h,反应温度35 ℃,吸附体系的初始pH为6。由图1与图2可知,随着吸附剂量的增加,天然矿物对Pb2+的吸附去除率不断提高,而其饱和吸附量逐渐降低。
当重金属Pb2+的初始浓度为50 mg/L、吸附剂量为0.5 g/L时,天然矿物对Pb2+的吸附去除率仅为77.15%,其饱和吸附量高达77.15 mg/g;吸附剂量提高到2.0 g/L时,Pb2+的吸附去除率提高到94.85%,相应的饱和吸附量降低为23.71 mg/g;吸附剂量进一步提高到3.0 g/L时,重金属Pb2+的吸附去除率高达98.33%,其对应的饱和吸附量降为16.39 mg/g;之后继续提高吸附剂量,污染物的去除率趋于饱和,饱和吸附量继续下降。
当重金属Pb2+的初始浓度为100 mg/L、吸附剂量为0.5 g/L时,天然矿物对Pb2+的吸附去除率仅为43.83%,其饱和吸附量高达87.67 mg/g;吸附剂量提高到2.0 g/L时,Pb2+的吸附去除率提高到79.17%,相应的饱和吸附量降低为39.58 mg/g;吸附剂量进一步提高到4.0 g/L时,Pb2+的吸附去除率提高到94.63%,相應的饱和吸附量降低为23.66 mg/g;之后继续提高吸附剂量,天然矿物对重金属Pb2+的吸附趋于饱和。随着溶液中吸附剂量的不断增加,其与水体中污染物的接触面积不断增加,降低了吸附剂的利用率,这与相关研究得到的结论相似[7]。
2.2 初始pH对Pb2+去除率与饱和吸附量的影响
初始pH对天然矿物吸附重金属Pb2+的去除率影响如图3所示,Pb2+的初始浓度为100 mg/L,反应温度为35 ℃,吸附剂投加量为4.0 g/L,pH为2~9。由图3可知,pH对天然矿物吸附Pb2+的去除效果影响较大,随着初始pH的不断提高,天然矿物对重金属Pb2+的吸附去除率不断增加。初始pH为酸性环境时,天然矿物对重金属Pb2+的去除效果较差。当初始pH为2时,Pb2+的吸附去除率仅为23.08%;初始pH为3时,Pb2+的吸附去除率为47.69%;当初始pH升高到4时,Pb2+的吸附去除率提高到64.62%;初始pH提高到弱酸性环境时,天然矿物对重金属Pb2+的吸附去除率快速提高,初始pH为5和6时,Pb2+的吸附去除率分别提高到81.73%和94.54%;而当初始pH提高到中性和偏碱性环境时,天然矿物对重金属Pb2+的吸附去除率几乎为100%。推测本试验中酸性环境下溶液中H+占据了天然矿物吸附剂的位置,而pH过高时,OH-离子极易与水体中的重金属离子发生沉淀,故后续吸附试验采用pH为偏酸性环境。
2.3 反应时间对Pb2+去除率与饱和吸附量的影响
反应时间是影响吸附反应效果与吸附特性的一个重要因素。考察了不同吸附反应时间对天然矿物吸附Pb2+的效果影响,结果如图4所示,其中反应温度为35 ℃,吸附剂量为4.0 g/L,Pb2+的初始浓度为100 mg/L,初始pH为6。由图4可知,天然矿物对Pb2+的吸附去除率随着反应时间的增加而不断提高。反应时间为15 min时,天然矿物对重金属Pb2+的吸附去除率为45.56%;反应时间提高到1 h时,Pb2+的吸附去除率提高到了70.34%;反应时间进一步提高为2 h时Pb2+的吸附去除率进一步提高到81.39%;反应时间提高到4 h时天然矿物对重金属Pb2+的吸附去除率进一步增加到96.20%。
2.4 吸附等温线
对于单一组分溶质,常见的吸附等温线为Langmuir等温吸附模型与Freundlich等温吸附模型[8,9]。根据图1与图2(不同初始浓度时吸附剂量对Pb2+去除率与饱和吸附量的影响)的试验结果,利用Langmuir吸附等温式和Freundlich吸附等温式对天然矿物吸附Pb2+的试验数据进行拟合, 其结果如图5—图8以及表1所示。结果表明,与Langmuir吸附等温式的拟合结果相比,天然矿物对Pb2+的吸附过程更加符合Freundlich吸附等温模型,其相关程度更好。
2.5 吸附动力学
对于一般的固液吸附过程而言,通常采用准一级和准二级动力学方程来进行动力学拟合[8,9]。利用准一级动力学方程与准二级动力学方程对天然矿物吸附Pb2+的过程进行拟合,其结果如图9、图10与表2所示。结果显示,准一级动力学方程对天然矿物吸附重金属Pb2+的拟合R2为0.987 3,Qe,cal为17.96 mg/g,而准二级动力学方程对天然矿物吸附重金属Pb2+的过程拟合R2为0.998 8,其Qe,cal为26.81 mg/g,更加接近试验值25.0 mg/g。因此,Pb2+在天然矿物上的吸附过程更加符合准二级动力学模型。
3 结论
吸附剂量、pH、反应时间均对天然矿物吸附重金属Pb2+的去除率影响较大。Pb2+初始浓度为50 mg/L与100 mg/L时,随着天然矿物投加量的不断提高,重金属Pb2+的吸附去除率不断提高,而饱和吸附量逐渐下降。初始浓度为100 mg/L时,天然矿物对重金属Pb2+的最大饱和吸附量为87.67 mg/g。酸性条件下天然矿物对重金属Pb2+的吸附效果较差,而偏酸性环境吸附效果较好。初始pH为6时,重金属Pb2+的吸附去除率高达94.54%。天然矿物对Pb2+的吸附去除率随着反应时间的增加而不断提高。与Langmuir吸附等温模型的拟合结果相比,天然矿物对Pb2+的吸附过程更符合Freundlich吸附等温模型。此外,Pb2+在天然矿物上吸附过程拟合结果更加符合准二级动力学模型。
参考文献:
[1] 张 蕊,葛 滢.稻壳基活性炭制备及其对重金属吸附研究[J].环境污染与防治,2011,33(2):41-45,51.
[2] WEI Q,YING Z. Removal of lead,copper,nickel,cobalt, and zinc from water by a cancrinite-type zeolite synthesized from fly ash[J].Chemical engineering journal,2009,145(3):483-488.
[3] 范春暉,张颖超.粉煤灰基沸石对亚甲基蓝和Cr(Ⅲ)的共吸附行为——Ⅰ.吸附动力学和吸附热力学[J].环境工程学报,2012, 6(11):3923-3927.
[4] 程 婷,袁 昌,藏奕奕,等.吸附剂量对合成沸石吸附混合重金属的竞争效果[J].粉煤灰综合利用,2015(3):3-5.
[5] 崔杏雨,陈树伟,闫晓亮,等.粉煤灰合成Na-X沸石去除废水中镍离子的研究[J].燃料化学学报,2009,37(6):752-756.
[6] 饶品华,张文启,李永峰,等.氧化铝对水体中重金属离子吸附去除研究[J].水处理技术,2009,35(12):71-74.
[7] 程 婷,陈 晨,韩承辉,等.Linde type F(K)沸石对Ni2+的吸附性能及效果[J]. 湖北农业科学,2014,53(8):1765-1768.
[8] CHEN C,CHENG T,WANG Z L,et al. Removal of Zn2+ in aqueous solution by Linde F(K) zeolite prepared from recycled fly ash[J].Journal of the Indian chemical society,2014,91(2):285-291.
[9] 程 婷,陈 晨,谢伟芳,等.改性沸石对Cr(VI)与F-的竞争吸附性能研究[J].湖北农业科学,2015,54(17):4138-4142.
收稿日期:2019-01-14
基金项目:2016江苏高校“青蓝工程”中青年学术带头人培养对象项目;国家自然科学基金项目(21407068);江苏省科技计划项目(江苏省
