有机过氧化物的稳定性研究进展
2019-11-05唐小华惠菲查飞吴思宇周友三
唐小华,惠菲,查飞,吴思宇,周友三
(1.西北师范大学 化学化工学院,甘肃 兰州 730070;2.兰州助剂厂有限责任公司,甘肃 兰州 730079)
有机过氧化物是H2O2中一个或两个H被有机官能团取代后的产物,通式为R—O—O—R1,依据所含官能团可分为过氧化羧酸、烷基过氧化物、过氧化酮、酯类过氧化物、酰类过氧化物[1]。有机过氧化物在高分子材料领域中应用较广,主要用作高分子化合物单体引发剂、高分子化合物交联剂以及降解剂,是制备高分子材料的关键性原料。由于分子中含有 —O—O—键,具有不稳定性和强氧化性,在遇热、撞击、摩擦,或在掺杂酸、碱、金属、橡胶等情况下,都易分解。近年来,由有机过氧化物引发的事故见表1,如何降低有机过氧化物安全性危害一直是安全领域的研究重点[2],因而对有机过氧化物的稳定性研究显得尤为重要。

表1 近年来有机过氧化物的热爆炸事故Table 1 Thermal explosion accident of organic peroxide in recent years
注:“-”表示未知。
1 有机过氧化物的热分解
1.1 热分解机理
有机过氧化物中的 —O—O—键长而弱,极不稳定,遇热易分解,随温度升高,热分解加剧。研究表明,在特定的温度下,有机过氧化物热分解发生自由基的连锁反应。过氧化氢异丙苯的热分解机理见图1[3],反应进程为:有机过氧化物→自由基→分解产物+热量[4]。反应释放大量热,若热量不能及时移走,反应温度急剧上升,反应速率加快将引发爆炸。
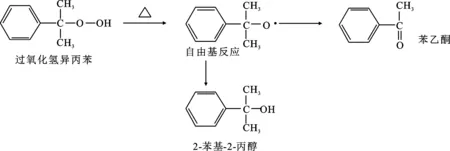
图1 过氧化氢异丙苯的热分解机理Fig.1 Thermal decomposition mechanism of cumene hydroperoxide
1.2 热分解的研究方法
有机过氧化物热分解的研究方法主要通过检测有机过氧化物放热反应,收集放热参数来进行热动力学分析,还可运用预测法对有机过氧化物建立预测模型。
1.2.1 定量性质-结构相关性(QSPR)法 QSPR研究方法是依据化合物性能与分子结构密切相关原理,通过理论计算结合统计学方法,建立有机化合物的物理化学性质与其结构之间的定量关系。研究的基本步骤包括:数据的获取和整理,分子结构的构建、优化,分子结构描述符的计算、选取,预测模型的建立和评价[5]。
QSPR模型可模拟特殊类别物质的危险特性,如含能材料的撞击和爆炸极限、活性化学物质的自反应危险性预测等,该方法可弥补实验研究的一些不足,因而受到学者的广泛关注及应用。依据定量结构-性质相关性的原理,结合有机过氧化物的分子结构与其热分解的内在联系,选择合适的预测模拟模型进行参数预测,常用的建立模型的方法有多元线性回归(MLR)[6]、主成分回归法(PCR)[7]、人工神经网络法(ANN)[8]、偏最小二乘法(PLS)、支持向量机法(SVM)[9]、最小二乘支持向量机(LS-SVM)[10]以及投影寻踪回归(PPR)等,在有机过氧化物研究领域中,MLR和SVM模型应用最多[11],主要用来预测有机过氧化物的自加速分解温度(SADT)。
吕志果[12]、潘勇等[13]采用QSPR方法,分别建立PLS与GA-MLR(遗传-多元线性回归模型)预测有机过氧化物的SADT,研究显示,两种模型在SADT的预测方面均具有较好的稳定性及预测能力。游波[14]对比研究了MLR、PLS、SVM模型对有机过氧化物参数起始分解温度T0和分解热ΔH的预测能力,结果表明,模型预测精度顺序依次为SVM>PLS>MLR,同时证明同种模型的预测精度与影响参数的因子个数有关,因子个数越少越精确。马继涛[15]通过有机过氧化物分子描述符(46种),建立了最佳多元线性回归(B-MLR)和SVM模型,同时运用Williams图,对模型的应用域进行分析,研究表明,两种预测模型都可应用于有机过氧化物的SADT预测。
1.2.2 热分析动力学法 热分析是借助热分析仪器,获取实验数据,结合相关理论对有机过氧化物的热分解进行动力学和热力学计算,获得反应级数n、活化能Ea和指前因子A等反应动力学参数,由此判定其热稳定性及危险性。
动力学研究比较多,已有多种热分析动力学处理方法。目前热分析方法还有等温法和不等温法,不等温法按动力学方程形式分为微分法和积分法,其基本形式一般是基于Arrhenius方程计算;按加热速率方式可分为单个扫描速率法和多重扫描速率法(等转化率法)。在这些方法中,有机过氧化物的Ea、A值计算常采用等转化率法[16],这归因于等转化率法的推算不涉及多种假设,完全基于实验数据,可信度高。常用的等转化率法有Friedman法、Ozawa法和Kissinger法等。
薛岩[17]采用Friedman法得到过氧化苯甲酸叔丁酯(tert-butyl peroxide benzoate,简称TBPB)的Ea及A随转化率的曲线,并得出Ea的范围为42~135.5 kJ/mol,A的范围为0.25~33.5。黄艳军等[18]采用Friedman等转化率法求得过氧化氢异丙苯(cumene hydroperoxide,简称CHP)在不同温升速率下的Ea值,并得出在分解过程中,Ea介于52~91 kJ/mol之间。
田映韬[19]通过Friedman法、Ozawa法、ASTM E698方法对4种不同浓度的MEKP及纯品MEKP、TBPB、2,5-二甲基-2,5-二(叔丁基过氧基)乙烷[2,5-dimethyl-2,5-di(tert-butylperoxy)hexane,简称DHBP]的差示扫描量热仪(DSC)数据进行动力学分析,结果表明,3种方法所得4种不同浓度的MEKP的Ea取值基本一致,用3种方法计算3种纯品过氧化物的Ea值大小顺序为DHBP>TBPB>MEKP。方将来[20]在探究不同杂质对过氧化苯甲酰(benzoyl peroxide,简称BPO)的热分解影响时,采用Kissinger法与Ozawa法计算纯BPO的Ea值相似分别为213.88,209.42 kJ/mol,通过加和平均得出纯BPO的Ea值,同理求出混合杂质时BPO的Ea值。
2 催化分解
2.1 金属分解
锰、铁、铜等金属化合物在常温下对有机过氧化物都具有较强的催化分解作用,特别是变价的过渡重金属离子。羧酸过氧化物在金属存在下的分解历程见图2[21],从羧酸的分解反应能够看出,分解生成了活泼自由基,自由基又进一步促进反应。在整个分解过程中,金属离子只发生价态的互相转变,自身却不会消耗,因此只需存在微量金属离子,就会加速羧酸过氧化物的分解。
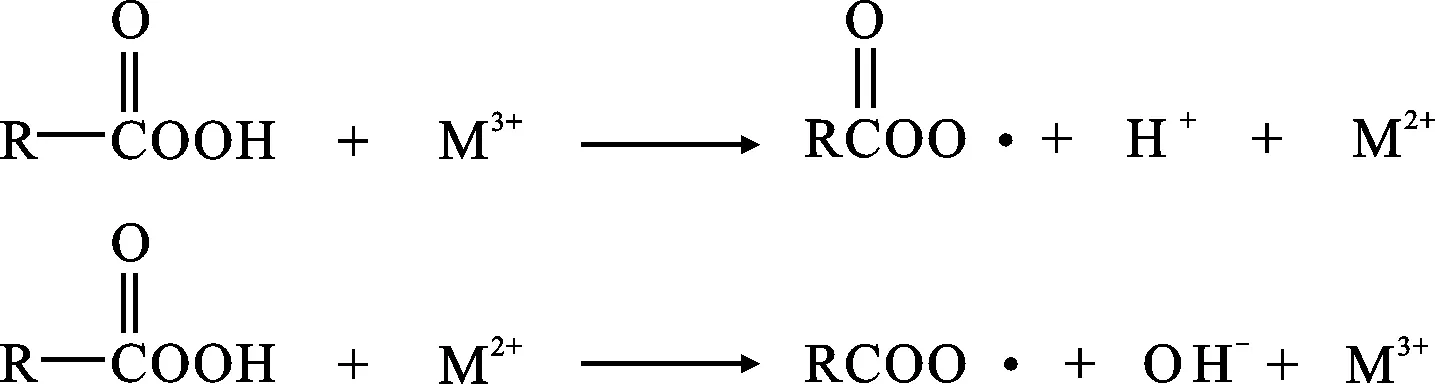
图2 羧酸过氧化物的金属分解机理Fig.2 Metal decomposition mechanism of carboxylic acid peroxide
Uchida等[22]首先用DSC研究了9种有机过氧化物分别在玻璃样品池、不锈钢样品池和镀金样品池的热分解反应,结果显示镀金样品池对氢过氧化物的分解具有显著的影响,在此基础上该团队采用C80微量量热仪检测分析了CHP、CHP与Au、CHP与Au2O3的等温反应曲线,由放热曲线可以明显的看出,CHP与Au2O3在反应一开始就有极强的放热峰出现,说明Au3+催化分解作用强烈,同时色谱结果显示,不同金属催化分解产物不同。
Ron-Hsin Chang等[23]则研究了FeSO4、FeCl3对MEKPO热稳定性的影响,DSC和泄放面积组合仪(VSP2)数据分析可知,MEKPO与氯化铁、亚硫酸铁混合,起始放热温度均降低,放热曲线均出现两个明显的放热峰,表明铁离子能促进MEKPO的分解,反应过程复杂。Wei Meng[24]使用自动压力跟踪绝热量热计(APTAC)检测了不同浓度的Fe2O3对MEKPO的量热分析,结果显示,在低浓度下(<0.3%),MEKPO稳定性受Fe2O3的影响不大,然而,在中高浓度范围(即10%)下,MEKPO的热稳定性明显下降。
Mei-Li You等[25]使用DSC研究了80% CHP与ZnBa2、CuBa2、FeBa2混合的热分解反应,研究表明,加入金属化合物,CHP的分解热没有明显变化,但T0由105 ℃分别降低到95,75,74 ℃,Cu2+、Fe2+对CHP的稳定性影响较大;采用TAM III研究CHP分别在80,90,100,110 ℃等温条件下与金属化合物混合的反应,研究表明,在任何等温条件下,CHP与FeBa2混合达到最大速率时间(TMRios)最短,时间在0.34~0.43 h之间,与ZnBa2的混合,在100,110 ℃时的TMRios分别为0.42,0.41 h。
2.2 酸碱分解
酸和碱都可加速有机过氧化物的分解,尤其是强酸强碱,原因是强碱释放的氢氧根离子和强酸释放的氢离子会攻击有机过氧化物的过氧键(O—O),加速自由基的生成,释放大量热,有机过氧化物在强酸碱介质中,甚至发生歧化反应[26]。因此,酸性或碱性催化剂的存在也会增大有机过氧化物的危险性。如过氧化甲乙酮的酸催化反应机理[27]见图3所示:
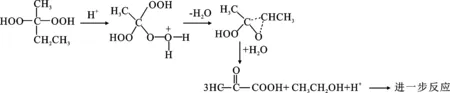
图3 过氧化甲乙酮的酸分解机理Fig.3 Acid decomposition mechanism of methyl ethyl ketone peroxide
我国有机过氧化物的合成,多采用无机酸作为催化剂,这使得收集到的产物呈酸性,需要用碱中和至中性,中和不当(过量或少量)都会使有机过氧化物显碱性或酸性,对有机过氧化物的稳定性存在安全隐患。Li等[27]采用微量量热仪(C80D)研究了不同浓度(1%,3%和5%)的硫酸对MEKPO的影响,结果显示,随着H2SO4浓度的增加,MEKPO的稳定性显著下降,T0接近环境温度。Tseng等[28]通过热反应检测仪(TAMⅢ)检测了纯BPO与硫酸、氢氧化钠混合的热动力及热危险参数,结果表明,BPO热分解遵循自催化反应模式,H2SO4的加入会降低BPO的稳定性,相反,NaOH能够提高BPO的稳定性。Chen等[29]利用DSC分别测试了80%的CHP、CHP(80%)与硫酸、氢氧化钠混合时的热分解过程,结果表明,当CHP分别与NaOH、H2SO4混合后,T0从80 ℃下降至40,53 ℃,说明CHP对氢氧化钠更敏感。
Chou等[30]利用DSC探讨了NaOH混入CHP后,T0从80 ℃下降至40 ℃,同时CHP的放热峰从单峰变为双峰,说明NaOH的加入会引发二次放热反应,危险性更大。Hou等[31]用DCS在异丙苯溶液中测量了80%的CHP与NaOH、t-BuONa、KOH、LiOH和NH3(水溶液)的热分解情况,由热分解曲线和数据可以看出,CHP与OH-混合后,T0显著降低,反应过程变得复杂,加剧了热危害性并增加了传递CHP的危险风险。
Tseng等[32]则利用DSC研究了MEKPO与HNO3、NaNO3的混合反应危险性,发现HNO3会显著提高MEKPO反应的危险性,而与NaNO3混合反应推迟,具有更高的稳定性。You等[33]使用DSC对95%的过氧化月桂酰(lauroyl peroxide,简称LPO)分别与1,2,6,12 mol/L的HNO3混合进行测试,结果显示,LPO与硝酸混合发生强烈的放热现象,12 mol/L HNO3在实验过程中有非常强的二次放热峰,表明发生二次剧烈反应,造成高度危害,并在分解产物中发现了爆炸性产物1-硝基十二烷。
近期,查飞课题组采用12-磷钨酸[34]催化制备的有机过氧化物,也存在产物呈酸性的困扰。因此,有机过氧化物混合酸碱物质的风险较大,应引起有机过氧化物稳定性研究者的广泛关注。
2.3 水分解
蒋慧灵等[35]利用绝热加速量热仪研究了TBPB在不同含水量条件下的放热情况,研究表明,少量的水可以加速TBPB的分解,随着含水量的增加,水的汽化吸收了反应系统的热量而对反应有一定的冷却和抑制作用。魏彤彤[36]研究了含30%水的BPO的热分解过程,结果同样显示,水的加入提高了BPO的自加速分解温度,并降低了热分解的剧烈程度。
王传虎[37]则研究了不同水质对过氧乙酸(PAA)的影响,检测表明,不同水质配制的过氧乙酸中,双蒸水的稳定性最好,去离子水、蒸馏水次之,地下水配制的稳定性最差,出现这种结果可能是与各种水中含有的不同的金属离子和杂质有关。金满平等[38]用C600微量量热仪测试了水对CHP的影响,其结果表明,随着水含量的增加,T0和最大放热温度(Tmax)呈U型曲线关系,混有20%左右含水量CHP的分解作用最明显。
2.4 有机过氧化物/有机物分解
何洁[39]使用加速量热仪(ARC)和快速筛选仪(RSD)探究了叔丁基过氧化氢(tert-butyl hydroperoxide,TBHP)分别与过氧化二叔丁基(DTBP)、BPO的混合热危险性,结果显示:TBHP和BPO的混合,出现了二次放热峰,危险性比TBHP和DTBP混合高。Lin[40]采用差示扫描量热法(DSC)探究了31%的MEKPO和99%的丙酮在3种加热速率下的放热情况,结果表明,丙酮可以提高MEKPO的Ea和T0,从反应的TMR图和数据也可以看出,丙酮明显降低了MEKPO的热危险性。Liu S H等[41]采用DSC和TAMⅢ探究了纯的BPO及与苯甲酸、苯、苯酚混合的热分解情况,结果表明,3种有机物都会增加BPO的热分解危险性。方将来等[20]探究了甲苯对BPO的热分解过程和危险性,由T0、Ea可看出,甲苯对BPO的分解起促进作用。
不同有机过氧化物混合,稳定性与其自身因素有关,混合后的有机过氧化物的稳定性,比单一的低;与其他有机物混合,可促进有机过氧化物的分解(除MEKP与丙酮的混合,会提高MEKP的稳定性)。
3 其它分解因素
有机过氧化物的稳定性除了与混有的杂质有关外,还与物料层厚度、罐径大小等因素有关。王慧欣[42]对DTBP的物料厚度展开研究,结果表明,物料层越厚,其SADT越低,越不利于存储和运输;黄艳军[18]采用C80微量量热仪探索了储罐内径对CHP稳定性的影响,结果显示,储罐内径越大,SADT越低;江美丽等[43]研究表明,储罐的壁厚及其内半径对有机过氧化物的SADT也有一定的影响。
4 有机过氧化物的稳定剂
在储运过程中,纯的有机过氧化物易分解,因此在运输和储存有机过氧化物时需添加稳定剂,减敏性的稀释剂成为首选。常用的稀释稳定剂有硅酸钠、8-羟基喹啉、碳酸钙、焦磷酸钠等,不同稳定剂对不同的有机过氧化物的作用效果不同,因此,不同有机过氧化物与稀释稳定剂的相互匹配也随之受到关注。王传虎等[37]在186 g/L的过氧乙酸中加入不同的稳定剂(尿素、EDTA、水杨酸、磷酸、顺丁烯二酸、8-羟基喹啉、焦磷酸钠),并在常温中储存180 d后检测,结果表明,8-羟基喹啉稳定作用最好,焦磷酸钠次之。魏彤彤[44]借助ARC检测了纯的过氧化环己酮以及加入等质量的4种有机物(邻苯二甲酸二辛酯、邻苯二甲酸二丁酯、环己醇、正己酸)后的热危险参数,结果显示,邻苯二甲酸二辛酯对过氧化环己酮的减敏效果最佳。
过氧乙酸(PAA)的稀释稳定剂不易配伍,赵勇[45]筛选了8-羟基喹啉、焦磷酸钠和自制的STB作为稳定剂,跟踪检测了在25 ℃日光照射条件下PAA的分解情况,结果显示,3种稳定剂都大大提高了PAA的稳定性,其中自制的STB效果最佳,过氧乙酸的平均日分解不到0.07%,月分解为2.2%。
刘雄民[46]采用小型密闭压力容器(MCPVT)跟踪测试了BPO-H2O、DCP-CaCO3、DTBP-IPS(石蜡油)、TBPB-IPS四种有机过氧化物有无稀释稳定剂的热反应压力效应,结果表明,挥发性的稀释稳定剂使分解产生的最大压力(Pmax)值增大,非挥发性的稀释稳定剂则能降低Pmax,但两类稳定剂均降低了热分解速度。
5 结束语
有机过氧化物中的 —O—O—键长而弱,极不稳定,遇热易分解,随温度升高,热分解加剧。有机过氧化物的热危险性研究手段主要是通过分解热动力学,获得动力学危险参数,其中QSPR法是一种有效的热稳定性模型。
金属、酸碱、水、有机物和有机过氧化物对有机过氧化物均具有催化分解能力,有机过氧化物在合成、运输和储存时可通过添加稳定剂和稀释剂监督其分解,增加安全性。
未来有机过氧化物危险特性的研究,可从物质结构性质出发,通过建模分析来弥补实验方法的不足,进一步减少事故发生。
