PD-L1基因rs2297136位点多态性对术后结直肠癌患者接受卡培他滨为基础辅助化疗预后的影响
2019-11-05张慧俭刘佃温周晓丽刘永刚刘世举
张慧俭,刘佃温,周晓丽,刘永刚,李 敏,刘世举
1.河南中医药大学针灸推拿学院,河南 郑州 450000;2.河南中医药大学第三附属医院肛肠外科,河南 郑州450000;3.河南省肿瘤医院普外科,河南 郑州 450000
目前结直肠癌在中国的发病率呈逐年上升趋势,每年新发病例为37.5万,死亡病例为19.1万[1]。近年来,结直肠癌靶向治疗领域进展迅速,不同作用靶点的药物给结直肠癌患者带来了不同的治疗选择。在抗表皮生长因子受体方面,西妥昔单抗显著降低患者进展风险[2]。在抗血管新生方面,贝伐珠单抗和瑞戈非尼的上市为患者带了进一步的生存获益[3]。在免疫治疗方面,派姆单抗为微卫星高度不稳定的患者带来新的治疗选择[4]。在辅助化疗方面,基于对IDEA研究的结果,低危的Ⅲ期结肠癌推荐3个月的XELOX辅助化疗方案[5]。这些不同的靶向药物和治疗模式都为患者带来了显著的生存获益。
卡培他滨为基础的辅助化疗方案经过研究证实可显著降低结直肠癌患者的术后复发风险[6]。然而,尚有很多影响该方案疗效的因素。近年来免疫检查点抑制剂成为肿瘤领域的新热点,尤其是2018年,纳武单抗在中国的上市给晚期非小细胞肺癌患者带来新的治疗希望[7]。程序性死亡配体1(programmed death-ligand 1,PD-L1)是近年来最热门的分子,已成为目前免疫治疗药物的重要靶点[8]。该基因编码的蛋白主要表达在肿瘤细胞表面,通过和激活的T细胞表面的PD-L1的结合后,抑制T细胞活性,引起T细胞凋亡,从而实现肿瘤细胞的免疫逃逸[9]。先前的研究表明,在多种肿瘤细胞中PD-L1均高表达,但是PD-L1的表达和患者的预后关系目前结论尚不统一[10]。
PD-L1基因位于染色体9p24.1,包含8个外显子。作为程序性死亡配体家族中的一员,PD-L1在不同肿瘤患者中的表达也会呈现较大的个体差异[11]。Xie等[12]的研究探讨了在肝癌患者当中,PD-L1基因遗传变异位点rs2297136的临床意义。研究结果提示,在肝癌患者中PD-L1基因的多态性位点与肝癌的易感性及预后均显著相关。然而,目前在结直肠癌辅助化疗领域,尚未见PD-L1基因遗传变异和预后的关联研究。
因此,本研究旨在评估PD-L1基因rs2297136位点对接受卡培他滨为基础辅助化疗的结直肠癌患者的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)的影响,并探讨该位点对结直肠癌组织中PD-L1基因mRNA表达水平的影响。
1 资料和方法
1.1 研究设计及入组患者基线临床资料
研究设计为回顾性分析,纳入2010年1月—2017年12月在河南省肿瘤医院普外科和河南中医药大学第三附属医院肛肠外科纳入接受手术切除治疗的结直肠癌患者。具体的入组标准包括:①年龄:18~80岁,美国东部肿瘤协作组(Eastern Oncology Cooperative Group,ECOG)评分在0~2分,心功能正常(左心室射血分数>50%),肾功能正常(肌酐≤1.5×ULN),骨髓功能正常(中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L,血红蛋白≥9 g/dL);②病理学诊断为结直肠癌患者且接受了手术切除治疗;③预期寿命至少3个月。排除标准为:①没有接受卡培他滨为基础辅助化疗的患者;②没有合适标本检测PD-L1基因遗传变异的患者;③家族性腺瘤性息肉病,其他遗传性结直肠癌综合征;④直肠癌患者后期接受放疗的患者;⑤失访的患者。最终,符合入排标准并纳入本研究的患者为213例。
接受卡培他滨为基础的辅助化疗,具体用法用量为:术后3~4周,卡培他滨,1 000 mg/m2,每天2次,第1~14天,每21 d为1个周期。奥沙利铂,130 mg/m2,静脉滴注,第1天。辅助化疗结合患者情况6~8个周期。根据治疗过程中出现的血液学或非血液学毒性调整相应的给药剂量,一旦发生可能威胁生命的毒性反应时治疗中止。本研究得到医院伦理委员会的批准。
1.2 血液样本收集DNA提取及基因分型
每位入组研究的患者在接受辅助化疗之前收集患者的外周血样本大约4 mL,用苯酚氯仿法提取基因组DNA,之后于-20 ℃保存。设计rs2297136位点的上下游PCR引物,对该位点及附近的DNA片段进行扩增,上游引物为:5’-GCTCCCTGTTTGACTCCATC-3’,下游引物为:5’-TTTTTCCCCAGACCACTTCC-3’,产物片段为274 bp,用TaqⅠ内切酶通过限制性片段长度多态性聚合酶链反应(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)方法对该位点进行基因分型。通过条带大小判断该位点的基因型。TT型1条条带:1条274 bp条带。TC型3条条带:1条274 bp条带,1条105 bp条带,1条169 bp条带。CC型2条条带:1条105 bp条带,1条169 bp条带。部分样本的分型结果通过直接测序的方法进行验证。
1.3 组织样本收集及PD-L1基因mRNA表达分析
纳入研究的部分患者在手术过程中收集每个患者被切除的结直肠癌癌组织标本,最终纳入79例癌组织标本,液氮保存。之后用TRIzol试剂进行RNA提取,采用罗氏诊断产品(上海)有限公司real-time PCR仪进行PD-L1基因mRNA表达分析,PD-L1基因的上游引物为:5’-CTTCCCGAGGCTCCGCACCA-3’,下游引物为:5’-GCCCCGATGAACCCCTAAAC-3’。实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)反应体系如下:SYBN Premix Ex Tag 溶液10 μL,PD-L1基因上游引物(20 μmol/L)0.2 μL,PD-L1基因下游引物(20 μmol/L)0.2 μL,ddH2O 7.6 μL,cDNA2 μL,反应体系总计20 μL,GAPDH mRNA 表达用作内参。PD-L1基因mRNA 用相对定量法2-ΔΔCt进行计算。
1.4 统计学处理
本研究当中所有的变量均采用SPSS统计分析软件进行(19.0版本)相应的统计分析。χ2检验分析多态性位点基因分型是否符合哈迪温伯格平衡。在基线临床资料当中,离散型的变量和rs2297136位点不同基因型的分布采用χ2检验,当数据较少时用Fisher精确检验。连续型的变量和rs2297136位点不同基因型的分析采用非参数Mann-WhitneyU检验。
通过Stata绘制Kaplan-Meier曲线比较不同基因型患者DFS和OS的差异,曲线间的差异用对数秩和检验进行比较。DFS为从手术日至疾病进展或任何原因导致的死亡(以先发生的计算),OS为从手术日至任何原因导致的死亡,未出现进展死亡的,截至末次随访记录。多变量分析时,对DFS构建采用COX风险比例模型,P<0.05为差异有统计学意义。
2 结果
2.1 入组患者基线临床资料
本研究入组的213例结直肠癌患者的基线临床资料如表1所示,纳入研究患者的中位年龄49岁,范围为18~80岁。男性患者122例(57.28%)。ECOG评分中0分患者151例(70.89%)。结肠癌和直肠癌分别130和83例。肿瘤分化方面,高中低分化患者分别为45、145和16例。肿瘤分期上,Ⅱ期患者45例,Ⅲ期患者168例。错配修复(mismatch repair,MMR)基因状态上,错配修复基因缺失(deficient mismatch repair,dMMR)患者12例,错配修复基因存在(proficient mismatch repair,pMMR)患者135例,无法评价患者66例。辅助化疗方面,接受卡培他滨单药辅助化疗患者52例,接受卡培他滨联合奥沙利铂辅助化疗患者161例。
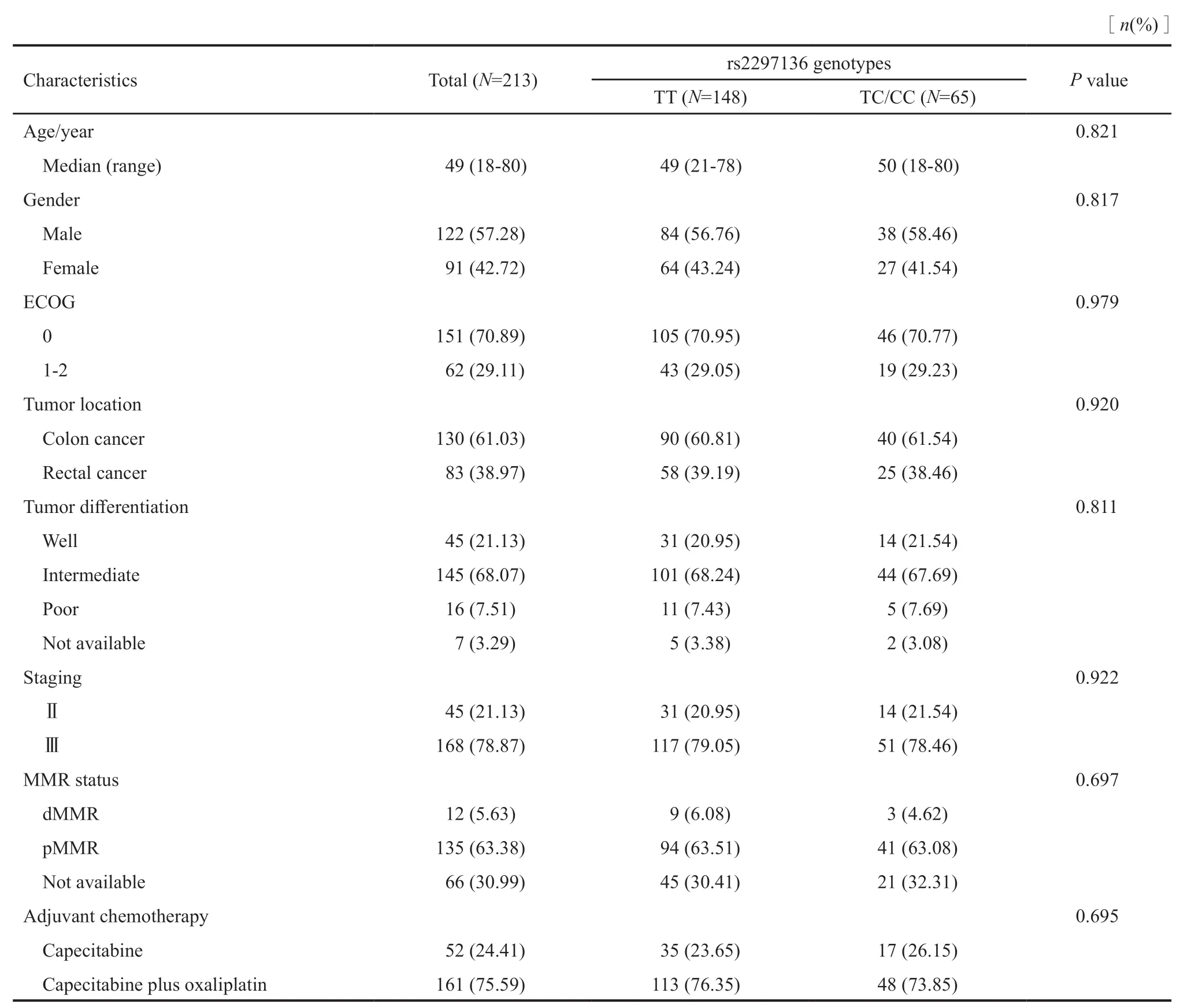
表1 213例结直肠癌患者的基线临床资料及rs2297136位点基因型分布比较Tab.1 Comparison of baseline characteristics of 213 colorectal cancer patients according to rs2297136 genotype status
Rs2297136位点的基因分型结果为:野生TT型148例(69.48%),TC型59例(27.70%),CC型6例(2.82%),最小等位基因频率为0.17,3种基因型分布频率符合哈迪温伯格平衡(P=0.967)。后期分析中把TC和CC基因型患者合并。该位点不同基因型患者在基线临床资料中的分布基本均衡(表2)。
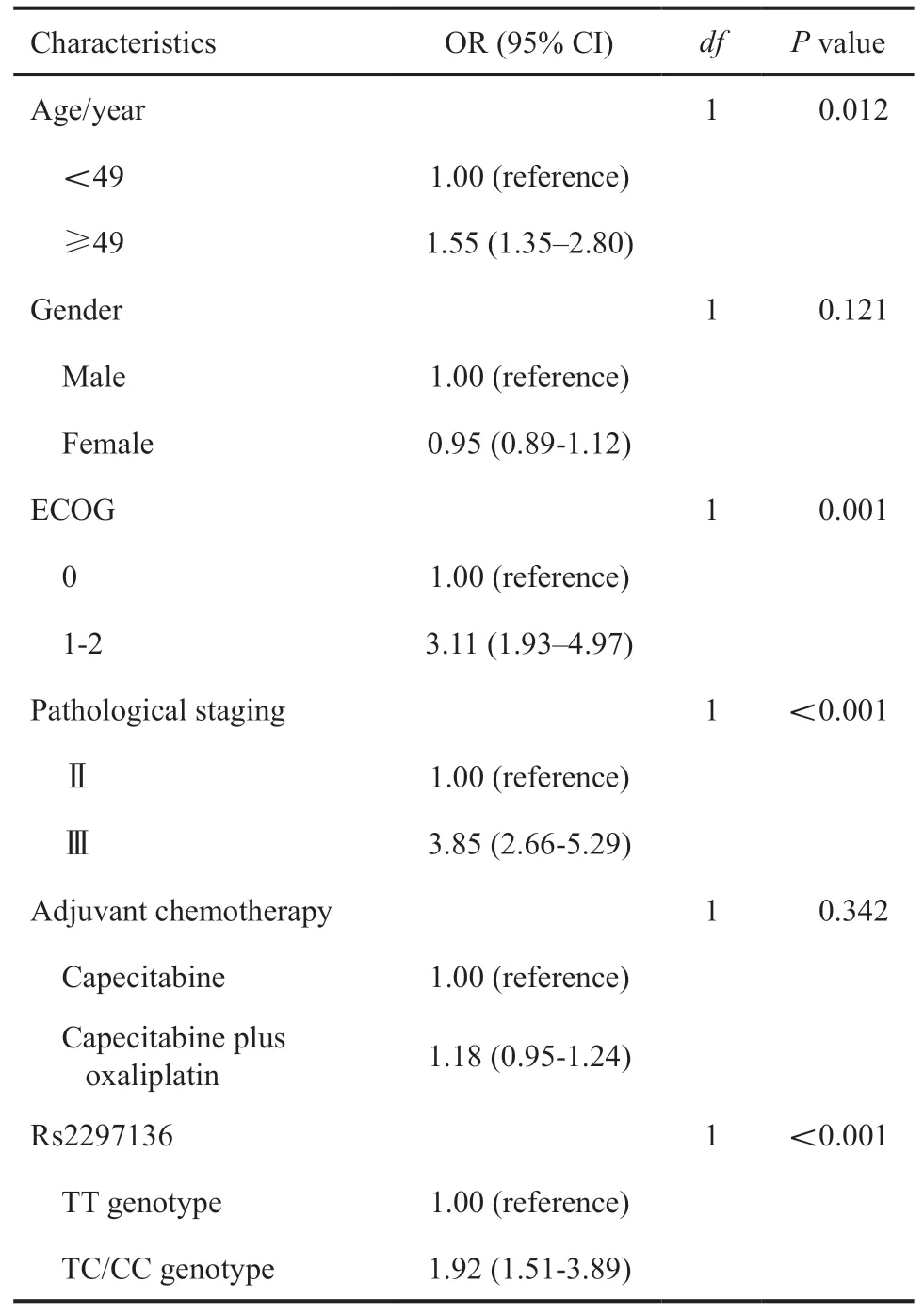
表2 构建的影响总生存期的基线临床资料和多态性位点的单因素分析Tab.2 Univariate analysis for OS according to other characteristics and polymorphism
2.2 PD-L1基因rs2297136位点对预后的影响
本研究最后一次随访时间为2018年6月,所有患者从纳入研究到最后一次随访的中位随访时间为65.4个月(随访时间7.2~90.0个月)。
纳入研究的213例患者均按时复查评估,整体人群的中位DFS为4.6年(95% CI:3.83~5.35),中位OS为6.5年(95% CI:5.74~7.27)。
将TC和CC基因型患者合并后,共计65例。在针对DFS的单变量分析中,野生型TT基因型患者和TC/CC基因型患者在DFS上明显不同,TT和TC/CC基因型患者的中位DFS分别为4.7和3.3年,差异有统计学意义(P=0.001,图1)。
在OS方面,两种基因型患者的中位OS分别为6.5和4.7年,差异有统计学意义(P<0.001,图2)。

图1 PD-L1基因rs2297136位点不同基因型的213例结直肠癌患者的DFS曲线对比Fig.1 DFS of the 213 colorectal cancer patients according to PD-L1 rs2297136 genotype status

图2 PD-L1基因rs2297136位点不同基因型的213例结直肠癌患者的OS曲线对比Fig.2 OS of the 213 colorectal cancer patients according to PD-L1 rs2297136 genotype status
为了进一步校正其他混杂因素的影响,本研究构建了COX风险比例模型,先进行了单因素分析。多变量分析时将单变量分析中差异有统计学意义的风险因素如年龄、ECOG评分、病理学分期及rs2297136位点纳入该模型。经过多变量校正rs2297136位点对OS独立的影响意义依然存在,差异无统计学意义(OR=1.89,P=0.006),其他的在COX模型当中差异有统计学意义的变量为年龄(OR=1.42,P=0.015)、ECOG评分(OR=2.21,P=0.005)和肿瘤分期(OR=2.98,P<0.001,表3)。
2.3 PD-L1基因rs2297136位点对PD-L1基因mRNA表达的影响
本研究收集了79例术后切除的结直肠癌组织标本并纳入表达分析。通过提取的RNA对PD-L1基因的mRNA表达情况进行探讨,并与rs2297136位点的基因型进行相关性分析。首先对79例癌组织标本进行了rs2297136位点的基因分型,其中TT型55例,TC型21例,CC型3例,3种基因型分布频率同样符合哈迪温伯格平衡(P=0.582)。TT型患者相对较少,同样将TT型和CC型患者合并,共计24例。Rs2297136位点不同基因型患者的PD-L1基因mRNA表达如图3所示,TC/CC型患者相对于野生型TT基因型患者,癌组织中PD-L1基因mRNA表达水平明显较高(4.08±1.21vs2.67±1.88),差异有统计学意义(P<0.001)。

表3 对OS构建校正其他变量的多变量Cox风险比例模型Tab.3 Multivariate COX regression analysis for OS according to other characteristics
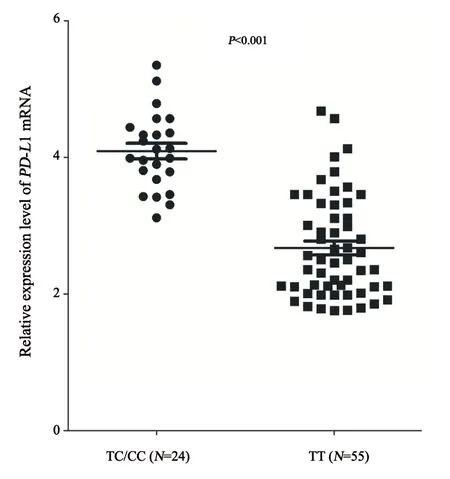
图3 PD-L1基因rs2297136位点不同基因型PD-L1基因mRNA表达情况对比Fig.3 Relative expression level of PD-L1 gene mRNA according to PD-L1 rs2297136 status
3 讨 论
本研究纳入了213例经过手术切除的结直肠癌患者,通过对PD-L1基因rs2297136位点基因分型并和患者的预后进行关联性分析,发现该位点携带C等位基因的TC/CC基因型患者相对于野生型TT型患者来说具有显著较差的DFS和OS,并通过79例癌组织标本的PD-L1基因mRNA表达水平分析发现了该位点不同的基因型患者的mRNA表达水平呈现较大的差异。rs2297136位点可能通过影响PD-L1基因的mRNA表达进而改变接受卡培他滨为基础辅助化疗治疗的结直肠癌患者的预后。
结直肠癌是异质性较强的恶性肿瘤,在临床治疗效果和预后上也有较大的个体差异[13]。目前已经有较多的可以预测结直肠癌疗效的生物标志物的研究成果:2018年报道的胸苷磷酸化酶(thymidine phosphorylase,TYMP)基因多态性对接受卡培他滨辅助化疗的结直肠癌患者疗效影响[14];2017年报道的亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)多态性对氟尿嘧啶疗效的影响[15];2016年报道的胸苷酸合成酶(thymidylate synthase,TS)多态性对结肠癌一线5-FU放疗效果的影响[16]。这些研究结果都提示了药物基因组学在结直肠癌疗效预测方面的价值。
本研究在中国首次报道了结直肠癌患者接受卡培他滨为基础的辅助化疗方案时,PD-L1基因rs2297136位点的C等位基因携带者可能通过影响该基因的表达,从而改变接受卡培他滨为基础辅助化疗的结直肠癌患者的预后。首先,本研究中rs2297136位点的最小等位基因频率为0.17,这和美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中中国人群中的突变频率一致,另外也与之前Xie等[12]的研究中rs2297136位点的分布频率基本一致。Xie等[12]的研究纳入225例肝癌患者和200位健康志愿者,通过对PD-L1基因上4个多态性位点进行基因分型。结果发现,rs2297136位点CC基因型与肝癌发生风险显著相关。另外,在该位点和肝癌患者预后分析方面,Xie等[12]的研究和本研究结果也基本一致。他们的研究结果也表明,rs2297136位点较少等位基因携带患者的预后较差。然而,他们的研究并没有深入探讨该位点和PD-L1基因表达方面的关联性。另外,Du等[17]的研究探讨了位于PD-L1基因的3’-UTR区域的多态性rs2297136位点对非小细胞肺癌的易感性的影响,荧光素酶报告实验的结果表明,rs2297136位点通过扰乱miR-296-5p、miR-138及PD-L1基因mRNA从而可影响非小细胞肺癌的易感性。他们研究的rs2297136位点的分布频率与本研究不太一致,可能是纳入研究的癌种差异,这在Xie等[12]纳入的肝癌患者的研究中也初步提示有类似趋势。然而Du等[17]的研究并没有继续探讨rs2297136位点不同基因型患者的PD-L1基因表达情况。
另一方面,PD-L1是目前肿瘤免疫治疗领域的热点基因,多项免疫治疗的临床研究结果显示,PD-L1的表达水平可以预测PD-1和PD-L1抑制剂的疗效[18]。然而,在PD-L1基因表达水平和接受常规化疗的结直肠癌患者预后的关联上,目前尚存在较大的争议。本研究结果初步表明PD-L1基因mRNA高表达的人群在接受卡培他滨辅助化疗时具有较差的预后,这与之前Enkhbat等[19]的研究结果是一致的。他们的研究纳入了116例手术切除的Ⅱ期和Ⅲ期的结直肠癌患者,分析了PD-1和PD-L1表达水平的相关性以及和预后的关系,发现PD-L1高表达的人群预后较差。然而,另一方面也有很多研究结果发现,PD-L1基因编码的蛋白主要表达在肿瘤细胞表面,通过和激活的T细胞表面的PD-1的结合后,抑制T细胞活性,引起T细胞凋亡,在体内的作用还有一些尚不清楚。然而,也有部分临床研究的结果表明PD-L1高表达人群患者的预后较好[20]。这些结果可能和纳入研究样本的异质性,接受辅助化疗等情况相关,总之还需要进一步的深入研究。
总之,本研究发现了在中国结直肠癌人群当中PD-L1基因rs2297136位点是一个独立的预后影响因素。当然,本研究也有部分局限性,首先纳入研究的样本量不大,没有在大样本当中评估该位点的预后指导意义。另外,研究为回顾性分析,有一些偏倚无法避免。不过本研究还是比较充分地对rs2297136位点的预后影响意义进行了评估,同时也从PD-L1基因mRNA表达层面去揭示了该位点造成预后差异的部分原因,对结直肠癌患者预后的指导具有临床指导意义。
