青萝卜晚抽薹性状回交转育及FLC2第1内含子PCR扩增检测
2019-11-05刘春香刘春霞向春玲曹红祥常天利尹晨霖
刘春香,隋 铭,刘春霞,向春玲,曹红祥,常天利,尹晨霖
(潍坊学院 生物与农业工程学院,“十三五”山东省高等学校生物化学与分子生物学重点实验室,山东 潍坊 261061)
潍坊青萝卜又称为潍县青,品质优,秋茬栽培的潍县青作为地理标志名牌产品,深受欢迎。潍县青萝卜易于抽薹,早春栽培风险大,在周年供应方面成了限制因素。在晚抽薹育种方面,徐文玲等[1]育成的北选潍青2号是具备潍县青特点的适合山东各地进行秋冬、冬春设施保护地栽培的改良品种,抽薹率比对照降低23%,但仍有22.7%的抽薹率。目前,选育的早春萝卜主要是白萝卜[2]。针对地方品种改良,经典的育种方法就是回交,适合单基因或主效基因控制的性状[3-4],或存在标记的数量性状[5],虽然周期长,最终是可以实现育种目标的。
萝卜抽薹相关基因的调控是复杂的[6],有报道认为萝卜抽薹性状受主基因控制[7],并且第1对主基因对抽臺时期的控制较高。为了寻找对耐抽薹有影响的基因,张素君[8]在极耐抽薹材料中克隆获得一个成花座位C基因(Flowering locus C,FLC)的cDNA全长,与早抽薹FLC序列间存在15个碱基的差异。黄丹琼[9]对多个不同抽薹特性萝卜品系RsFLC基因序列的分析发现FLC基因的内含子区存在变异,其中在内含子1和内含子2中存在与植株材料抽薹特性显著相关的插入-缺失型差异区域,与晚抽薹性状密切相关,但没有报道序列及序列长度。白菜中鉴定了4个FLC基因[10-11],在萝卜中有2个FLC[12]。越来越多的研究证实FLC2成为抽薹开花时期的关键基因[12-13]。FLC蛋白不仅会对拟南芥的开花产生抑制作用,而且在其他开花植物成花的过程中也起到关键的调控作用[14]。如白菜[15]、花椰菜、油菜[16]中FLC功能也已得到验证[17]。FLC是成花转变的枢纽基因[18],大量的报道认为FLC2是影响抽薹期早晚的首选QTL位点[19-20]。通过FLC过量表达,可使植物晚开花[20],延长营养生长期。重要的与开花相关的基因FT[21]、FD、SOC、LFY、FLD、VRN等都与FLC存在一定的关系[22]。未春化的植株FT等产物甚至可以通过嫁接春化过的砧木实现开花[23]。
萝卜自然群体中存在基因多态性,点突变、插入缺失等可以引发抽薹期改变,FLC2编码框的插入引发的翻译提前终止可以引发早花[10, 24]。白菜内含子区的长插入序列可以引发晚抽薹[25]。低温途径通过抑制FLC2的表达实现成花转变,该过程中SVP蛋白与FLC互作[26-27],抑制成花相关基因FT的表达,植物通过了春化才能解除抑制,促进FT表达[28],向成花转变。
栽培上的低温萝卜很难克服,因此,低温途径促进开花需要从基因水平控制。长日照(赤霉素途径)促进开花,早春栽培正是日照逐渐变长的过程,也很难从栽培上克服。本研究以早春白萝卜为晚抽薹基因源,从2013年起,将晚抽薹性状按照质量性状转育的方式转到潍县青萝卜上,并研究了FLC2基因第1内含子区,探索FLC2第1内含子区是否存在多态性,以及多态性与抽薹期的关系。试验过程意外发现春化时间对FLC2扩增的影响,本研究在回交转育萝卜的过程中,以探索FLC2基因内含子区PCR检测的条件及应用为目标,为萝卜晚抽薹育种提供参考。
1 材料和方法
1.1 回交供体、轮回亲本及常规选育过程
本研究以改良地方品种潍县青萝卜的春季抽薹特性为目标,以晚抽薹的西星白玉春萝卜(由登海种业邓永林先生提供)为晚抽薹基因源,于2013年以潍县萝卜为父本,进行杂交;2014年进行F1自交,2015年F2花期进行晚抽薹性及皮色、根型的选择,入选植株以潍县青萝卜为轮回父本进行回交,连续回交3代,至2018年回交3代的萝卜花期进行自交或姊妹交,选择晚抽薹性好,其他性状符合潍县青萝卜特点的植株种子为材料,于2018年6月采收种子。
1.2 F2晚抽薹株群FLC2基因的PCR扩增分析
在NCBI上检索萝卜FLC2基因序列(在GenBank上的编号: GI: 756809027),用Primer Premier 5.0分别进行引物设计,命名时基本按照在基因上的位置命名(图1)。引物对1的序列和名称如下,上游序列S379:5′-TTCTCCAAACGACGCAGT-3′,下游序列为a1599:5′-GGCTTTAAGATCATCAGCATG-3′;引物对2的上游序列S484:5′-TCTCCAAACG ACGCAGTGGTCTCAT-3′,下游引物a1704:5′-TCAT CAGCATGTTGTTTTCCATATCG-3′。以上述2对引物进行基因组FLC2基因区间见图1,扩增的群体主要是晚抽薹入选植株和轮回亲本植株。扩增条件:PCR扩增反应采用25 μL体系,其中萝卜DNA模板浓度平均为30 ng/μL,加1 μL,2×Taq酶混合液(ExTaq酶)12.5 μL,上下游引物(10 μmol/L)各0.5 μL,混合于1管,加蒸馏水补至25 μL。PCR扩增程序为预变性94 ℃ 10 min;94 ℃ 30 s,退火引物对1是52.8 ℃ 30 s,引物对2是60.5 ℃,延伸72 ℃ 2 min,35个循环;后延伸72 ℃ 10 min。对扩增产物进行电泳,检测结果。
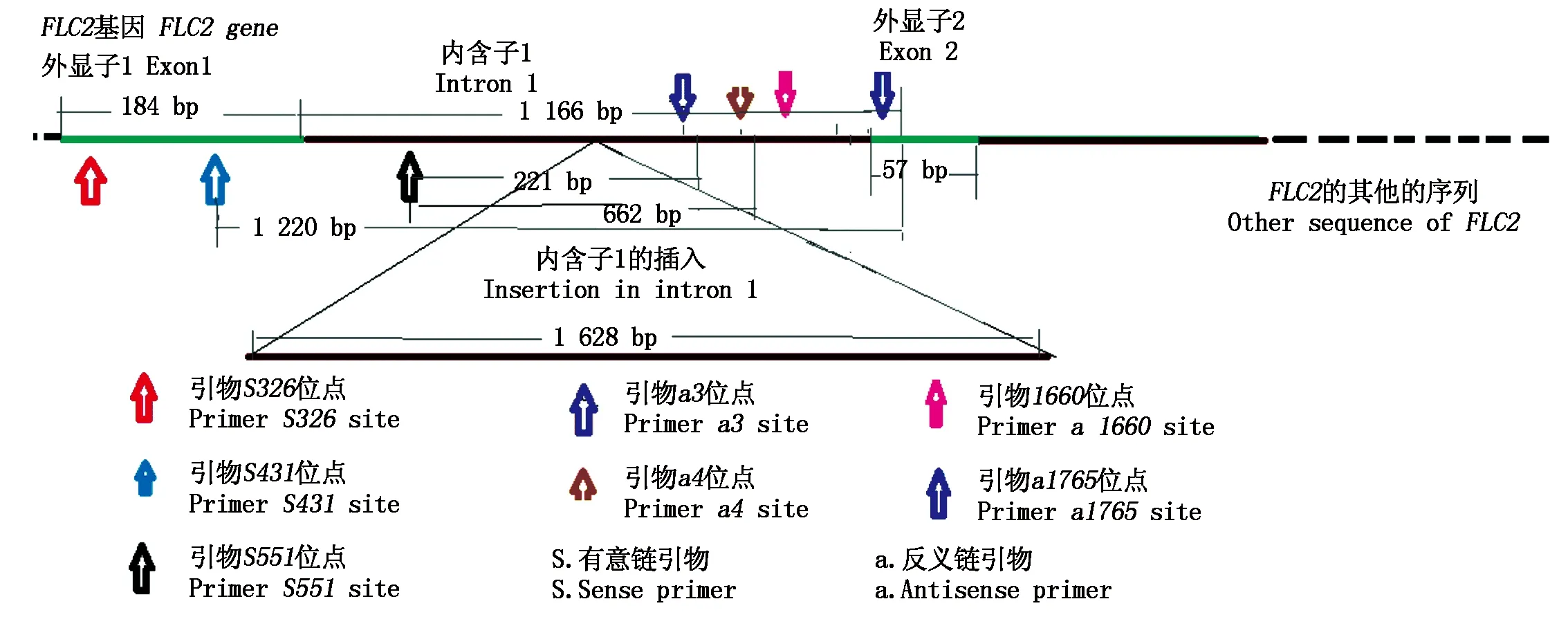
图1 FLC2基因上的引物位置Fig.1 Primer sites on FLC2 gene
1.3 多态性片段的克隆和测序
对F2中高频出现的扩增产物长片段和轮回亲本的扩增产物短片段进行TA克隆,克隆菌落进行双向测序和序列拼接(委托上海生工生物技术公司),对测序结果在NCBI数据库进行Blast比对,分析多态性的序列特征。并利用DNAStar的序列比对软件进行两序列比较。
1.4 将FLC2第1内含子的多态性作为参考检测其与抽薹性的关系
按照CTAB法对F2分植株进行基因组DNA提取,PCR扩增采用1.2中的引物对2进行。调查植株抽薹期,以花臺高约2 cm作为抽薹的标准,分析PCR扩增多态性与抽薹的关系。
1.5 回交群体和部分晚抽薹自交群体经春化处理后FLC2第1内含子的检测
通过对回交种子和少部分晚抽薹自交种子进行催芽,对幼苗进行12,36 d的4 ℃低温春化处理,处理后于3月中旬定植到潍坊学院温室,分别进行抽薹期的调查和FLC2第1内含子多态性分析,5月初结束抽薹统计。取处理后和抽薹期的植株叶片,采用CTAB法分别进行基因组DNA提取,PCR扩增,扩增方法同上。定植后开始统计各植株的抽薹期。
1.6 春化处理后对FLC2内含子区扩增的检测
重新对FLC2第1内含子区插入序列两端设计引物,其中引物对3与引物对4上游序列是一致的,为S604,序列: 5′-ACCAGAATGAGGAAGAACA-3′,引物对3下游序列a3为: 5′-AACATCAAGTCTGCG TCA-3′;引物对4的下游序列a4为5′-ATCAATG GCTGCACAAT-3′。用来对试验材料进行PCR扩增检测,扩增区间如图1所示。同时,对DNA质量进行抽检,抽检引物从萝卜基因组中随机选择了一段序列,P1: 5′-TGTGATTTATACAGCTTCCATAT-3′,P2: 5′-AGAACTTGCCTTCCTTGA-3′,扩增产物700 bp左右。
于2018年进行试验,对照1为西星白玉春,基因型为内含子有插入突变和无插入突变的杂合型,对照2为轮回亲本潍县青,FLC2基因第1内含子为野生型;其他为回交1代后代。萝卜的处理方式:植株长至两叶一心时定为春化0 d,此后放在保鲜柜中4 ℃处理12,24 d,处理结束的当天每个单株取少量叶片提取DNA;处理后继续低温至通过春化,之后定植到田间,抽薹开花期取臺梗或果荚皮提取DNA,单株编号,分别提取;提取方法仍为CTAB法,试验所选样品为后期晚抽薹的杂合型植株,淘汰早抽薹植株DNA。PCR反应体系同上,引物对3扩增条件为预变性94 ℃ 10 min;94 ℃ 30 s,退火52 ℃,延伸72 ℃ 2 min,35个循环;后延伸72 ℃ 10 min。DNA质量检测扩增条件同引物对4,引物对4的扩增条件仅退火温度降为50 ℃,其他不变。
2 结果与分析
2.1 回交转育过程的抽薹期分析
尽管萝卜抽薹期表现为数量性状,为了将晚抽薹相关基因转化到潍县青萝卜中,本研究最初采用回交-自交结合的模式进行晚抽薹性状的转育,本研究发现,轮回亲本潍县青萝卜50%植株抽薹时间为3月5日;供体亲本西星白玉春抽薹50%植株抽薹时间为4月6日。2015年F2出现了明显的性状分离现象,商品性一般,入选植株晚抽薹性较好,平均抽薹时间为4月14-19日,从图2可见入选的4株萝卜在5月2日有2株还没有开花。说明F2部分晚抽薹植株性状可优于亲本西星白玉春,显著好于轮回亲本潍县青。
按照数量性状的转育方法,如没有辅助选择手段,每一代需要富集影响抽薹的各种基因,采用回交后自交或高世代选择,这样会延长育种进程。本研究根据植物开花已有的报道,选择成花枢纽基因FLC2作为关注的主效基因,对F2及回交世代进行基因型检测,探索其基因型对抽薹的影响,对以后的回交世代选择起了一定作用,每次回交后不用再自交。

图2 F2部分入选晚抽薹植株及对照在5月2日的抽薹开花Fig.2 Part of flowering of selected plants from F2 generation and control plant on May 2nd
2.2 萝卜FLC2基因外显子1和外显子2间基因组扩增结果
通过对萝卜FLC2基因的部分序列进行扩增,发现该基因有一定的扩增难度,引物对1不能扩增出理想的结果(S379、a1599),而引物对2(S484、a1704)能够有效扩增出产物,且产物的大小不一致,从图3可以看出,对照潍县青萝卜扩增带1 220 bp,而晚抽薹植株都是扩增出2 848 bp的产物。由此可知,在不同萝卜基因组DNA上FLC2基因存在序列长短的差异,即多态性。这种差异需要通过克隆测序才能明确产生的原因。而且需要验证这种差异是否与抽薹性密切相关。
2.3 萝卜FLC2扩增多态性片段的克隆和序列比对分析
通过将目的扩增产物克隆到pMD18-T载体,转化大肠杆菌,获得了阳性转化子,对2个不同的插入片段分别选择2个阳性转化子进行测序,测序结果显示,同一大小的片段间序列是一致的,从图4可以看出,小片段的FLC2基因内含子与大片段内含子的上游和下游都是一致的,只是在中间从320-1 949位置有一个1 628 bp的插入序列。
将这个插入序列在https://blast.ncbi.nlm.nih.gov/Blast.cgi上进行比对分析,发现基本没有完全一致的已知序列,在甘蓝基因组序列中,存在同源性较高(83%)的约900 bp的同源性片段,该片段功能尚未鉴定。其次是欧洲油菜中有约712 bp同源性85%的mRNA序列,而从920-1 500 bp间没有任何相似的序列。由此可知,这个长内含子是由插入突变引起的,插入位置在第1内含子的中部,并不影响FLC2基因的编码序列,可导致内含子序列和长度发生变化,片段应与十字花科植物序列有亲缘关系。

图3 两对引物FLC外显子1到外显子2间基因组扩增结果Fig.3 Genomic amplification results of two pairs of primers on FLC from exon 1 to exon 2

图中粗线为省略部分,该部分2个序列间是一致的;三角号表示内含子插入序列的起点和终点。The bold dotted lines in the figure are omitted sequences, and the two sequences are consistent; The triangle indicates the beginning and end of insertion sequences on the first intron.
2.4 插入突变基因型与晚抽薹的关系
通过对2015年所有晚抽薹植株的PCR扩增分析得出(表1):有85.71%的晚抽薹植株含有纯合的FLC2插入突变序列(2 848 bp扩增带),有92.86%较晚抽薹植株含有杂合或纯合的插入突变序列(2 848,1 220 bp共存或纯合2 848 bp)。说明晚抽薹株普遍表现出含有插入突变序列的带型。2015年由于在花期仅存少量入选的晚抽薹植株和潍县青花粉供体株,样本量较少,为了进一步确定其作为晚抽薹筛选标记的可靠性,2016年进一步进行晚抽薹性PCR检测,扩增结果见表2,从表2可以看出,经过花期检测的基因型为纯合插入突变的植株全部是晚抽薹(85.7%)和较晚抽薹(14.3%)的,另有部分植株最终没有抽薹,PCR检测结果不清晰,没有参与统计;纯合野生型(潍县青,扩增产物1 220 bp)没有晚抽薹植株,全部是早抽薹(81.1%)和较晚抽薹(19.0%)。基因型为杂合型的主要是较晚抽薹的(78.3%)。说明FLC2的基因型与抽薹早晚关系很密切。值得一提的是这些结果必须基于花期的检测,苗期和春化未完成时期的检测有时带型是不全的。要以这一特征作为抽薹早晚的选择标记需进一步探索其适用的条件。
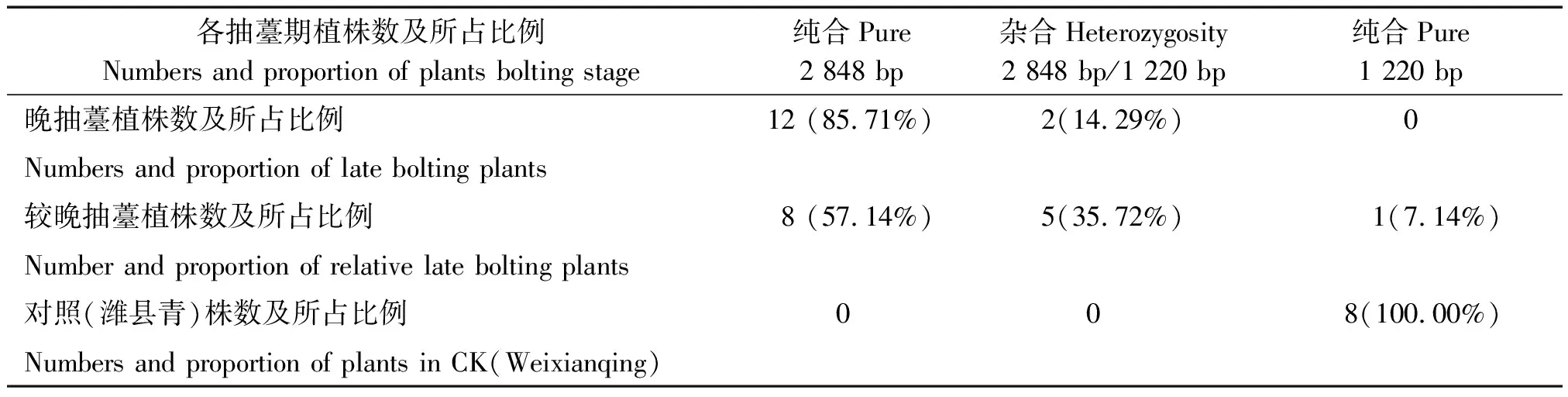
表1 2015年插入突变带型与抽薹统计Tab.1 Statistics of insertion mutation zone type and bolting plants on 2015

表2 2016年萝卜PCR检测到的插入突变带型与抽薹期比例的关系Tab.2 The relationship between insertion mutation by PCR detection and bolting stage ratio on 2016 %
2.5 春化处理对扩增的影响
利用引物对2进行PCR扩增,期望通过不同春化时间处理获得不同育种材料抽薹期的特征,并检测抽薹早晚与扩增结果间的关系,进一步明确晚抽薹与FLC2插入突变的关系。从表3可以看出,春化处理36 d对扩增有明显影响,1 220 bp带(野生型,WT)多数植株能够扩增出来,有部分植株不能得到扩增产物;而春化处理12 d的植株则完全不能扩增出1 220 bp的WT带型,仅在部分植株中能够扩增出2 848 bp的带。说明苗期春化处理对引物对2扩增FLC2基因结果是有明显影响的,短期春化主要影响野生型FLC2内含子的扩增,长时间春化主要影响插入突变型FLC2的扩增。花期扩增则多数植株都可以得到正常结果,与实际基因型相符,且抽薹期极晚接近5月抽薹的植株100%都是纯合插入突变基因型。

表3 萝卜在2种春化天数下各基因型的PCR检测带型及抽薹早晚Tab.3 The counts and ratio of bolting time and PCR amplification products of radish under two different vernalization days
注: 早春定植后植株依赖自然低温大部分最后开花,部分植株最终也没有开花,无法检测基因型,不参与统计。
Note: Most of the plants depend on natural low temperature to blossom finally after planting in early spring,some plants do not bolting at last so they can not be detected genotypes and can not be counted.
2.6 春化处理对内含子区扩增的影响
春化处理会影响FLC2基因的扩增结果,且引物对2扩增难度大,为了降低扩增难度,对已经测序的内含子区重新设计引物,经过筛选引物对3的扩增效果较好。为了验证春化对PCR扩增FLC2的影响,需要对DNA质量进行检测,并对2种基因型未经春化处理植株的引物扩增效率进行检测,从图5可知,春化24 d的基因组DNA对扩增萝卜育性相关基因RSRF是没有影响的, 都有产物。未经春化处理的萝卜DNA扩增引物对3可以扩增出CK1(杂合)的2条带和CK2(纯合野生型)的1条带,由此可以确定引物、酶和DNA都是正常可用的。

图5 检验萝卜春化24 d DNA质量的RSRF基因扩增结果Fig.5 RSRF gene amplification results of radish after vernalization 24 d for DNA quality detection
通过引物对3对FLC2第1内含子基因型为杂合型的不同春化时期萝卜单株DNA进行PCR扩增,结果见图6,从图6可以看出,春化0 d和抽薹开花期,萝卜植株基本能够检测到杂合型特征,即产物为双带,而春化24 d主要影响插入突变内含子序列的扩增,87%的植株无理想扩增结果,有些WT带的扩增效果也受影响;同样基因型,在苗期,尤其是抽薹或开花期该有的带型基本能扩增出来。春化12 d则野生型带(小带)扩增效果不好,插入突变型(大带)也受到一定的影响。经过引物对4扩增以上材料也表现了相似的特征(图7),即春化24 d几乎全部插入突变带型扩增均受影响,有时会额外出1条小带;春化12 d有的出2条带,有的出1条,有的1条也扩增不出来。由此可以看出,引物更换虽然可以改变扩增效率,但不能完全克服春化的影响。

M.DL2000分子质量标准;CK1.未处理的西星白玉春;CK2.未处理的潍县青;1-15.FLC2的杂合基因型植株。
M.Molecular Marker DL2000;CK1.Uncontrolled Baiyuchun;CK2.Uncontrolled Weixianqing;1-15.Plants with heterozygous genotype onFLC2.
图6 不同春化时期萝卜FLC2第1内含子用引物对3的扩增结果
Fig.6 Results of the first intron amplification of radishFLC2by primer pair 3 in different vernalization periods
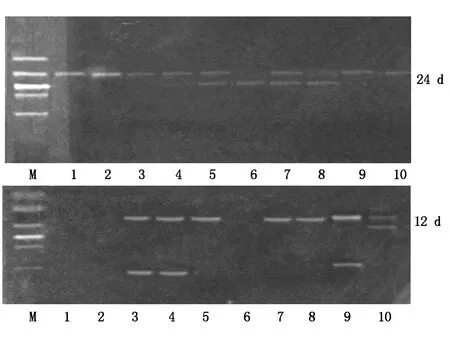
M.DL2000分子质量标准;1-10.FLC2的杂合基因型植株。M. Molecular Marker DL2000; 1-10. Plants with heterozygous genotype on FLC2.
2.7 FLC2第1内含子多态性的适宜检测时期及选种应用
获得FLC2第1内含子多态性信息,且该多态性显著影响回交材料的抽薹时期,杂合型较晚抽薹,纯合突变型晚抽薹,育种上可以结合示意图(图8)来进行转育和筛选。
由于扩增结果的最佳检测时期是臺花期,苗期淘汰结果有时不够可靠,不适合苗期筛选。在回交育种中,回交转育后需要一步自交,有利于基因纯合,在选择自交后代是否基因型为纯合时,可以通过扩增检测纯合插入突变基因型,从而确保该等位基因(FLC2内含子区基因型为纯合插入突变)后代不发生分离,确保晚抽薹稳定性。
通过臺花期检测,可以明确晚抽薹是由FLC2基因第1内含子插入突变引起,还是其他影响抽薹的作用因素引起,从而指导育种上的选择,实现非等位基因的累加。经过选择的回交3代植株普遍性状符合潍县青萝卜特征,且早春抽薹期平均比对照晚30 d左右。
3 结论与讨论
FLC2基因是成花转变的枢纽基因[18],植物通过抑制FLC2基因的表达实现成花转变[12],萝卜与拟南芥在春化途径上具有相似性[29]。有研究认为,FLC2表达的抑制作用主要在FLC2的启动子到第1内含子区[17, 30-31],因此,本研究也选用该区域作为检测对象,并发现了在FLC2第1内含子区存在一个长插入突变,长度约1 600 bp,没有影响内含子的边界,因此,该插入突变并不影响FLC基因的编码序列,这种长插入在其他十字花科植物中也有[32],油菜FLC2上游一个621 bp的插入引发冬性增强[33],白菜中有报道发现了一个5 kb的插入突变,最终导致延迟抽薹开花[25],与本研究的结果类似,说明在FLC2内含子区的长插入序列的确有延迟抽薹开花的作用。

斜体表示必需进行检测,非斜体表示可以检测。×表示淘汰,表示自交。 Italics font indicates that it must be detected, and non-italics font indicates that it can be detected. ×denotes elimination, and denotes self-bred.
FLC2基因内含子区的长度差异是本研究育种材料的主要差异,因此,围绕长短内含子的检测可以预知材料是否含有导致晚抽薹的序列存在。黄丹琼[9]也报道了FLC2基因扩增长度的差异,并认为与抽薹早晚关系密切,可以将FLC2作为分子标记[18],与本研究基本一致;本研究虽与其采用的育种资源不同,但效果是相似的,重要的是在利用FLC2基因内含子长度作为标记进行筛选时遇到了困难。通过进一步的春化处理研究,发现仅通过改进引物是很难实现理想扩增的,本研究为了对该内含子区进行扩增,设计了多对引物,通过引物对3在苗期和开花期基本可以实现正常扩增。然而,春化阶段则受到明显影响,说明春化阶段模板DNA的状态较为复杂。有研究认为,FLC2基因的抑制是通过对启动子到第1内含子区进行大量的修饰,包括组蛋白甲基化[34-36]、非编码RNA结合[37]、DNA甲基化[38]、组蛋白去乙酰化[28,39]、蛋白复合体结合等多种作用,期间涉及了FT[21-22,40]、FLD[14,40]、VIN等多种蛋白及蛋白复合体的作用[41]。这些修饰蛋白或结合蛋白可能通过苯酚-氯仿抽提并不能去除干净,也可能其间有作用力较强的键难以通过有机溶剂变性分开。2017年Kim等[42]报道发现FLC基因所在染色体在春化阶段会因长链非编码RNA作用而成环,成环会影响DNA作为模板的功能。具体是什么机理导致PCR扩增困难有待进一步研究。
本研究发现,同样一株萝卜的DNA,在不同阶段FLC2第1内含子扩增难度不同,对引物对2,春化12 d野生型的扩增困难,而春化36 d插入突变扩增难度较大,推测短期春化,DNA上的修饰作用主要发生在野生型FLC2第1内含子上,而较长时间的春化可能引发了插入突变型内含子区的大量修饰。然而,前人并未报道模板修饰会对DNA扩增产生影响,因此,本研究采用了不同年度不同批次的多次试验,每次都能发现春化对扩增的不良影响。最容易扩增的时间段为抽薹开花期,2种内含子都能较好地实现扩增,可能与抽薹开花期FLC2的正常表达(修饰作用被解除)有关[15,43]。苗期扩增需要引物合适,引物不适合苗期扩增结果也不够可靠。如果复杂的修饰影响PCR扩增效率,通过扩增效率反过来估计模板DNA的修饰状态可能也是值得探索的问题。
晚抽薹的影响因素较多[7,20],本研究所采用的亲本基因源较为单一,采用回交转育转有插入突变的FLC2基因型,抽薹这一数量性状的转育因而可以按照质量性状的转育方法进行[4],到回交的最后一代,需要对有FLC2内含子插入突变的基因型进行纯合,这时,标记检测可以明确预知后代的基因型,从而避免后代发生性状分离。如果进一步加强晚抽薹性育种,可以通过检测插入突变等位基因是否纯合判断其对晚抽薹的贡献,从而衡量其他基因的贡献力,实现对晚抽薹有贡献的其他基因的累积。
