牛磺酸颗粒微生物限度检查方法适用性试验研究及市场质量考查
2019-11-04阎雅宁郭福庆曹晓云
阎雅宁,郭福庆,曹晓云
(天津市药品检验鉴定研究院,天津 300070)
牛磺酸颗粒作为一种内源性氨基酸,是中枢抑制性递质,能调节神经组织兴奋性,亦能调节体温,故有解热、镇静、镇痛、抗炎、抗风湿、抗惊厥等作用。并有提高肌体非特异性免疫的功能,其主要成分为牛磺酸,收载于《中国药典》2015年版二部[1]。按照《中国药典》2015年版四部通则1105和1106进行计数方法和控制菌检查法的适用性试验和检查[2],需氧菌总数、霉菌和酵母菌总数采用平皿法、大肠埃希菌采用常规法进行了检查。本文对来自全国的17个生产企业的47批次样品进行检验,对检验结果进行统计分析并对该药品的微生物污染情况进行评价。
1 仪器与试药
1.1仪器 SG-403生物安全柜(美国Baker公司),ADS161SMU超净工作台(日本Yamato株式会社),MLS-378IL压力蒸汽灭菌器(松下健康医疗器械株式会社),SANYO MIR-254恒温培养箱(日本三洋株式会社),SANYO MIR-554恒温培养箱(日本三洋株式会社),BINDER KB720恒温培养箱(德国宾得)。
1.2标准菌种 金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、铜绿假单胞菌[CMCC(B) 10104]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]、大肠埃希菌[CMCC(B)44102]均购自中国食品药品检定研究院,由本院传代保存。
1.3培养基和稀释剂 胰酪大豆胨琼脂培养基(TSA)、沙氏葡萄糖琼脂培养基(SDA)、胰酪大豆胨液体培养基(TSB)、麦康凯液体培养基、麦康凯琼脂培养基均购自北京陆桥技术有限责任公司;pH 7.0无菌氯化钠-蛋白胨缓冲液购自北京三药有限责任公司。以上培养基均通过了适用性和灵敏度的检查。
1.4样品 微生物限度检查样品来自17个生产企业47批次。选取其中A、F、J三个厂家样品进行方法学适用性试验。
2 方法和结果
2.1微生物限度检查方法学适用性试验
2.1.1菌液制备 参照《中国药典》2015版四部通则1105和1106有关规定制备菌悬液[3]。
2.1.2供试液制备 取供试品10 g,加pH 7.0无菌氯化钠-蛋白胨缓冲液稀释至100 ml,震荡混匀,制成1∶10供试液。
2.1.3需氧菌总数、霉菌和酵母菌总数 菌液组:取适量浓度的0.1 ml金黄色葡萄球菌菌液加pH 7.0无菌氯化钠-蛋白胨缓冲液稀释至10 ml,混匀,制成菌含量<100 cfu/ml的菌悬液,吸取1 ml至平皿中,立即倾注TSA培养基,测定菌落数结果为A。同法制备铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的菌悬液。样品对照组:取“2.1.2”项下1∶10供试液1 ml,注入平皿中,立即倾注TSA培养基。测定样品中的菌落数,结果为B。验证组:平皿法,取“2.1.2”项下的1∶10供试液9.9 ml,加入已配制的0.1 ml金黄色葡萄球菌液,制成菌含量<100 cfu/ml的供试液,取1 ml至平皿中,立即倾注TSA培养基,结果为C。同法制备含铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉的供试液,测定菌落数。验证组回收率R=(C-B)/A。根据《中国药典》2015年版四部通则1105规定[3],R值应在0.5~2范围内。若各试验菌的回收试验均符合要求,所用的供试液制备方法及计数方法适用于该样品的需氧菌总数、霉菌和酵母菌总数计数。
2.1.4控制菌检查方法适用性试验 试验组:取1∶10供试液10 ml和规定量大肠埃希菌(不大于100 cfu)加入100 ml的TSB中。阳性菌对照组:取规定量大肠埃希菌(不大于100 cfu),加入100 ml的TSB中。阴性对照组:取稀释液10 ml加入100 ml的TSB中。上述培养物分别置于32.5 ℃培养18 h。取培养物1 ml接种至100 ml麦康凯液体培养基中,43 ℃培养24 h。然后将上述培养物划线接种于麦康凯琼脂培养基平板上,32.5 ℃培养18 h。观察是否有菌落生长,以及菌落大小、形态特征,判断是否检出大肠埃希菌。
2.2 结果
2.2.1需氧菌总数、霉菌和酵母菌总数、大肠埃希菌检查方法学适用性试验结果 在47批次样品的17个生产厂家中选取A、F、J三个厂家的样品(批号6717005、161103、20161101),按照“2.1.3”项下平皿法进行需氧菌总数适用性试验,5种菌的回收率均在0.5~2范围内,符合《中国药典》要求;按照“2.1.3”项下常规法进行霉菌和酵母菌总数适用性试验,白色念珠菌和黑曲霉的回收率均在0.5~2范围内,符合《中国药典》要求。试验结果见表1。
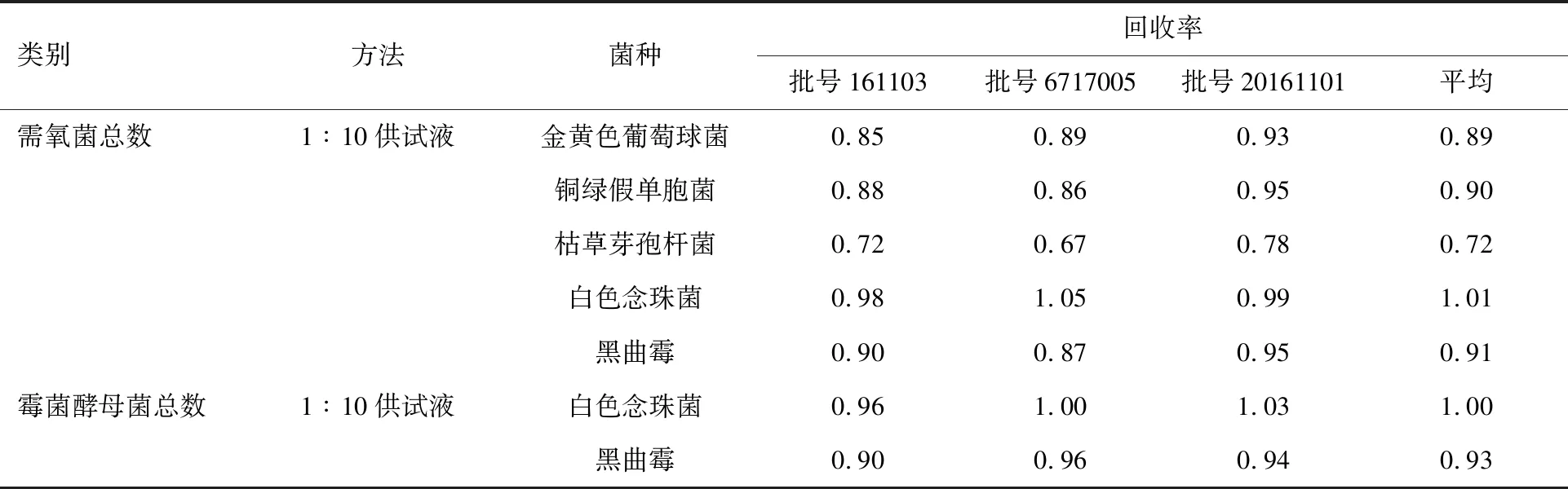
表1 需氧菌总数、霉菌和酵母菌总数方法学适用性试验结果
2.2.2控制菌(大肠埃希菌)的方法学适用性试验结果 如表2所示。3个批次的试验结果表明:试验组与阳性菌对照组结果一致,说明加入的阳性菌生长良好。所采用的试验方法适用于该控制菌的检查。

表2 大肠埃希菌方法学适用性试验结果
注:+表示平板表面有菌生长或液体培养基变浑浊;-表示平板表面无菌生长或液体培养基澄清。
2.2.347批次样品微生物限度检查结果及分析 牛磺酸颗粒的微生物限度按照《中国药典》2015年版四部通则1107要求,即“1 g供试品中,需氧菌总数不得过103cfu,霉菌和酵母菌总数不得过102cfu。1 g供试品中不得检出大肠埃希菌”。 按照“2.1”项下的方法学适用性试验方法对47批样品进行微生物限度检查,结果见表3。
47批次样品的检验结果显示,厂家E生产的批号为160901的样品需氧菌总数为3.6×103cfu/g,霉菌和酵母菌总数为2.6×102cfu/g,均超过《中国药典》2015版规定的限度值,不符合规定;厂家A生产的批号为6717004、厂家B生产的批号为20160501、厂家C生产的批号为17022341和厂家D生产的批号为151108的4批样品需氧菌总数均在10~100 cfu/g,但小于103cfu/g,符合《中国药典》规定;剩余42批次样品的需氧菌总数均<10 cfu/g,符合《中国药典》规定。
对47批次的需氧菌总数结果进行统计分析,其中需氧菌总数X>103的有1批次,约占2%;101≤X<102的有4批次,约占9%;X<101的有42批次,约占89%。
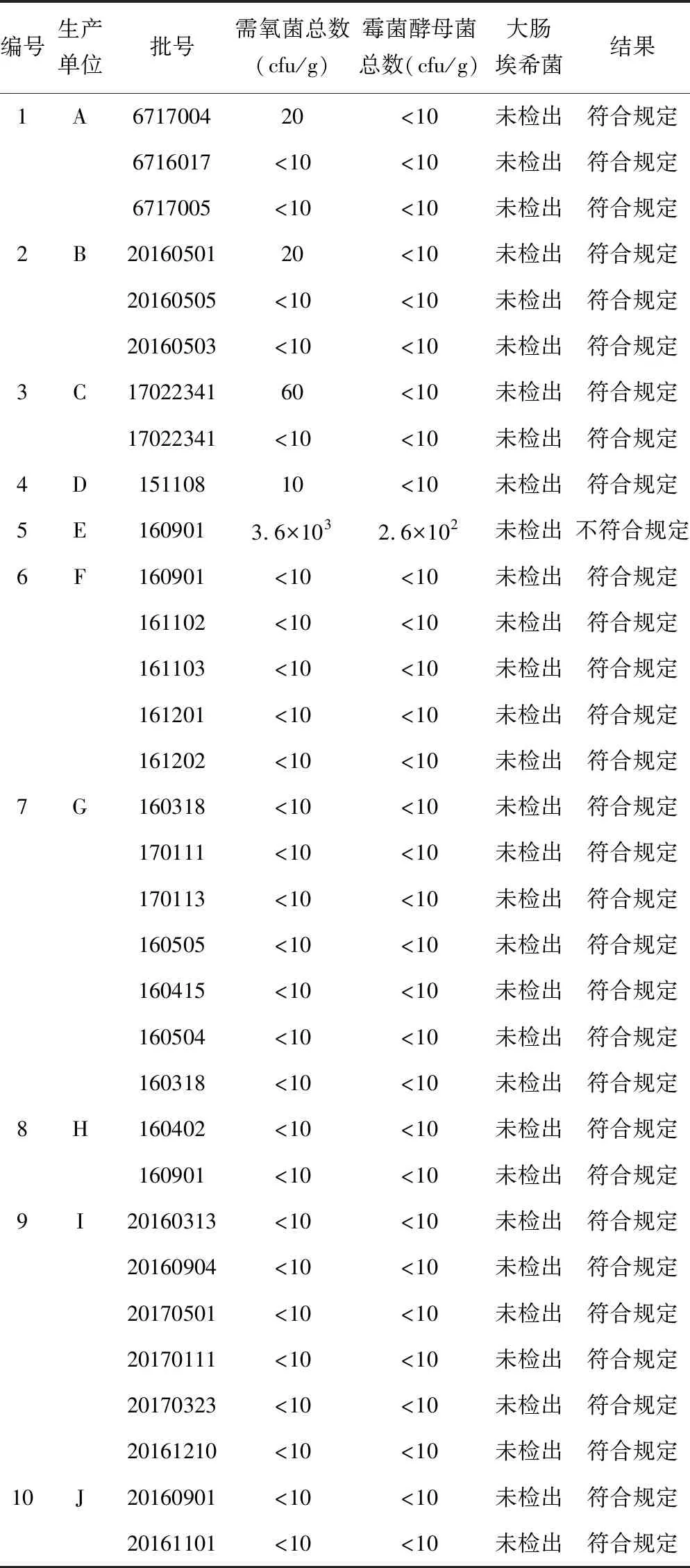
表3 47批次样品的检验结果

续表3
3 讨论
3.1《中国药典》2015年版未将微生物限度分列于各品种项下,附录中的试验较为笼统宽泛,由于受不同药品的成分、处方、制剂工艺等因素的影响,因此《中国药典》2015年版规定各品种的微生物限度检验方法依然要进行适用性试验,以确保所采用的方法适合于该药品的需氧菌总数、霉菌和酵母菌总数及控制菌的测定。本试验对3个不同生产厂家的3 批样品进行了微生物限度的适用性试验,确保试验方法准确可行,并用确立的方法对牛磺酸颗粒进行微生物限度检查。
3.2《中国药典》未对化学药口服固体制剂的微生物限度检查做强制规定,企业应建立自己的内控标准。虽然不是法检项目,但微生物限度检查结果不符合规定,产品也是不合格的。为了对牛磺酸颗粒质量全面考查,此次评价性抽验进行了微生物限度检查,共抽样47批样品,涉及17家生产企业,占全国批准生产企业的34.7%;其中4批次来自生产单位,1批次来自使用单位,42批次来自经营单位;涉及17个批准文号,占全国批准文号的28.8%。
3.3此次检查结果显示,抽自赤峰某经销公司厂家E生产的批号为160901的样品中需氧菌总数、霉菌和酵母菌总数均超过《中国药典》2015年版给出的限度范围,不符合规定。由于仅抽取了厂家E一个批次即不合格,此次抽验该厂家的不合格率为100%,其他批次的结果如何需要厂家进一步筛查,并应加大市场监督频次。此次检查结果还显示,厂家C共抽取两批次样品,批号相同均为17022341,一个抽自国药某公司,一个抽自安徽某公司,抽验结果显示:抽自国药某公司的需氧菌总数为60cfu/g,抽自安徽某公司的需氧菌总数为<10cfu/g。虽然生产批号相同,但是来自不同的经营单位,检验结果不相同,那么微生物的污染来源还需要进行进一步的分析。微生物污染是药品质量评估的重要指标,也是药品质量控制的重要组成成分[4],非无菌制剂允许微生物的量在一定的限度内,原材料、包装、加工、设备仪器、生产环境、人员操作、流通、储存等各个环节都可能是药品中微生物存在的来源。该生产企业应仔细寻找并分析可能存在的污染环节。
4.4其他16个生产厂家的检验结果显示样品的需氧菌总数、霉菌和酵母菌总数、大肠埃希菌均符合《中国药典》规定,表明此次国家评价性抽验的生产企业的牛磺酸颗粒在制备、工艺、生产及流通的各个环节质量相对稳定,其结果在一定程度上反映出目前国产牛磺酸颗粒微生物污染情况,结果较满意。
