草莓果实查尔酮异构酶基因克隆及表达分析
2019-11-04蔡雯婷董文华刘晓言董清华
蔡雯婷,孙 娟,董文华,刘晓言,董清华
(农业应用新技术北京市重点实验室/北京农学院 植物科学技术学院,北京102206)
随着草莓Fragaria×ananassa果实的成熟, 果皮中花色素苷大量积累最终呈现红色[1]。花色素苷属于类黄酮化合物,广泛存在于植物果实表皮细胞的液泡中[2]。查尔酮异构酶(chalcone isomerase,CHI,EC 5.5.1.6)是花色素苷合成的关键酶和限速酶,该酶(CHI)和查尔酮合成酶(CHS)两者一起协同调控花色素苷合成,CHI参与查尔酮的异构化并催化查尔酮(Chalcone)生成柚皮素(Naringenin),经过其他酶的催化最终形成花色素苷[3,4,5]。CHI基因作为花色素苷合成的结构基因[6],其表达量的高低直接影响植物花色或果实着色,因此CHI基因调控机制的研究对于了解草莓花色素苷形成的分子机理有着重要意义。
查尔酮异构酶是最先从大豆中发现[7],1987 年从法国菜豆(Phaseolusvulgaris)中克隆获得CHI基因[8],目前该基因已在烟草[9]、矮牵牛[10]、番茄[11]、芍药[12]、黄花蒿[13]、苹果[14]等多种植物中被克隆。在红果、黄果两种森林草莓(Fragariavesca)转录组数据中,与红果草莓相比,FvCHI基因表达量在黄果草莓中下调,该基因表达量与花色素苷的积累呈正相关[15]。‘红颜’草莓属于光敏感型草莓,果实中FaCHI基因随着透光率的降低而表达量下降,说明‘红颜’草莓果实着色与FaCHI密切相关[16]。
目前草莓中CHI基因多在转录组中发现其表达量的差异与花色素苷合成有关,但未见报道有关八倍体草莓的FaCHI基因克隆与表达等研究。本研究利用前期不同颜色的‘红颜’草莓果实转录组筛选出在着色期表达量显著的差异基因,即FaCHI,本试验从‘红颜’草莓中克隆FaCHI基因,通过生物信息学分析和在草莓着色过程中的实时荧光定量分析,初步探明查尔酮异构酶基因在草莓花色素苷合成过程中的作用。
1 材料与方法
1.1 试验材料
植物材料:以种植于北京市大兴区长子营镇和莓庄园的八倍体‘红颜’草莓果实为研究材料,采集花后14 d大绿果,花后19 d大白果、花后25 d转色果、花后28 d全红果,将果实去籽后液氮速冻,保存-80 ℃冰箱备用,用于RNA提取。
试剂盒:植物RNA提取试剂盒(OMEGA,China)、反转录试剂盒(全式金,北京)、Q5 High-Fidelity DNA Polymerase(博迈德生物,北京)、琼脂糖凝胶DNA回收试剂盒(Axygen,China)、T1-simple载体(全式金,北京)、大肠杆菌Trans1-T1克隆感受态细胞(全式金,北京)、2×Taq PCR MasterMix(博迈德生物)、质粒提取试剂盒(Axygen,China)、TransStart Top Green qPCR SuperMix荧光定量试剂盒(全式金,北京)。
1.2 试验方法
1.2.1 RNA提取和反转录cDNA 草莓果实(大绿期,白果期、转色期、全红期)总RNA提取参照OMEGA植物RNA提取试剂盒方法,利用反转录试剂盒(全式金公司,北京)将提取的RNA 反转录成cDNA。
1.2.2 克隆FaCHI基因 根据前期草莓转录组提供的基因序列与NCBI的BLAST数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对得到编码序列信息,获得完整的FaCHI基因序列(Genbank Number:AB201754.1)。设计引物Forward primer:5’-ATGGCTCAATCAGTCACCGGAA-3’;Reverse primer:5’-TCATGCCTTGTTTTCTGCTTCCTT-3’。PCR扩增体系参考Q5 High-Fidelity DNA Polymerase说明书,反应条件98 ℃预变性30 s;98 ℃变性10 s;55 ℃退火30 s;72 ℃延伸1 min;循环数35;72 ℃延伸2 min。将PCR产物电泳检测目的条带,将正确位置的目的片段使用Axygen琼脂糖凝胶DNA回收试剂盒提取目的基因,回收目的基因的产物连接T1-simple载体,转入Trans1-T1感受态细胞,挑选阳性单菌落用2×Taq PCR Master Mix酶PCR检测,挑选正确位置的条带的菌落培养,提取质粒进行测序(上海生工生物工程有限公司北京测序部),测序成功样品于-80 ℃保菌待用。
1.2.3FaCHI基因生物信息学分析 利用BLAST 对克隆的目的序列进行同源比对,分析其功能保守结构域;使用DNAMAN对该基因进行氨基酸序列的分析;筛选适宜物种后通过MEGA5.1构建进化树。
1.2.4FaCHI基因实时荧光定量分析 提取‘红颜’草莓果实的4个时期的总RNA,反转录合成cDNA备用。设计荧光定量引物FaCHI-Forward primer:5’-AAAGATCAGACCTTCCCACC-3’;FaCHI-Reverse primer:5’-AATCACCGCATTCCCAAC-3’,以草莓FaAPI作为内参基因,FaAPI-Forward primer:5’-GGCCCAACGACAATTATTACTG-3’;FaAPI-Reverse primer:5’-AACCACAGTCTTGCATTCTTGACT-3’。参考TransStart Top Green qPCR SuperMix荧光定量试剂盒说明书,使用10 μL体系于实时荧光定量PCR仪(瑞士Roche Light Cycler 96)检测该基因表达水平。扩增程序:94 ℃,10 min;94 ℃,30 s;56 ℃,20 s;72 ℃,20 s;循环数40。数据采用 2-ΔΔCT法分析基因表达量,每个样品3个生物学重复。
2 结果与分析
2.1 FaCHI基因的克隆和分析
以cDNA为模板,经PCR扩增,得到清晰的条带(图1)。目的片段回收纯化,经连接转化、测序拼接等过程,得到FaCHI基因开放阅读框714 bp,编码氨基酸237个(图2)。使用DNAMAN与八倍体草莓基因编码的氨基酸序列(Genbank Number: Q4AE12.1)比对,相似度97.90%;氨基酸相似度97.89%。
2.2 草莓FaCHI基因的生物学分析
使用Expasy-ProtParam在线分析显示,蛋白相对分子量为25.4 kD,理论等电点(pI)为5.31,脂肪族氨基指数为80.63,亲水平均系数为(GRAVY): -0.118。通过NCBI Conserved Domain Search对FaCHI进行功能域预测,发现查尔酮合酶(chalcone synthase, CHS)超家族保守序列(图3),该家族编码多种重要的酶,可以催化和合成植物次生代谢产物,具有不同的结构和生物活性[17]。
进化树分析表明(图4),FaCHI基因在进化上具有明显种属特性,FaCHI氨基酸序列与同为草莓属的八倍体草莓(Fragaria×ananassa,Q4AE12.1)
图1 FaCHI基因扩增Fig.1 The PCR product in FaCHI gene

图2 FaCHI 基因的核苷酸序列及氨基酸序列Fig.2 Nucleotide sequence and amino acid sequence of FaCHI gene

图3 FaCHI保守结构域分析Fig.3 Conserved domains of FaCHI
和二倍体草莓(Fragariavescasubsp.Vesca,XP_004307451.1)亲缘关系最近;与蔷薇属的玫瑰(Rosarugosa,AKT71851.1)、月季(Rosachinensis,XP_024176829.1)、蔷薇(Rosahybridcultivar,AYU56554.1)的亲缘关系较近,以上草莓属与蔷薇属聚为一个分支;与同为蔷薇科李属的吉野樱(Prunusyedoensisvar.nudiflora,PQQ16500.1)、欧洲酸樱桃(Prunuscerasus,AJO67976.1)、桃(Prunuspersica, XP_007218371.1)、紫叶李(Prunuscerasifera,AKV89240.1)、欧洲甜樱桃(Prunusavium,XP_021813821.1)、梅(Prunusmume,XP_008233532.1)聚为另一个分支,亲缘关系次之。
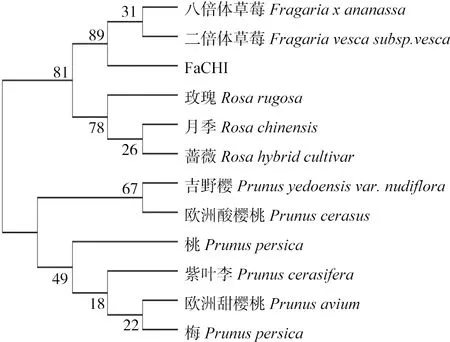
图4 FaCHI系统进化树分析Fig.4 Phylogenetic tree analysis of FaCHI
2.3 FaCHI基因在草莓着色过程中的表达分析
利用qRT-PCR技术对FaCHI基因在草莓果实大绿、白果、转色、全红4个时期的相对表达量进行测定(图5)。结果显示,FaCHI基因在草莓大绿时期(花后14 d)到白果时期(花后19 d)表达量下调,随着果实颜色的加深表达量逐渐升高,全红时期(花后28 d)表达量最高。
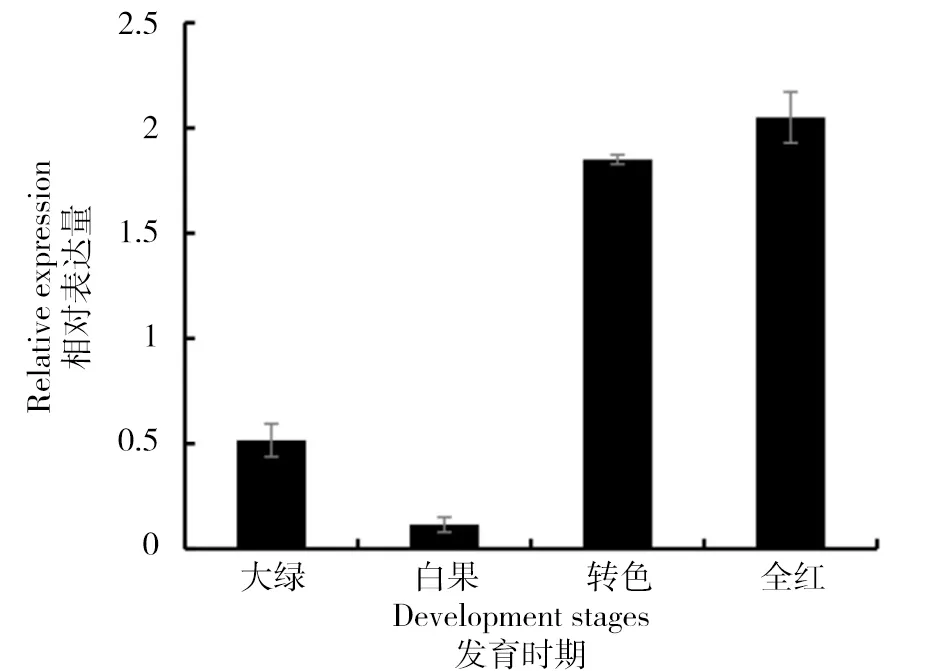
图5 ‘红颜’草莓果实大绿、白果、转色、全红4个时期中FaCHI相对表达量Fig.5 Relative expression level of FaCHI in four stages of 'Benihoppe' strawberry fruits: big green, white, partially red and full red
3 讨 论
前人的研究证实了查尔酮异构酶是花色素苷合成途径早期的关键酶之一,其表达的效率直接影响到植物花和果实的色泽和质量[18]。在森林草莓转录组的分析和‘红颜’草莓遮光处理中发现查尔酮异构酶基因调控草莓花色素苷的合成,同时印证了在草莓中该基因与花色素苷的积累呈正相关这一结论[15,16]。最新研究表明,对不同品种栽培草莓的3个果实发育阶段进行转录组分析,高花色素苷品种中FaCHI基因表达量要高于低花色素苷品种,并且该基因表达趋势都是随着果实的成熟,表达量趋势上升[19]。这一重要作用揭示了FaCHI基因是控制草莓果实花色素苷合成的关键酶。研究查尔酮异构酶基因,有利于从分子层面调控草莓花色素苷等类黄酮化合物的形成。
本研究成功克隆出八倍体草莓FaCHI的全长基因,开放阅读框的大小为714 bp,编码237个氨基酸。通过与NCBI上所刊载的其他植物的氨基酸序列进行相似性比对,发现CHI基因具有较高的同源性,根据结果生成的进化树可以清楚的发现八倍体‘红颜’草莓CHI 蛋白序列和蔷薇科的草莓属与蔷薇属植物的CHI蛋白序列相似度比较高且聚为一类,而梅、吉野樱、桃和甜樱桃等李属果树相似度聚为一类,产生这一现象的原因有两方面,一是CHI蛋白在不同植物间的同源性一般为42%~65%[20],同一类型植物的CHI的氨基酸同源性可达70%以上[21];二是月季、玫瑰等蔷薇属植物属于园林景观植物,在驯化方向上更关注于花色差异,而欧洲甜樱桃、桃等蔷薇科李属植物属于经济林,其驯化方向大多是针对果实的大小,含糖量多少等方面,对花色方面研究不多[22]。
通过对草莓果实4个时期的实时荧光定量分析,FaCHI基因在果实的全红期表达量最高,证实了查尔酮异构酶基因在草莓花色素苷合成过程中起重要作用。本试验中FaCHI基因在大绿期到白果期表达量降低,这一时期草莓果实膨大,果实颜色由绿变白,说明该基因在大绿时期基因启动表达,积累黄烷酮底物(Flavanone),而白果期表达量降低,推断积累的反应底物黄烷酮发生反馈抑制使该酶活性降低[23],转色期作为果实着色期,此时FaCHI基因表达量开始升高,到全红时期果实成熟期表达量最高,说明FaCHI基因在果实发育阶段后期即草莓着色时期的表达量相对较高,因而在成熟果实中产生了花色素苷的积累[24]。与苹果中CHI基因在未成熟果实的酶活性较高,在中间期下降,成熟后上升,成熟果实的酶活性不同于未成熟果实中高的结论一致[14]。
本试验成功分离了八倍体草莓的FaCHI基因,并对该基因在草莓发育过程中的表达特性进行了研究,为进一步研究该基因的功能及其在草莓花色素苷合成途径的调控和表达机制的研究提供依据,但该基因在草莓花色素苷合成上的作用机制还需进一步借助于基因敲除技术和转基因技术的验证。
